Dendrotoxin
Dendrotoxiner är en klass av presynaptiska neurotoxiner som produceras av mamba -ormar ( Dendroaspis ) som blockerar särskilda undertyper av spänningsstyrda kaliumkanaler i neuroner , och därigenom ökar frisättningen av acetylkolin vid neuromuskulära förbindelser . På grund av sin höga potens och selektivitet för kaliumkanaler har dendrotoxiner visat sig vara extremt användbara som farmakologiska verktyg för att studera strukturen och funktionen hos dessa jonkanalproteiner .
Funktionella effekter i nervsystemet
Dendrotoxiner har visat sig blockera särskilda undertyper av spänningsstyrda kaliumkanaler (K + ) i neuronal vävnad. [ Citat behövs ] I nervsystemet kontrollerar spänningsstyrda K + -kanaler excitabiliteten hos nerver och muskler genom att kontrollera vilomembranpotentialen och genom att repolarisera membranet under aktionspotentialer . Dendrotoxin har visat sig binda Ranviers noder hos motorneuroner och blockera aktiviteten hos dessa kaliumkanaler. På detta sätt förlänger dendrotoxiner varaktigheten av verkanspotentialen och ökar acetylkolinfrisättningen vid den neuromuskulära förbindelsen, vilket kan resultera i muskelöverspänning och konvulsiva symtom.
Dendrotoxin struktur
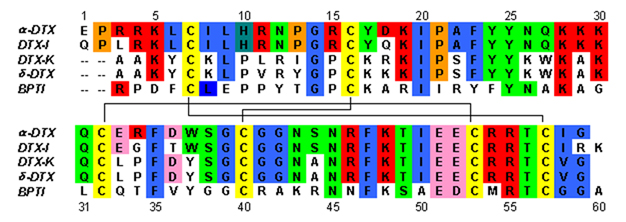
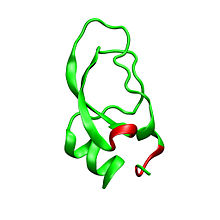
Dendrotoxiner är ~7kDa proteiner som består av en enda peptidkedja på cirka 57-60 aminosyror . Flera homologer av alfa-dendrotoxin har isolerats, alla har en något annorlunda sekvens. Den molekylära arkitekturen och vikningskonformationen hos dessa proteiner är dock mycket lika. Dendrotoxiner har en mycket kort 3 10 -helix nära peptidens N-terminal , medan en tvåvarvs alfa-helix förekommer nära C-terminalen . Ett tvåsträngat antiparallellt β-ark upptar den centrala delen av molekylstrukturen. Dessa två β-strängar är förbundna med en förvrängd β-svängregion som anses vara viktig för proteinets bindningsaktivitet. Alla dendrotoxiner är tvärbundna av tre disulfidbryggor , som tillför stabilitet till proteinet och i hög grad bidrar till dess strukturella konformation. Cysteinresterna som bildar dessa disulfidbindningar har bevarats bland alla medlemmar av dendrotoxinfamiljen och är lokaliserade vid C7-C57, C16-C40 och C32-C53 (numrering enligt alfa-dendrotoxin) .
Dendrotoxinerna är strukturellt homologa med serinproteashämmare av Kunitz -typ , inklusive bovin pankreatisk trypsinhämmare (BPTI). Alfa-dendrotoxin och BPTI har visat sig ha 35 % sekvensidentitet såväl som identiska disulfidbindningar. Trots den strukturella homologin mellan dessa två proteiner verkar dendrotoxiner inte uppvisa någon mätbar hämmande proteasaktivitet som BPTI. Denna förlust av aktivitet verkar vara resultatet av frånvaron av nyckelaminosyrarester som producerar strukturella skillnader som hindrar nyckelinteraktionerna som är nödvändiga för proteasaktiviteten som ses i BPTI.
Dendrotoxiner är basiska proteiner som har en positiv nettoladdning när de finns i neutralt pH . De flesta av de positivt laddade aminosyraresterna av dendrotoxiner är belägna i den nedre delen av strukturen, vilket skapar en katjonisk domän på ena sidan av proteinet. Positiv laddning resulterar från lysin (Lys) och arginin (Arg) rester som är koncentrerade i tre primära regioner av proteinet: nära N-terminalen (Arg3, Arg4, Lys5), nära C-terminalen (Arg54, Arg55) och vid det smala β-svängområdet (Lys28, Lys29, Lys30). Man tror att dessa positivt laddade rester kan spela en avgörande roll i dendrotoxinbindande aktiviteten, eftersom de kan skapa potentiella interaktioner med de anjoniska ställena (negativt laddade aminosyror) i kaliumkanalernas porer.
Biologisk aktivitet
Farmakologi
En enda dendrotoxinmolekyl associerar reversibelt med en kaliumkanal för att utöva sin hämmande effekt. Det föreslås att denna interaktion förmedlas av elektrostatiska interaktioner mellan de positivt laddade aminosyraresterna i dendrotoxinets katjoniska domän och de negativt laddade resterna i jonkanalporen . Kaliumkanaler, liknande andra katjonselektiva kanaler, tros ha ett moln av negativa laddningar som föregår öppningen till kanalporen som hjälper till att leda kaliumjoner genom permeationsvägen. Det antas allmänt (men inte bevisat) att en dendrotoxinmolekyl binder till anjoniska ställen nära den extracellulära ytan av kanalen och fysiskt blockerar poren, vilket förhindrar jonkonduktans. Imredy och MacKinnon har emellertid föreslagit att delta-dendrotoxin kan ha ett off-center bindningsställe på sina målproteiner och kan hämma kanalen genom att förändra strukturen av kanalen, snarare än att fysiskt blockera poren.
Biologiskt viktiga rester
Många studier har försökt identifiera vilka aminosyrarester som är viktiga för att binda aktiviteten hos dendrotoxiner till deras kaliumkanalmål. Harvey et al. använde restspecifika modifieringar för att identifiera positivt laddade rester som var avgörande för dendrotoxin-Is blockerande aktivitet. De rapporterade att acetylering av Lys5 nära den N-terminala regionen och Lys29 i beta-turn-regionen ledde till avsevärda minskningar i DTX-I-bindningsaffinitet. Liknande resultat har visats med dendrotoxin-K med användning av platsriktad mutagenes för att ersätta positivt laddade lysin- och argininrester med neutrala alaniner . Dessa resultat, tillsammans med många andra, har implicerat att de positivt laddade lysinerna i den N-terminala halvan, särskilt Lys5 i 310-helixen, spelar en mycket viktig roll i dendrotoxinbindningen till deras kaliumkanalmål. Lysinresterna i β-svängregionen har gett mer förvirrande resultat, som verkar vara biologiskt kritiska i vissa dendrotoxinhomologer och inte nödvändiga för andra. Dessutom resulterade mutation av hela lysintripletten (K28-K29-K30) till Ala-Ala-Gly i alfa-DTX i mycket liten förändring i biologisk aktivitet.
Det finns en allmän enighet om att den konserverade lysinresten nära N-terminalen (Lys5 i alfa-DTX) är avgörande för den biologiska aktiviteten hos alla dendrotoxiner, medan ytterligare rester, såsom de i beta-turn-regionen, kan spela en roll i dendrotoxinspecificitet genom att förmedla interaktionerna mellan individuella toxiner till deras individuella målställen. Detta hjälper inte bara till att förklara den stringenta specificiteten hos vissa dendrotoxiner för olika undertyper av spänningsstyrda K + -kanaler, utan förklarar också skillnader i styrkan hos dendrotoxiner för vanliga K + -kanaler. Till exempel, Wang et al. visade att interaktionen av dendrotoxin-K med KV 1.1 förmedlas av dess lysinrester i både N-terminalen och β-turnregionen, medan alfa-dendrotoxin verkar interagera med sitt mål enbart genom N-terminalen. Denna mindre expansiva interaktiva domän kan hjälpa till att förklara varför alfa-dendrotoxin är mindre diskriminerande medan dendrotoxin-K är strikt selektivt för K V 1.1.
Används i forskning
Kaliumkanaler hos neuroner från ryggradsdjur uppvisar en hög grad av mångfald som gör att neuroner kan justera sina elektriska signalegenskaper genom att uttrycka olika kombinationer av kaliumkanalsubenheter. Dessutom, eftersom de reglerar jonflöde över biologiska membran, är de viktiga i många aspekter av cellulär reglering och signaltransduktion av olika celltyper. Därför är spänningsstyrda kaliumkanaler mål för ett brett spektrum av potenta biologiska toxiner från sådana organismer som ormar, skorpioner , havsanemoner och konsniglar . Således giftrening lett till isolering av peptidtoxiner såsom dendrotoxiner, som har blivit användbara farmakologiska verktyg för studier av kaliumkanaler. På grund av sin styrka och selektivitet för olika subtyper av kaliumkanaler har dendrotoxiner blivit användbara som molekylära prober för strukturella och funktionella studier av dessa proteiner. Detta kan bidra till att förbättra vår förståelse för de roller som individuella kanaltyper spelar, samt hjälpa till med den farmakologiska klassificeringen av dessa olika kanaltyper. Dessutom tillhandahåller tillgången på radioaktivt märkta dendrotoxiner ett verktyg för screening av andra källor i en sökning efter nya kaliumkanaltoxiner, såsom kalicludinklassen av kaliumkanaltoxiner i havsanemoner. Slutligen kan den strukturella informationen från dendrotoxiner ge ledtrådar till syntesen av terapeutiska föreningar som kan rikta in sig på särskilda klasser av kaliumkanaler. Dendrotoxin I har också använts för att hjälpa till att rena och karakterisera K+-kanalproteinet till vilket det binder via olika bindningsanalyser och kromatografitekniker.
- ^ Gasparini S, Danse JM, Licoq A, Pinkasfeld S, Zinn-Justin S, Young LC, CL de Medeiros C, Rowan EG, Harvey AL, and Me'nez A (1998). Avgränsning av det funktionella stället för alfa-dendrotoxin: De funktionella topografierna för dendrotoxiner är olika men delar en konserverad kärna med de för andra KV 1- kaliumkanalblockerande toxiner. Journal of Biological Chemistry 273:25393-25403
- ^ Katoh E, Nishio H, Inui T, Nishiuchi Y, Kimura T, Sakakibara S, Yamazaki T (2000). Strukturell grund för den biologiska aktiviteten av Dendrotoxin-I, en potent kaliumkanalblockerare. Biopolymers 54:44-57
- ^ Swaminathan P, Hariharan M, Murali R, Singh CU (1996). Molekylär struktur, konformationsanalys och struktur-aktivitetsstudier av dendrotoxin och dess homologer med hjälp av molekylär mekanik och molekylär dynamik. Journal of Medicinal Chemistry . 39:2141-2155
- ^ Imredy JP och MacKinnon R (2000). Energetiska och strukturella interaktioner mellan delta-dendrotoxin och en spänningsstyrd kaliumkanal. Journal of Molecular Biology 296:1283-1294
- ^ Harvey AL, Rowan EG, Vatanpour H, Engström A, Westerlund B, Karlsson E (1997). Förändringar i biologisk aktivitet efter acetylering av dendrotoxin I från Dendroaspis polylepis (svart mamba). '35 :1263-1273
- ^ Wang FC, Bell N, Reid P, Smith LA, McIntosh P, Robertson B och Dolly JO (1999). Identifiering av rester i dendrotoxin K som är ansvariga för dess diskriminering mellan neuronala K + -kanaler innehållande Kv 1,1 och 1,2 alfa-subenheter. European Journal of Biochemistry 263:222-229
- ^ Yoshida S och Matsumoto S (2005). Effekter av alfa-dendrotoxin på K + -strömmar och aktionspotentialer i tetrodotoxinresistenta trigeminusganglieneuroner hos vuxna råttor. Journal of Pharmacology and Experimental Therapeutics 314:437-445
- ^ Rehm, H.; Lazdunski, M. (1988-07-01). "Rening och subenhetsstruktur av ett förmodat K+-kanalprotein identifierat av dess bindningsegenskaper för dendrotoxin I." Proceedings of the National Academy of Sciences . 85 (13): 4919–4923. Bibcode : 1988PNAS...85.4919R . doi : 10.1073/pnas.85.13.4919 . ISSN 0027-8424 . PMC 80549 . PMID 2455300 .
externa länkar
- dendrotoxin vid US National Library of Medicine Medical Subject Headings (MeSH)