Clostridium difficile toxin B
| Toxin B | |||||||
|---|---|---|---|---|---|---|---|
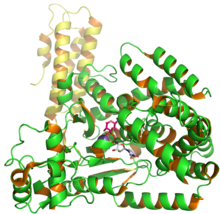 Struktur för C. difficile glukosyltransferas Toxin B som visar UDP och glukos från PDB-post 2BVM.
| |||||||
| Identifierare | |||||||
| Organism | |||||||
| Symbol | toxB | ||||||
| Alt. symboler | tcdB | ||||||
| Entrez | 4914074 | ||||||
| PDB | 2BVM | ||||||
| RefSeq (Prot) | YP_001087135.1 | ||||||
| UniProt | P18177 | ||||||
| Övriga uppgifter | |||||||
| EG-nummer | 2.4.1.- | ||||||
| Kromosom | genom: 0,79 - 0,8 Mb | ||||||
| |||||||
| TcdB-toxin N-terminala | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| spiraldomänidentifierare | |||||||||
| Symbol | TcdB_N | ||||||||
| Pfam | PF12918 | ||||||||
| |||||||||
| - | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| katalytiska glykosyltransferasdomänidentifierare | |||||||||
| Symbol | TcdA_TcdB | ||||||||
| Pfam | PF12919 | ||||||||
| |||||||||
| Identifierare av | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Peptidase C80-familjen | |||||||||
| Symbol | Peptidas_C80 | ||||||||
| Pfam | PF11713 | ||||||||
| InterPro | IPR020974 | ||||||||
| |||||||||
| TcdA/TcdB porbildande | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| domänidentifierare | |||||||||
| Symbol | TcdA_TcdB_pore | ||||||||
| Pfam | PF12920 | ||||||||
| TCDB | 1.C.57 | ||||||||
| OPM superfamilj | 199 | ||||||||
| OPM-protein | 6oq6 | ||||||||
| |||||||||
Clostridium difficile toxin B är ett cellgift som produceras av bakterien Clostridioides difficile , tidigare känt som Clostridium difficile . Det är en av två huvudtyper av toxiner som produceras av C. difficile , den andra är ett besläktat enterotoxin ( toxin A) . Båda är mycket potenta och dödliga.
Strukturera
Toxin B (TcdB) är ett cytotoxin som har en molekylvikt på 270 kDa och en isoelektrisk punkt , pl, på 4,1. Toxin B har fyra olika strukturella domäner: katalytisk , cysteinproteas , translokation och receptorbindning . Den N-terminala glukosyltransferaskatalytiska domänen inkluderar aminosyraresterna 1–544 medan cysteinproteasdomänen inkluderar resterna 545–801. Dessutom inkorporerar translokationsregionen aminosyrarester från 802 till 1664 medan den receptorbindande regionen är en del av den C-terminala regionen och inkluderar aminosyrarester från 1665 till 2366.
Glykosyleringsaktiviteten av toxin B sker i den N-terminala katalytiska regionen (rester 1–544) . Denna region glykosylerar substrat oberoende av eventuell cytotoxisk aktivitet. En liten deletion av den receptorbindande regionen orsakar dock attenuering av toxin B-aktivitet. Translokationsregionen innehåller en hydrofob stjälkliknande struktur, vilket kan hjälpa resterna 958–1130 att bilda membranomspännande porer . Den receptorbindande regionen som inkluderar den C-terminala repetitiva regionen (CRR) ökar TcdB-membraninteraktionen men deltar inte i porbildning. Dessutom cysteinproteas och translokationsregioner båda komplexa strukturer som spelar en viktig funktionell roll vid translokation och receptorbindning. Att ta bort translokationsregionen av aminosyror minskar emellertid den cytotoxiska aktiviteten fyra gånger. Både cysteinproteaser och en majoritet av translokationsregionerna har hydrofoba proteiner, som visar tillgång till TcdB och andra toxiner som passerar cellmembranen .
Receptorbindande domän
C -terminalen av TcdB (den gröna regionen i fig. 2) innehåller en region känd som de kombinerade repetitiva oligopeptiderna (CROPs) som innehåller aminosyrarester 1831–2366. Dessa CROPs utgör 19–24 korta upprepningar (SRs) av aminosyror, ungefär 31 långa upprepningar (LRs) av aminosyror, toxin A och Toxin B. TcdB CROPs-regionen består av 19 SRs och 4 LRs. Denna SR- och LR-region tillåter bildandet av cellväggsbindande motiv som hjälper till att binda sockerdelar på cellytorna.
Rening
För att rena toxin B från C. difficile- cellkulturer används hjärnhjärtinfusionsbuljong eftersom den främjar syntesen av toxin B. Filtreringsmetoden underlättar rening av toxin B från supernatanten av C. difficile . Toxinkoncentrationen i supernatanten är proportionell mot organismcellantalet . Det har föreslagits av många studier att majoriteten av toxinerna frisätts i antingen sen log-fas eller tidiga stationära faser , och därför utsöndras toxin B kontinuerligt av celler. Även om det finns många metoder som används av olika studier för att rena toxin B, använder de flesta studier metoder som involverar koncentrationer av ultrafiltrerat ammoniumsulfat eller utfällning , i stället för antingen gelfiltrering eller jonbyteskromatografi . Dessutom hjälper effektiviteten av jonbyteskromatografimetoden till att skilja mellan TcdA och TcdB.
Fungera
När den katalytiska treoninresten av glukosyltransferas deaktiverar en familj av små GTPaser , t.ex. Rho-familjen ; Rac och Cdc42 inuti målcellerna stör signaltransduktionsmekanismer , vilket leder till dysfunktion av aktincytoskelettet , cell - cell-övergången och apoptos (fig. 5 ) . Rho inducerar aktiviteten hos aktinstressfibrer . Rac -proteiner kontrollerar aktiviteten av membranrussel och NADPH- oxidas neutrofil . Cdc42 reglerar bildningen av F-aktinfilament i filopodia .
Cytotoxicitet
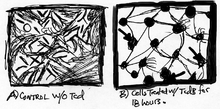
har visat att närvaron av TcdB i däggdjursceller leder till snabba förändringar inom cellmorfologi och cellsignalering . Inom en kort tidsperiod ser cellerna ut som plack med små doser av TcdB och TcdA. Dessutom är celldöd en stor påverkan av dessa toxiner efter att celler har blivit berusade . En undersökning av Donta et al. , vidarebefordrade att TcdB har allvarliga effekter i andra däggdjursceller såsom äggstocksceller från kinesisk hamster , humana cervikala epitelceller , musbinjureceller , råtthepatocyter och råttaastrocyter ( Fig. 3).
Den cytotoxiska aktiviteten är baserad på celltyper, som kan variera från 4-faldigt till 200-faldigt. Generellt, när celler infekteras med TcdB, förlorar de inte bara sin strukturella integritet, utan också minskningar av F- aktinfilament . Cellavrundningar av TcdB tar inte längre än 2 timmar (fig. 4), men när det gäller celldöd kan det ta ungefär 24 timmar. När det gäller Clostridium difficile - diarré associerad (CDAD) är effekterna av cytopaticitet mer kritiska än faktisk celldöd, eftersom när celler förlorar integriteten hos cytoskelettaktinfilamentet förlorar de också sin normala funktion.

Effekter på små GTPaser
Orsaken till cytotoxisk aktivitet av TcdB inom värdcellen förmedlas huvudsakligen via receptorendocytos [ citat behövs ] . Sura endosomer tillåter toxin B att komma in i cytosolen . Detta fenomen sker genom en bindande receptorregion, som gör att toxin kan komma in i värdceller [ citat behövs ] . Genom tillgängligheten för värdcellernas cytosol , deaktiverar TcdB de små GTPaserna (fig. 5), t.ex. Rho-familjens medlemmar Rac och Cdc42 genom processen med glykosylering av treonin 35 i Cdc42 och Rac, och treonin 37 i Rho. Dessa Rho GTPaser finns allestädes närvarande i cytosolen hos eukaryota celler som är ansvariga för organiseringen av aktincytoskelettet eftersom toxinerna i cytosolen orsakar kondensering av aktinfilament som en konsekvens av cellavrundning och membranblödning (Fig. 3), vilket i slutändan leder till apoptos . TcdB orsakar kritiska förändringar av celldynamik och morfologi . Figur 3 visar den troliga effekten av toxin B på en cells yta; membranblebbing (svarta pilar). Dessutom inaktiverar TcdB Rho GTPaser. Som en konsekvens avbryts cell-cellövergångar, vilket förbättrar epitelpermeabiliteten för toxin B och vätskeansamling i lumen. Detta är ett av de främsta orsakerna till att få Clostridium difficile -associerad diarré (CDAD) (Fig. 5).

Dessutom är hydrolyshastigheten av TcdB av UDP-glukos ungefär fem gånger högre än TcdA. Flera studier har indikerat att Rho uppvisar posttranslationell modifiering genom prenylering och karboximetylering, som sker i den cytoplasmatiska sidan av plasmamembranet , och därmed utbytet av GTP till GDP . När TcdB binder till Rho och andra små GTPaser hydrolyseras GTP till GDP , vilket leder till GTP-bunden (aktiv) till GDP-bunden (inaktiv) (Fig. 5). Dessutom regleras denna utbytesaktivitet av guaninfaktorer i cellens cytosol.
Störning på signalvägar
Den cellulära regleringen av Rho, Rac och Cdc42 har effekter utanför närheten av aktinfilamenten i cytoskelettet (Fig. 4), Dessa små GTPaser är inkorporerade i cellcykeln som reglerar signaler via mitogenaktiverade proteinkinaskinaser (MAPKKs) . Vissa fysiologiska delar av cellerna som inte är involverade i aktinfilament kan inte orsaka cellavrundning eller celldöd omedelbart, men i nedströms vägaktivitet kan det leda till försämring av aktinfilament och slutligen celldöd .
1993 visade en studie utförd av Shoshan et al. att celler med TcdB förändrade fosfolipas A2- aktivitet. Detta var en oberoende händelse från störning av aktincytoskelettet . Shoshan et al., visade också att TcdB hämmade receptorsignaleringsaktiviteten genom att deaktivera Rho-proteinerna via fosfolipas D .
Porbildning
TcdB kommer åt det inre av cellen genom clathrin-medierad endocytos , När toxin B är en del av cytosolen , passerar glukosyltransferaset genom det endosomala membranet , vilket minskar pH, inducerar translokation och slutligen leder till morfologiska förändringar av translokationsregionsrester (958–1130) ). De hydrofoba regionerna är inbäddade i värdmembranet för att bilda porer som tillåter glukosyltransferasdomäner att passera igenom. När celler infekteras med TcdB i en sur miljö, försvagar det toxiner och orsakar omarrangemang av formen (fig. 6). Som en konsekvens av surt pH visar TcdB tydliga skillnader i ursprunglig fluorescens av tryptofan , känslighet för proteaser och hydrofoba ytor. En annan grupp har visat att försurning leder till konformationsförändringar av toxinet och, ännu viktigare, hjälper till att bilda porer. En förmodad translokationsregion (Fig. 2) utgör cirka 801–1400 aminosyror, av vilka resterna 958–1130 är hydrofoba och ansvarar för bildandet av transmembranporer. En majoritet av studierna använde TcdB-stam 630 för att visa porbildningsaktiviteten hos C. difficile -toxiner.
Inducerad av pH
För att se om effekterna av proteolytisk klyvning av TcdB äger rum på cellytan eller i sura endosomer , använde studier Bafilomycin A1 , som är känt för att blockera v-typ H + -ATPaser av endosomer. Detta minskar surheten i endosomer. Den fysiologiska upptagningsvägen för TcdB förhindrar cytopatisk aktivitet av TcdB. När celler var i sura förhållanden (pH 4,0) under 5 minuter efter bindning av TcdB till cellytan vid 37 grader Celsius observerades formomarrangemang och avrundning. När avrundade celler inkuberades under ytterligare en timme i neutralt pH (7,0) med liknande parametrar observerades emellertid ingen cellavrundning. Båda studierna visade att toxin B har en egenskap av proteolytisk klyvning , vilket är avgörande för tillgången till cytosolen . Att ha ett surt endosom-pH leder till topologiska förändringar av TcdB (Figur 6).
Genetik
Genen som kodar för TcdB-proteinet, tcdB , är belägen inom den kromosomala regionen på 19,6 kb . Detta är känt som platsen för patogenicitet eller PaLoc (Figur 2). Den öppna läsramen (ORF) för tcdB är 7 098 nukleotider lång. Det är viktigt att nämna att - förutom de stora toxingenerna i PaLoc-regionen - det finns tre andra accessoriska gener som kodar för PaLoc-regionen: tcdR (L), tcdC (R) och tcdE i mitten. Dessa gener hjälper till att reglera TcdA- och TcdB-uttryck. De hjälper också till att utsöndra eller frigöra toxiner från cellen. Den kodande genen tcdE , belägen mellan tcdB och tcdA , är analog med holinproteiner , sålunda föreslås det att tcdE fungerar som en facilitatorgen som förbättrar frisättningen eller utsöndringen av TcdA och TcdB och därmed ökar permeabiliteten hos värdcellmembranet .
Toxindetektering
Det finns olika plasmidstorlekar av C. difficile . De detekterade molekylvikterna sträcker sig från 2,7x10 6 till 100x10 6 , men plasmidstorlekar visar ingen korrelation med toxicitet . För att detektera toxin B-nivån i C. difficile använder läkare i stor utsträckning cellodlingsanalyser från avföringsprover från patienter med PMC . Cellodlingsanalysen betraktas som en "guldstandard" för att detektera toxicitet hos C. difficile eftersom en liten mängd toxin B kan orsaka cellavrundning (Fig. 4), så det är en stor fördel för kliniska laboratorier att göra korrelationer med CDAD orsakad av TcdB. Även om cytotoxisk aktivitet av stora klostridietoxiner (LCT) hittades i PMC-patientavföringsprover, hade toxin B-aktivitet mer skadliga cytotoxiska effekter jämfört med toxin A. Därför försvagas aktiviteten av toxin A när det inte isoleras från toxin B. Detekteringen av C. difficile -toxicitet är extremt känslig, men med hjälp av cellodlingsanalysen kan kliniska laboratorier övervinna utmaningen; att använda doser så lite som 1 pg/ml av toxin B är tillräckligt för att orsaka cellavrundning. Detta är den största fördelen med att använda odlingsvävnadsanalysen för att detektera toxicitet hos PMC- patienter. Även om kliniska laboratorier har försökt använda en mikrotiterplattenzymkopplad immunosorbentanalys (ELISA) och andra tekniker för att detektera den cytotoxiska aktiviteten av toxin B i avföringen från PMC -patienter, är resultaten inte lika exakta som de där cellodlingsanalyser var använda.
Produktionsfaktor
Genom att tillsätta antimikrobiellt medel , t.ex. klindamycin , i odlingsmediet har studier visat att den cytotoxiska aktiviteten i C. difficile- kulturer ökar med 4–8 gånger. Dessutom, med kunskap om antibiotikans roll på orsakerna till PMC, fokuserade många tidigare studier på effekterna av antimikrobiella produktion av toxiner. Som ett resultat kunde studier dra slutsatsen att den subinhiberande naturen hos vankomycin och penicillinnivåer ökade toxinproduktionen i kulturer av C. difficile . Mängderna av toxinproduktion korrelerades med användningen av tillväxtmedium för organismerna. En annan studie visade att de höga nivåerna av toxinproduktion av TcdB observerades i komplexa medier som hjärn- och hjärtinfusionsbuljong . Höga nivåer av toxiner producerades med isolering av mycket virulenta . Omvänt producerades låga nivåer av toxiner med isolering av svagt virulenta . Därmed visar det att produktionen av toxiner samreglerades. Även om mekanismen bakom miljöns engagemang i att modulera signalerna som uttrycker toxiner inte är förstådd, har in vitro -studier visat att uttryck av toxin stärks av katabolitförtryck och stress, t.ex. antibiotika . En annan studie har visat att begränsning av biotin i välkarakteriserat medium ökar produktionen av TcdB med 64 gånger och TcdA med 35 gånger. Detta gjordes med C. difficile och doser av biotin så små som 0,05 nM. Flera andra tidiga studier har argumenterat mot teorin att produktionen av toxin har något att göra med stress eller katabolitrepression av antingen toxin TcdA eller TcdB. Många studier säger också att den främsta orsaken till skillnaderna mellan andra studier beror på att toxinproduktion inte förekommer med alla isolat av C. difficile .
Klinisk signifikans
Många tidiga studier har föreslagit att toxin A (även känd som TcdA) är det huvudsakliga toxinproteinet som orsakar antibiotika-associerad diarré (AAD); dock har forskare under det senaste decenniet eller så visat att Toxin B (eller TcdB) spelar en viktigare roll i sjukdomar än någon hade förutsett. Med denna kunskap har Toxin B identifierats som den huvudsakliga virulensfaktorn som orsakar öppning av täta korsningar av tarmepitelceller , vilket gör det möjligt för toxin att öka vaskulär permeabilitet och inducera blödningar . Följaktligen leder detta till att tumörnekrosfaktor α (TNF α) och proinflammatoriska interleukiner etableras som de huvudsakliga orsakerna till pseudomembranös kolit (PMC) och antibiotika-associerad diarré (AAD).
Inblandningen av toxin A och – viktigast av allt – toxin B är nyckelelementet som bestämmer sjukdomen orsakad av C. difficile . Kliniska laboratorier har identifierat dessa toxiner i patienternas avföring baserat på antikropps- och cytotoxicitetsanalyser . Dessa bakteriella toxiner har visats vara associerade med Clostridium sordellii hemorragiskt toxin (TcsH), dödligt toxin (TcsL) och Clostridium novyi alfa-toxin (Tcn α), vilket gör att denna kohort är den stora familjen av toxin clostridial. På grund av likheter mellan dessa toxiner med andra, har forskare klassificerat dem som familjen av stora klostridiala toxiner (LCT).
Mekanism av bezlotoxumab med TcdB
Bezlotoxumab är en human monoklonal antikropp utformad för att förhindra återfall av Clostridium difficile-infektioner. Genom röntgenkristalliserad struktur av N-terminalen av TcdB identifieras toxinet bestå av tre domäner: en glukosyltransferasdomän (GTD), ett cysteinproteas och en kombinerad repetitiv oligopeptiddomän (CROP). Bezlotoxumab binder specifikt till två homologa ställen inom CROP-domänen av TcdB. Strukturell analys genom röntgenkristallografi indikerar att antikroppsbindning delvis täpper till förmodade kolhydratbindningsfickor. I enlighet med denna idé blockerar Bezlotoxumab bindning av TcdB till däggdjursceller.
Roll i pseudomembranös kolit
I tidiga stadier av sjukdomen PMC har många studier spekulerat i att TcdA är mer potent än TcdB. Detta har härletts från in vivo-experiment där toxinproduktionen av TcdA var allvarligare än TcdB med antibiotika cecit. Senare visade flera studier att TcdB spelar en stor roll vid sjukdomen PMC och ADD. Studien visade att även om C. difficile inte producerade TcdA, visade den fortfarande symtom på sjukdomen. Vidare har senare studier visat att en renad form av TcdB är ett mer dödligt enterotoxin i jämförelse med TcdA, och även att tarmepitel är allvarligt skadat och orsakar ett akut inflammatoriskt svar. Med bättre förståelse för toxinet kunde forskarna konstatera att TcdB är den viktigaste virulensfaktorn som orsakar CDI över TcdA. Men när TcdA finns i tarmen, hjälper det till att underlätta TcdB:s aktivitet att ha bredare effekter, och följaktligen påverkar flera organsystem. Dessutom, när hamstrar vaccinerades mot TcdA, visade det att hamstrar inte var helt skyddade från C. difficile -sjukdomen och detta ledde studier till att dra slutsatsen att TcdB är mycket dödligt och potent. Dessutom visade sig injicering av en liten dos av TcdA med en dödlig dos av TcdB intravenöst eller intraperitonealt tillräckligt för att orsaka ett djurs död. Därför fungerar TcdA som en facilitator för att TcdB kommer ut ur tarmen.