Aminosyra
Aminosyror är organiska föreningar som innehåller både amino- och karboxylsyrafunktionella grupper . Även om hundratals aminosyror finns i naturen, är de överlägset viktigaste alfa-aminosyrorna, som består av proteiner . Endast 22 alfaaminosyror förekommer i den genetiska koden .
Aminosyror kan klassificeras enligt placeringen av de centrala strukturella funktionella grupperna, som alfa- (α-) , beta- (β-) , gamma- (γ-) eller delta- (δ-) aminosyror; andra kategorier hänför sig till polaritet , jonisering och sidokedjegrupptyp ( alifatisk , acyklisk , aromatisk , innehållande hydroxyl eller svavel , etc.). I form av proteiner utgör aminosyrarester den näst största komponenten ( vatten är den största ) i mänskliga muskler och andra vävnader . Utöver sin roll som rester i proteiner, deltar aminosyror i ett antal processer som av signalsubstanser och biosyntes . Man tror att de spelade en nyckelroll för att möjliggöra liv på jorden och dess uppkomst .
Aminosyror är formellt namngivna av IUPAC-IUBMB Joint Commission on Biochemical Nomenclature i termer av den fiktiva "neutrala" strukturen som visas i illustrationen. Till exempel är det systematiska namnet på alanin 2-aminopropansyra, baserat på formeln CH 3 −CH(NH 2 )−COOH . Kommissionen motiverade detta tillvägagångssätt på följande sätt:
De systematiska namnen och formlerna som anges hänvisar till hypotetiska former där aminogrupper är oprotonerade och karboxylgrupper är odissocierade. Denna konvention är användbar för att undvika olika nomenklaturella problem men bör inte uppfattas som att dessa strukturer representerar en avsevärd del av aminosyramolekylerna.
Historia
De första aminosyrorna upptäcktes i början av 1800-talet. År 1806 isolerade de franska kemisterna Louis-Nicolas Vauquelin och Pierre Jean Robiquet en förening från sparris som senare fick namnet asparagin , den första aminosyran som upptäcktes. Cystin upptäcktes 1810, även om dess monomer, cystein , förblev oupptäckt till 1884. Glycin och leucin upptäcktes 1820. Den sista av de 20 vanliga aminosyrorna som upptäcktes var treonin 1935 av William Cumming Rose , som också bestämde det väsentliga aminosyror och fastställde de dagliga minimikraven för alla aminosyror för optimal tillväxt.
Enheten i den kemiska kategorin erkändes av Wurtz 1865, men han gav inget särskilt namn till den. Den första användningen av termen "aminosyra" i det engelska språket är från 1898, medan den tyska termen, Aminosäure , användes tidigare. Proteiner visade sig ge aminosyror efter enzymatisk nedbrytning eller syrahydrolys . År 1902 Emil Fischer och Franz Hofmeister oberoende att proteiner bildas av många aminosyror, varvid bindningar bildas mellan aminogruppen i en aminosyra med karboxylgruppen i en annan, vilket resulterar i en linjär struktur som Fischer kallade "peptid " .
Allmän struktur

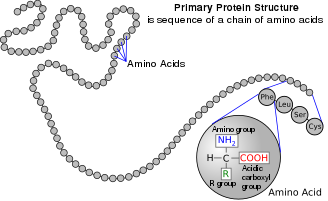
I strukturen som visas överst på sidan representerar R en sidokedja som är specifik för varje aminosyra. Kolatomen bredvid karboxylgruppen kallas α –kol . Aminosyror som innehåller en aminogrupp bunden direkt till α-kolet kallas α-aminosyror . Dessa inkluderar prolin och hydroxiprolin , som är sekundära aminer . Förr kallades de ofta iminosyror , en felaktig benämning eftersom de inte innehåller en imingruppering HN=C .
Isomeri
De vanliga naturliga formerna av aminosyror har strukturen −NH + 3 ( −NH + 2 − när det gäller prolin) och −CO − 2 funktionella grupper bundna till samma C-atom, och är således α-aminosyror. Med undantag för akiralt glycin har naturliga aminosyror L -konfigurationen och är de enda som finns i proteiner under translation i ribosomen.
L- och D -konventionen för aminosyrakonfiguration avser inte den optiska aktiviteten hos själva aminosyran utan snarare till den optiska aktiviteten hos isomeren av glyceraldehyd från vilken den aminosyran i teorin kan syntetiseras ( D -glyceraldehyd är högervridande; L -glyceraldehyd är vänstervridande).
En alternativ konvention är att använda ( S ) och ( R ) beteckningarna för att specificera den absoluta konfigurationen . Nästan alla aminosyrorna i proteiner är ( S ) vid α-kolet, där cystein är ( R ) och glycin är icke- kiralt . Cystein har sin sidokedja på samma geometriska plats som de andra aminosyrorna, men R / S -terminologin är omvänd eftersom svavel har högre atomnummer jämfört med karboxylsyren som ger sidokedjan högre prioritet av Cahn -Ingold-Prelog sekvensregler , medan atomerna i de flesta andra sidokedjor ger dem lägre prioritet jämfört med karboxylgruppen.
Sällan finns D -aminosyrarester i proteiner och omvandlas från l -aminosyran som en posttranslationell modifiering .
Sidokedjor
Aminosyror betecknas som α- när aminokväveatomen är bunden till α-kolet, kolatomen intill karboxylatgruppen.
I alla fall nedan i detta avsnitt hänvisar värdena (om några) till joniseringen av grupperna som aminosyrarester i proteiner. De är inte värden för de fria aminosyrorna (som är av liten biokemisk betydelse).
Alifatiska sidokedjor

Sju (av de 21 proteinogena) aminosyrorna har sidokedjor som bara innehåller H och C. Dessa joniseras därför inte. De är följande (med tre- och enbokstavssymboler inom parentes):
- Glycin (Gly, G): H−
- Alanin (Ala, A ) : CH3-
- Valin (Val, V): (CH 3 ) 2 CH−
- Isoleucin CH3CH2CH ( CH3 ) ( Ile , I ):
- Leucin ) : ( CH3 ) 2CHCH2- ( Leu, L
- Fenylalanin (Phe, F): C 6 H 5 CH 2 -
- Prolin (Pro, P): −CH 2 CH 2 CH 2 − cykliserad på aminen
Polar neutrala sidokedjor
Två aminosyror innehåller alkoholsidokedjor. Dessa joniseras inte under normala förhållanden, även om ett, serin, deprotoneras under katalysen av serinproteaser : detta är ett exempel på allvarlig störning och är inte karakteristiskt för serinrester i allmänhet.
- Serin (Ser, S, ingen när den inte är allvarligt störd): HOCH 2 −
- Treonin (Thr, T, ingen ): CH 3 CHOH−
Treonin har två kirala centra, inte bara det kirala L (2S )-centret vid a-kolet som delas av alla aminosyror förutom akiralt glycin, utan också (3R ) vid β-kolet. Den fullständiga stereokemiska specifikationen är L -treonin (2S , 3R ) .
Amide sidokedjor
Två aminosyror har amidsidokedjor, enligt följande:
Dessa sidokedjor joniseras inte inom det normala pH-området.
Svavelhaltiga sidokedjor
Två sidokedjor innehåller svavelatomer, varav den ena joniserar i normalområdet (med angivet) och den andra inte:
Aromatiska sidokedjor
Tre aminosyror har aromatiska ringstrukturer som sidokedjor, som illustreras. Av dessa joniserar tyrosin i normalområdet; de andra två gör det inte).
- Fenylalanin (Phe, F, no ): vänster i illustrationen
- Tyrosin (Tyr, Y, : mitten i illustrationen
- Tryptofan (Trp, W, no ): höger i illustrationen
Anjoniska sidokedjor
Två aminosyror har sidokedjor som är anjoner vid vanligt pH. Dessa aminosyror kallas ofta för karboxylsyror men kallas mer korrekt för karboxylater, eftersom de deprotoneras vid de flesta relevanta pH-värden. De anjoniska karboxylatgrupperna beter sig som Brønsted-baser under alla omständigheter förutom enzymer som pepsin som verkar i miljöer med mycket lågt pH som däggdjursmagen.
- Aspartat ("asparaginsyra", Asp, D, : −CH 2 CO − 2
- Glutamat ("glutaminsyra", Glu, E, { 2 CH 2 CO − 2 ):
Katjoniska sidokedjor
Det finns tre aminosyror med sidokedjor som är katjoner vid neutralt pH (även om i en, histidin, katjonisk och neutral form båda finns). De kallas vanligen för basiska aminosyror , men denna term är missvisande: histidin kan fungera både som en Brønsted-syra och som en Brønsted-bas vid neutralt pH, lysin fungerar som en Brønsted-syra, och arginin har en fast positiv laddning och joniserar inte i neutrala förhållanden. Namnen histidinium, lysinium och argininium skulle vara mer exakta namn för strukturerna, men har i princip ingen valuta.
- Histidin (His, H, : Protonerade och deprotonerade former i jämvikt visas till vänster i bilden
- Lysin (Lys, K, : Visas i mitten av bilden
- Arginin (Arg, R, : Visas till höger i bilden
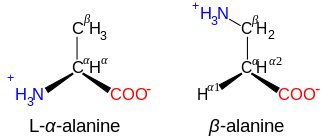
β- och y-aminosyror
Aminosyror med strukturen NH + 3 −CXY−CXY−CO − 2 , såsom β-alanin , en komponent i karnosin och några andra peptider, är β-aminosyror. Ettor med strukturen NH + 3 −CXY−CXY−CXY−CO − 2 är γ-aminosyror, och så vidare, där X och Y är två substituenter (av vilka en normalt är H).
Zwitterions
I vattenlösning vid pH nära neutralitet existerar aminosyror som zwitterjoner , dvs som dipolära joner med både NH + 3 och CO − 2 i laddade tillstånd, så den övergripande strukturen är NH + 3 −CHR−CO − 2 . Vid fysiologiskt pH är de så kallade "neutrala formerna" −NH 2 −CHR−CO 2 H inte närvarande i någon mätbar grad. Även om de två laddningarna i zwitterjonstrukturen summerar till noll är det missvisande att kalla en art med en nettoladdning på noll "oladdad".
Under starkt sura förhållanden (pH under 3) blir karboxylatgruppen protonerad och strukturen blir en ammoniokarboxylsyra, NH + 3 −CHR−CO 2 H . Detta är relevant för enzymer som pepsin som är aktiva i sura miljöer som däggdjursmagen och lysosomer , men gäller inte signifikant för intracellulära enzymer. Under mycket basiska förhållanden (pH högre än 10, ses normalt inte under fysiologiska förhållanden) deprotoneras ammoniogruppen för att ge NH 2 −CHR−CO − 2 .
Även om olika definitioner av syror och baser används i kemi, är den enda som är användbar för kemi i vattenlösning Brønsted : en syra är en art som kan donera en proton till en annan art, och en bas är en som kan acceptera en proton. Detta kriterium används för att märka grupperna i illustrationen ovan. Karboxylatsidokedjorna av aspartat- och glutamatrester är de huvudsakliga Brønsted-baserna i proteiner. På samma sätt kommer lysin, tyrosin och cystein vanligtvis att fungera som en Brønsted-syra. Histidin under dessa förhållanden kan fungera både som en Brønsted-syra och en bas.
Isoelektrisk punkt

För aminosyror med oladdade sidokedjor dominerar zwitterjonen vid pH-värden mellan de två pKa- värdena , men samexisterar i jämvikt med små mängder netto negativa och netto positiva joner. Vid mittpunkten mellan de två p Ka - värdena balanserar spårmängden av nettonegativa och spår av positiva nettojoner, så att den genomsnittliga nettoladdningen av alla närvarande former är noll. Detta pH är 1/2 ) känt som den isoelektriska punkten p I , så p I = (p K a1 + p K a2 .
För aminosyror med laddade sidokedjor är sidokedjans p Ka inblandad . För aspartat eller glutamat med negativa sidokedjor är den terminala aminogruppen i huvudsak helt i den laddade formen NH + 3 , men denna positiva laddning måste balanseras av tillståndet med bara en C-terminal karboxylatgrupp som är negativt laddad. Detta inträffar halvvägs mellan de två karboxylat-p Ka - värdena : p I = 1/2 ( ( (p K a1 + p Ka R) ), där p Ka R) är sidokedjan p Ka .
Liknande överväganden gäller andra aminosyror med joniserbara sidokedjor, inklusive inte bara glutamat (liknande aspartat), utan även cystein, histidin, lysin, tyrosin och arginin med positiva sidokedjor
Aminosyror har noll rörlighet vid elektrofores vid sin isoelektriska punkt, även om detta beteende vanligtvis utnyttjas för peptider och proteiner än enstaka aminosyror. Zwitterioner har minimal löslighet vid sin isoelektriska punkt, och vissa aminosyror (i synnerhet med opolära sidokedjor) kan isoleras genom utfällning från vatten genom att justera pH till den erforderliga isoelektriska punkten.
Fysikalisk-kemiska egenskaper
De 20 kanoniska aminosyrorna kan klassificeras efter deras egenskaper. Viktiga faktorer är laddning, hydrofilicitet eller hydrofobicitet , storlek och funktionella grupper. Dessa egenskaper påverkar proteinstruktur och protein-protein-interaktioner . De vattenlösliga proteinerna tenderar att ha sina hydrofoba rester ( Leu , Ile , Val , Phe och Trp ) begravda i mitten av proteinet, medan hydrofila sidokedjor exponeras för det vattenhaltiga lösningsmedlet. (Inom biokemi hänvisar en rest till en specifik monomer inom polymerkedjan av en polysackarid , protein eller nukleinsyra .) De integrerade membranproteinerna tenderar att ha yttre ringar av exponerade hydrofoba aminosyror som förankrar dem i lipiddubbelskiktet . Vissa perifera membranproteiner har en fläck av hydrofoba aminosyror på sin yta som fastnar på membranet. På ett liknande sätt har proteiner som måste binda till positivt laddade molekyler ytor rika på negativt laddade aminosyror som glutamat och aspartat , medan proteiner som binder till negativt laddade molekyler har ytor som är rika på positivt laddade aminosyror som lysin och arginin . Till exempel är lysin och arginin närvarande i stora mängder i regionerna med låg komplexitet av nukleinsyrabindande proteiner. Det finns olika hydrofobicitetsskalor för aminosyrarester.
Vissa aminosyror har speciella egenskaper. Cystein kan bilda kovalenta disulfidbindningar till andra cysteinrester. Prolin bildar en cykel till polypeptidens ryggrad, och glycin är mer flexibelt än andra aminosyror.
Glycin och prolin är starkt närvarande i regioner med låg komplexitet av både eukaryota och prokaryota proteiner, medan motsatsen är fallet med cystein, fenylalanin, tryptofan, metionin, valin, leucin, isoleucin, som är mycket reaktiva eller komplexa eller hydrofoba.
Många proteiner genomgår en rad posttranslationella modifieringar , varvid ytterligare kemiska grupper fästs till aminosyraresternas sidokedjor och ibland producerar lipoproteiner (som är hydrofoba), eller glykoproteiner (som är hydrofila) som gör att proteinet kan fästa tillfälligt till ett membran. Till exempel kan ett signalprotein fästa och sedan lossna från ett cellmembran, eftersom det innehåller cysteinrester som kan ha fettsyran palmitinsyra tillsatt och sedan avlägsnad.
Tabell över standardaminosyraförkortningar och egenskaper
Även om enbokstavssymboler ingår i tabellen, rekommenderar IUPAC–IUBMB att "Användning av enbokstavssymboler bör begränsas till jämförelse av långa sekvenser".
| Aminosyra | 3- och 1-bokstavssymboler | Sidokedja |
Hydropati index |
Molar absorptionsförmåga | Molekylär massa |
Överflöd av proteiner (%) |
Standard genetisk kodning, IUPAC-notation |
||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | Klass | Polaritet |
Nettoladdning vid pH 7,4 |
Våglängd, λ max (nm) |
Koefficient ε (mM −1 ·cm −1 ) |
|||||
| Alanin | Ala | A | Alifatisk | Opolär | Neutral | 1.8 | 89,094 | 8,76 | GCN | ||
| Arginin | Arg | R | Fast katjon | Grundläggande polär | Positiv | −4.5 | 174,203 | 5,78 | MGR, CGY | ||
| Asparagin | Asn | N | Amid | Polär | Neutral | −3.5 | 132,119 | 3,93 | AAY | ||
| Aspartat | Asp | D | Anjon | Brønsted bas | Negativ | −3.5 | 133,104 | 5,49 | GAY | ||
| Cystein | Cys | C | Thiol | Brønsted syra | Neutral | 2.5 | 250 | 0,3 | 121,154 | 1,38 | UGY |
| Glutamin | Gln | F | Amid | Polär | Neutral | −3.5 | 146,146 | 3.9 | BIL | ||
| Glutamat | Glu | E | Anjon | Brønsted bas | Negativ | −3.5 | 147,131 | 6,32 | GAR | ||
| Glycin | Gly | G | Alifatisk | Opolär | Neutral | −0,4 | 75,067 | 7.03 | GGN | ||
| Histidin | Hans | H | Aromatisk katjon | Brønsted syra och bas |
Positiv, 10 % neutral, 90 % |
−3.2 | 211 | 5.9 | 155,156 | 2.26 | CAY |
| Isoleucin | Ile | jag | Alifatisk | Opolär | Neutral | 4.5 | 131,175 | 5,49 | AUH | ||
| Leucin | Leu | L | Alifatisk | Opolär | Neutral | 3.8 | 131,175 | 9,68 | YUR, CUY | ||
| Lysin | Lys | K | Katjon | Brønsted syra | Positiv | −3.9 | 146,189 | 5.19 | AAR | ||
| Metionin | Träffade | M | Tioether | Opolär | Neutral | 1.9 | 149,208 | 2,32 | AUG | ||
| Fenylalanin | Phe | F | Aromatisk | Opolär | Neutral | 2.8 | 257, 206, 188 | 0,2, 9,3, 60,0 | 165,192 | 3,87 | UUY |
| Proline | Proffs | P | Cyklisk | Opolär | Neutral | −1.6 | 115,132 | 5.02 | CCN | ||
| Serine | Ser | S | Hydroxyl | Polär | Neutral | −0,8 | 105,093 | 7.14 | UCN, AGY | ||
| Treonin | Thr | T | Hydroxyl | Polär | Neutral | −0,7 | 119,119 | 5,53 | ACN | ||
| Tryptofan | Trp | W | Aromatisk | Opolär | Neutral | −0,9 | 280, 219 | 5,6, 47,0 | 204,228 | 1,25 | UGG |
| Tyrosin | Tyr | Y | Aromatisk | Brønsted syra | Neutral | −1.3 | 274, 222, 193 | 1,4, 8,0, 48,0 | 181,191 | 2,91 | UAY |
| Valine | Val | V | Alifatisk | Opolär | Neutral | 4.2 | 117,148 | 6,73 | PISTOL | ||
Två ytterligare aminosyror kodas i vissa arter av kodon som vanligtvis tolkas som stoppkodon :
| 21:a och 22:a aminosyrorna | 3-bokstäver | 1-bokstav | Molekylär massa |
|---|---|---|---|
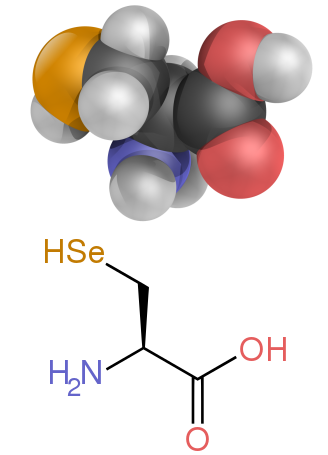
| Selenocystein | Sec | U | 168,064 |
| Pyrrolysin | Pyl | O | 255,313 |
Utöver de specifika aminosyrakoderna används platshållare i de fall där kemisk eller kristallografisk analys av en peptid eller ett protein inte entydigt kan fastställa identiteten för en rest. De används också för att sammanfatta konserverade proteinsekvensmotiv . Användningen av enstaka bokstäver för att indikera uppsättningar av liknande rester liknar användningen av förkortningskoder för degenererade baser .
| Tvetydiga aminosyror | 3-bokstäver | 1-bokstav | Aminosyror ingår | Kodon ingår |
|---|---|---|---|---|
| Någon/okänd | Xaa | X | Allt | NNN |
| Asparagin eller aspartat | Asx | B | D, N | STRÅLE |
| Glutamin eller glutamat | Glx | Z | E, Q | SAR |
| Leucin eller isoleucin | Xle | J | Jag, L | YTR, ATH, CTY |
| Hydrofobisk | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromatisk | Ω | F, W, Y, H | YWY, TTY, TGG | |
| Alifatisk (icke-aromatisk) | Ψ | V, I, L, M | VTN, TTR | |
| Små | π | P, G, A, S | BCN, RGY, GGR | |
| Hydrofil | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY | |
| Positivt laddad | + | K, R, H | ARR, CRY, CGR | |
| Negativt laddad | − | D, E | GAN |
Unk används ibland istället för Xaa , men är mindre standard.
Ter eller * (från terminering) används i notation för mutationer i proteiner när ett stoppkodon inträffar. Det motsvarar ingen aminosyra alls.
Dessutom har många icke-standardiserade aminosyror en specifik kod. Till exempel syntetiseras flera peptidläkemedel, såsom Bortezomib och MG132 , artificiellt och behåller sina skyddsgrupper , som har specifika koder . Bortezomib är Pyz –Phe–boroLeu och MG132 är Z –Leu–Leu–Leu–al. För att underlätta analysen av proteinstrukturen finns fotoreaktiva aminosyraanaloger tillgängliga. Dessa inkluderar fotoleucin ( pLeu ) och fotometionin ( pMet ).
Förekomst och funktioner inom biokemi
Aminosyror som har amingruppen bunden till (alfa-) kolatomen bredvid karboxylgruppen har primär betydelse i levande organismer eftersom de deltar i proteinsyntesen. De är kända som 2- , alfa- eller a-aminosyror (generisk formel H2NCHRCOOH ; organisk i de flesta fall, där R är en substituent känd som en " sidokedja ") ofta används termen "aminosyra" för att specifikt referera till dessa. De inkluderar de 22 proteinogena ("proteinbyggande") aminosyrorna, som kombineras till peptidkedjor ("polypeptider") för att bilda byggstenarna i ett stort antal proteiner. Dessa är alla L - stereoisomerer ("vänsterhänta" enantiomerer ), även om några få D -aminosyror ("högerhänta") förekommer i bakteriehöljen , som en neuromodulator ( D - serin ) och i vissa antibiotika .
Många proteinogena och icke-proteinogena aminosyror har biologiska funktioner. Till exempel, i den mänskliga hjärnan är glutamat (standardglutaminsyra ) och gamma-aminosmörsyra ("GABA", icke-standard gamma-aminosyra) de huvudsakliga excitatoriska respektive hämmande neurotransmittorerna . Hydroxiprolin , en viktig komponent i bindvävskollagenet , syntetiseras från prolin . Glycin är en biosyntetisk prekursor till porfyriner som används i röda blodkroppar . Karnitin används vid lipidtransport . Nio proteinogena aminosyror kallas " essentiella " för människor eftersom de inte kan produceras av andra föreningar av människokroppen och därför måste tas in som föda. Andra kan vara villkorligt nödvändiga för vissa åldrar eller medicinska tillstånd. Essentiella aminosyror kan också variera från art till art. På grund av sin biologiska betydelse är aminosyror viktiga i näring och används ofta i näringstillskott , gödningsmedel , foder och livsmedelsteknik . Industriell användning inkluderar tillverkning av läkemedel , biologiskt nedbrytbar plast och kirala katalysatorer .
Proteinogena aminosyror
Aminosyror är föregångare till proteiner. De sammanfogas genom kondensationsreaktioner för att bilda korta polymerkedjor som kallas peptider eller längre kedjor som kallas antingen polypeptider eller proteiner. Dessa kedjor är linjära och ogrenade, med varje aminosyrarest inom kedjan bunden till två angränsande aminosyror. I naturen kallas processen att göra proteiner kodade av DNA/RNA-genetiskt material translation och involverar steg-för-steg-tillsats av aminosyror till en växande proteinkedja av ett ribozym som kallas en ribosom . I vilken ordning aminosyrorna tillsätts läses genom den genetiska koden från en mRNA- mall, som är en RNA- kopia av en av organismens gener .
Tjugotvå aminosyror är naturligt inkorporerade i polypeptider och kallas proteinogena eller naturliga aminosyror. Av dessa är 20 kodade av den universella genetiska koden. De återstående 2, selenocystein och pyrrolysin , inkorporeras i proteiner genom unika syntetiska mekanismer. Selenocystein inkorporeras när mRNA:t som översätts inkluderar ett SECIS-element , vilket gör att UGA-kodonet kodar för selenocystein istället för ett stoppkodon. Pyrrolysin används av vissa metanogena arkéer i enzymer som de använder för att producera metan . Det kodas för med kodonet UAG, som normalt är ett stoppkodon i andra organismer. Detta UAG-kodon följs av en PYLIS nedströmssekvens .
Flera oberoende evolutionära studier har föreslagit att Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr kan tillhöra en grupp aminosyror som utgjorde den tidiga genetiska koden, medan Cys, Met, Tyr, Trp, His, Phe kan tillhöra en grupp aminosyror som utgjorde senare tillägg av den genetiska koden.
Standard kontra icke-standardiserade aminosyror
De 20 aminosyrorna som kodas direkt av kodonen för den universella genetiska koden kallas standard- eller kanoniska aminosyror. En modifierad form av metionin ( N -formylmetionin ) inkorporeras ofta i stället för metionin som den initiala aminosyran i proteiner i bakterier, mitokondrier och kloroplaster. Andra aminosyror kallas icke-standardiserade eller icke-kanoniska . De flesta av de icke-standardiserade aminosyrorna är också icke-proteinogena (dvs. de kan inte inkorporeras i proteiner under translation), men två av dem är proteinogena, eftersom de kan inkorporeras translationellt i proteiner genom att utnyttja information som inte är kodad i den universella genetiska koden.
De två icke-standardiserade proteinogena aminosyrorna är selenocystein (finns i många icke-eukaryoter såväl som de flesta eukaryoter, men kodas inte direkt av DNA) och pyrrolysin (finns endast i vissa arkéer och åtminstone en bakterie ). Införlivandet av dessa icke-standardiserade aminosyror är sällsynt. Till exempel inkluderar 25 humana proteiner selenocystein i sin primära struktur, och de strukturellt karakteriserade enzymerna (selenoenzymer) använder selenocystein som den katalytiska delen i sina aktiva ställen. Pyrrolysin och selenocystein kodas via variantkodon. Till exempel kodas selenocystein av stoppkodon och SECIS-element .
N -formylmetionin (som ofta är den initiala aminosyran av proteiner i bakterier, mitokondrier och kloroplaster ) anses allmänt vara en form av metionin snarare än som en separat proteinogen aminosyra. Kodon- tRNA -kombinationer som inte finns i naturen kan också användas för att "expandera" den genetiska koden och bilda nya proteiner som kallas alloproteiner som innehåller icke-proteinogena aminosyror .
Icke-proteinogena aminosyror
Bortsett från de 22 proteinogena aminosyrorna är många icke-proteinogena aminosyror kända. De finns antingen inte i proteiner (till exempel karnitin , GABA , levotyroxin ) eller produceras inte direkt och isolerat av standardcellulära maskiner (till exempel hydroxiprolin och selenometionin ).
Icke-proteinogena aminosyror som finns i proteiner bildas genom posttranslationell modifiering , vilket är modifiering efter translation under proteinsyntes. Dessa modifieringar är ofta väsentliga för funktionen eller regleringen av ett protein. Till exempel karboxyleringen av glutamat bättre bindning av kalciumkatjoner , och kollagen innehåller hydroxiprolin, genererad genom hydroxylering av prolin . Ett annat exempel är bildningen av hypusin i translationsinitieringsfaktorn EIF5A , genom modifiering av en lysinrest. Sådana modifieringar kan också bestämma lokaliseringen av proteinet, t.ex. kan tillägg av långa hydrofoba grupper få ett protein att binda till ett fosfolipidmembran .
Vissa icke-proteinogena aminosyror finns inte i proteiner. Exempel inkluderar 2-aminoisosmörsyra och signalsubstansen gamma-aminosmörsyra . Icke-proteinogena aminosyror förekommer ofta som mellanprodukter i de metaboliska vägarna för standardaminosyror – till exempel förekommer ornitin och citrullin i ureacykeln , en del av aminosyrakatabolismen ( se nedan). Ett sällsynt undantag från dominansen av α-aminosyror i biologi är β-aminosyran beta alanin (3-aminopropansyra), som används i växter och mikroorganismer vid syntesen av pantotensyra (vitamin B 5 ), en komponent i koenzym A.
I mänsklig näring
När de tas upp i människokroppen från kosten, används de 20 standardaminosyrorna antingen för att syntetisera proteiner, andra biomolekyler eller oxideras till urea och koldioxid som en energikälla. Oxidationsvägen börjar med avlägsnandet av aminogruppen genom ett transaminas ; aminogruppen matas sedan in i ureacykeln . Den andra produkten av transamidering är en ketosyra som går in i citronsyracykeln . Glukogena aminosyror kan också omvandlas till glukos genom glukoneogenes . Av de 20 standardaminosyrorna kallas nio ( His , Ile , Leu , Lys , Met , Phe , Thr , Trp och Val ) essentiella aminosyror eftersom människokroppen inte kan syntetisera dem från andra föreningar på den nivå som behövs för normal tillväxt, så de måste fås från mat. Dessutom betraktas cystein, tyrosin och arginin som semessentiella aminosyror och taurin som en halvessentiell aminosulfonsyra hos barn. De metaboliska vägarna som syntetiserar dessa monomerer är inte fullt utvecklade. De mängder som krävs beror också på individens ålder och hälsa, så det är svårt att göra generella uttalanden om kostbehovet för vissa aminosyror. Kostexponering för den icke-standardiserade aminosyran BMAA har kopplats till mänskliga neurodegenerativa sjukdomar, inklusive ALS .
• PLD: fosfolipas D • PA: fosfatidinsyra • mTOR: mekanistiskt mål för rapamycin • AMP: adenosinmonofosfat • ATP: adenosintrifosfat • AMPK: AMP-aktiverat proteinkinas • PGC-1α: peroxisomproliferatoraktiverad receptor-1α samverkande receptor S6K1: p70S6 kinas • 4EBP1: eukaryotisk translationsinitieringsfaktor 4E-bindande protein 1 • eIF4E: eukaryotisk translationsinitieringsfaktor 4E • RPS6: ribosomalt protein S6 • eEF2: eukaryotisk förlängningsfaktor 2 • RE: motståndsträning; EE: uthållighetsträning • Myo: myofibrillar ; Mito: mitokondriell • AA: aminosyror • HMB: β-hydroxi β-metylsmörsyra • ↑ representerar aktivering • Τ representerar hämning
Icke-proteinfunktioner
|
|
Hos människor har icke-proteinaminosyror också viktiga roller som metaboliska mellanprodukter , såsom i biosyntesen av signalsubstansen gamma-aminosmörsyra (GABA). Många aminosyror används för att syntetisera andra molekyler, till exempel:
- Tryptofan är en föregångare till signalsubstansen serotonin .
- Tyrosin ( och dess prekursor fenylalanin) är föregångare till katekolaminneurotransmittorerna dopamin , epinefrin och noradrenalin och olika spåraminer .
- Fenylalanin är en föregångare till fenetylamin och tyrosin hos människor. I växter är det en föregångare till olika fenylpropanoider , som är viktiga i växternas metabolism.
- Glycin är en föregångare till porfyriner såsom hem .
- Arginin är en föregångare till kväveoxid .
- Ornitin och S -adenosylmetionin är prekursorer till polyaminer .
- Aspartat , glycin och glutamin är prekursorer till nukleotider . Emellertid är inte alla funktionerna hos andra rikliga icke-standardiserade aminosyror kända.
Vissa icke-standardiserade aminosyror används som försvar mot växtätare i växter. Till exempel canavanine en analog av arginin som finns i många baljväxter , och i särskilt stora mängder i Canavalia gladiata (svärdböna). Denna aminosyra skyddar växterna från rovdjur som insekter och kan orsaka sjukdom hos människor om vissa typer av baljväxter äts utan bearbetning. Den icke-proteinbaserade aminosyran mimosin finns i andra arter av baljväxter, i synnerhet Leucaena leucocephala . Denna förening är en analog till tyrosin och kan förgifta djur som betar på dessa växter.
Används inom industrin
Gödselmedel
Aminosyrornas kelatbildande förmåga används ibland i gödningsmedel för att underlätta leveransen av mineraler till växter för att korrigera mineralbrister, såsom järnkloros. Dessa gödselmedel används också för att förhindra att brister uppstår och för att förbättra växternas allmänna hälsa.
Djurfoder
Aminosyror tillsätts ibland till djurfoder eftersom vissa av komponenterna i dessa foder, såsom sojabönor , har låga nivåer av några av de essentiella aminosyrorna , särskilt av lysin, metionin, treonin och tryptofan. Likaså används aminosyror för att kelera metallkatjoner för att förbättra absorptionen av mineraler från fodertillskott.
Mat
Livsmedelsindustrin är en storkonsument av aminosyror, särskilt glutaminsyra , som används som smakförstärkare , och aspartam (aspartylphenylalanine 1-methyl ester), som används som ett konstgjort sötningsmedel . Aminosyror tillsätts ibland till mat av tillverkare för att lindra symtom på mineralbrist, såsom anemi, genom att förbättra mineralabsorptionen och minska negativa biverkningar från oorganiska mineraltillskott.
Läkemedel och kosmetika
På liknande sätt används vissa aminosyraderivat inom läkemedelsindustrin. De inkluderar 5-HTP (5-hydroxitryptofan) som används för experimentell behandling av depression, L -DOPA ( L -dihydroxifenylalanin) för Parkinsons behandling och eflornitinläkemedel som hämmar ornitindekarboxylas och används vid behandling av sömnsjuka . Aminosyror används i syntesen av vissa kosmetika .
Utökad genetisk kod
Sedan 2001 har 40 icke-naturliga aminosyror lagts till protein genom att skapa ett unikt kodon (omkodning) och ett motsvarande transfer-RNA:aminoacyl – tRNA-syntetas-par för att koda för det med olika fysikalisk-kemiska och biologiska egenskaper för att kunna användas som ett verktyg för att utforska proteinstruktur och funktion eller för att skapa nya eller förbättrade proteiner.
Nullomerer
Nullomerer är kodon som i teorin kodar för en aminosyra, men i naturen finns det en selektiv bias mot att använda detta kodon till förmån för ett annat, till exempel föredrar bakterier att använda CGA istället för AGA för att koda för arginin. Detta skapar några sekvenser som inte förekommer i genomet. Denna egenskap kan utnyttjas och användas för att skapa nya selektiva cancerbekämpande läkemedel och för att förhindra korskontaminering av DNA-prover från brottsplatsundersökningar.
Kemiska byggstenar
Aminosyror är viktiga som lågkostnadsråvara . Dessa föreningar används i kiral poolsyntes som enantiomeriskt rena byggstenar.
Aminosyror har undersökts som prekursorer för kirala katalysatorer, såsom för asymmetriska hydreringsreaktioner , även om inga kommersiella tillämpningar existerar.
Biologiskt nedbrytbar plast
Aminosyror har betraktats som komponenter i biologiskt nedbrytbara polymerer, som har tillämpningar som miljövänliga förpackningar och i medicin vid läkemedelsleverans och konstruktion av protetiska implantat . Ett intressant exempel på sådana material är polyaspartat , en vattenlöslig biologiskt nedbrytbar polymer som kan ha tillämpningar i engångsblöjor och jordbruk. På grund av sin löslighet och förmåga att kelatera metalljoner används polyaspartat också som ett biologiskt nedbrytbart anti- avlagringsmedel och en korrosionsinhibitor . Dessutom har den aromatiska aminosyran tyrosin ansetts vara en möjlig ersättning för fenoler som bisfenol A vid tillverkning av polykarbonater .
Syntes
Kemisk syntes
Den kommersiella produktionen av aminosyror är vanligtvis beroende av muterade bakterier som överproducerar individuella aminosyror med glukos som kolkälla. Vissa aminosyror produceras genom enzymatiska omvandlingar av syntetiska mellanprodukter. 2-aminotiazolin-4-karboxylsyra är en mellanprodukt i en industriell syntes av till exempel L -cystein . Asparaginsyra produceras genom tillsats av ammoniak till fumarat med hjälp av ett lyas.
Biosyntes
I växter assimileras kväve först i organiska föreningar i form av glutamat , bildat av alfa-ketoglutarat och ammoniak i mitokondrien. För andra aminosyror använder växter transaminaser för att flytta aminogruppen från glutamat till en annan alfa-ketosyra. Till exempel omvandlar aspartataminotransferas glutamat och oxaloacetat till alfa-ketoglutarat och aspartat. Andra organismer använder också transaminaser för aminosyrasyntes.
Icke-standardiserade aminosyror bildas vanligtvis genom modifieringar av standardaminosyror. Till exempel bildas homocystein genom transsulfureringsvägen eller genom demetylering av metionin via den intermediära metaboliten S - adenosylmetionin, medan hydroxiprolin framställs genom en posttranslationell modifiering av prolin .
Mikroorganismer och växter syntetiserar många ovanliga aminosyror. Till exempel gör vissa mikrober 2-aminoisosmörsyra och lantionin , som är ett sulfidbryggt derivat av alanin. Båda dessa aminosyror finns i peptidiska lantibiotika som alameticin . Men i växter 1-aminocyklopropan-1-karboxylsyra en liten disubstituerad cyklisk aminosyra som är en mellanprodukt i produktionen av växthormonet eten .
Ursyntes
Bildandet av aminosyror och peptider antas föregå och kanske inducera uppkomsten av liv på jorden . Aminosyror kan bildas från enkla prekursorer under olika förhållanden. Ytbaserad kemisk metabolism av aminosyror och mycket små föreningar kan ha lett till uppbyggnad av aminosyror, koenzymer och fosfatbaserade små kolmolekyler. [ ytterligare citat behövs ] Aminosyror och liknande byggstenar kunde ha utvecklats till protopeptider, där peptider anses vara nyckelspelare i livets ursprung.
I det berömda Urey-Miller-experimentet producerar passagen av en elektrisk ljusbåge genom en blandning av metan, väte och ammoniak ett stort antal aminosyror. Sedan dess har forskare upptäckt en rad sätt och komponenter genom vilka den potentiellt prebiotiska bildningen och kemiska utvecklingen av peptider kan ha skett, såsom kondenseringsmedel, designen av självreplikerande peptider och ett antal icke-enzymatiska mekanismer genom vilka amino syror kunde ha dykt upp och utvecklats till peptider. Flera hypoteser åberopar Strecker-syntesen där vätecyanid, enkla aldehyder, ammoniak och vatten producerar aminosyror.
Enligt en granskning dyker aminosyror, och till och med peptider, upp ganska regelbundet i de olika experimentbuljongerna som har tillåtits tillagas av enkla kemikalier. Det beror på att nukleotider är mycket svårare att syntetisera kemiskt än aminosyror. För en kronologisk ordning antyder det att det måste ha funnits en 'proteinvärld' eller åtminstone en 'polypeptidvärld', möjligen senare följt av ' RNA-världen ' och ' DNA-världen '. Kartläggning av kodon -aminosyror kan vara det biologiska informationssystemet vid livets ursprungliga ursprung på jorden. Medan aminosyror och följaktligen enkla peptider måste ha bildats under olika experimentellt undersökta geokemiska scenarier, är övergången från en abiotisk värld till de första livsformerna till stor del fortfarande olöst.
Reaktioner
Aminosyror genomgår de reaktioner som förväntas av de ingående funktionella grupperna.
Peptidbindningsbildning

Eftersom både amin- och karboxylsyragrupperna i aminosyrorna kan reagera för att bilda amidbindningar, kan en aminosyramolekyl reagera med en annan och förenas genom en amidbindning. Denna polymerisation av aminosyror är det som skapar proteiner. Denna kondensationsreaktion ger den nybildade peptidbindningen och en vattenmolekyl. I celler sker denna reaktion inte direkt; istället aktiveras aminosyran först genom bindning till en transfer-RNA- molekyl genom en esterbindning . Detta aminoacyl-tRNA produceras i en ATP -beroende reaktion utförd av ett aminoacyl-tRNA-syntetas . Detta aminoacyl-tRNA är sedan ett substrat för ribosomen, som katalyserar attacken av aminogruppen i den förlängda proteinkedjan på esterbindningen. Som ett resultat av denna mekanism syntetiseras alla proteiner gjorda av ribosomer med början vid deras N -terminal och rör sig mot deras C -terminal.
Men inte alla peptidbindningar bildas på detta sätt. I några få fall syntetiseras peptider av specifika enzymer. Till exempel är tripeptiden glutation en väsentlig del av cellers försvar mot oxidativ stress. Denna peptid syntetiseras i två steg från fria aminosyror. I det första steget gamma-glutamylcysteinsyntetas cystein och glutamat genom en peptidbindning som bildas mellan sidokedjans karboxyl i glutamatet (gammakolet i denna sidokedja) och aminogruppen i cysteinet. Denna dipeptid kondenseras sedan med glycin av glutationsyntetas för att bilda glutation.
Inom kemin syntetiseras peptider genom en mängd olika reaktioner. En av de mest använda i fastfas peptidsyntes använder de aromatiska oximderivaten av aminosyror som aktiverade enheter. Dessa tillsätts i sekvens till den växande peptidkedjan, som är fäst vid ett fast hartsstöd. Bibliotek av peptider används i läkemedelsupptäckt genom screening med hög genomströmning .
Kombinationen av funktionella grupper tillåter aminosyror att vara effektiva polydentatligander för metall-aminosyrakelater. De multipla sidokedjorna av aminosyror kan också genomgå kemiska reaktioner.
Katabolism

Katabolism av proteinogena aminosyror. Aminosyror kan klassificeras efter egenskaperna hos deras huvudsakliga nedbrytningsprodukter: * Glukogena , varvid produkterna har förmågan att bilda glukos genom glukoneogenes * Ketogena , varvid produkterna inte har förmågan att bilda glukos. Dessa produkter kan fortfarande användas för ketogenes eller lipidsyntes . * Aminosyror kataboliseras till både glukogena och ketogena produkter.
Nedbrytning av en aminosyra involverar ofta deaminering genom att flytta dess aminogrupp till alfa-ketoglutarat, vilket bildar glutamat . Denna process involverar transaminaser, ofta samma som de som används vid aminering under syntes. Hos många ryggradsdjur avlägsnas sedan aminogruppen genom ureacykeln och utsöndras i form av urea . Emellertid kan aminosyranedbrytning producera urinsyra eller ammoniak istället. Till exempel serindehydratas serin till pyruvat och ammoniak. Efter avlägsnande av en eller flera aminogrupper kan resten av molekylen ibland användas för att syntetisera nya aminosyror, eller så kan den användas för energi genom att gå in i glykolys eller citronsyracykeln, som beskrivs i bilden till höger.
Komplexering
Aminosyror är tvåtandade ligander som bildar aminosyrakomplex av övergångsmetall .
Kemisk analys
Den totala kvävehalten i organiskt material bildas huvudsakligen av aminogrupperna i proteiner. Totalt Kjeldahl-kväve ( TKN ) är ett mått på kväve som används i stor utsträckning vid analys av (avlopps)vatten, jord, livsmedel, foder och organiskt material i allmänhet. Som namnet antyder tillämpas Kjeldahl-metoden . Det finns känsligare metoder.
Se även
Anteckningar
Vidare läsning
- Tymoczko JL (2012). "Proteinsammansättning och struktur" . Biokemi . New York: WH Freeman och företag. s. 28–31. ISBN 9781429229364 .
- Doolittle RF (1989). "Redundanser i proteinsekvenser". I Fasman GD (red.). Förutsägelser om proteinstruktur och principerna för proteinkonformation . New York: Plenum Press . s. 599–623. ISBN 978-0-306-43131-9 . LCCN 89008555 .
- Nelson DL, Cox MM (2000). Lehninger Principles of Biochemistry (3:e upplagan). Worth Publishers . ISBN 978-1-57259-153-0 . LCCN 99049137 .
- Meierhenrich U (2008). Aminosyror och livets asymmetri (PDF) . Berlin: Springer Verlag . ISBN 978-3-540-76885-2 . LCCN 2008930865 . Arkiverad från originalet (PDF) den 12 januari 2012.
externa länkar
-
 Media relaterade till aminosyra på Wikimedia Commons
Media relaterade till aminosyra på Wikimedia Commons