Delta endotoxin
| delta endotoxin, N-terminal domän | |||||||||
|---|---|---|---|---|---|---|---|---|---|
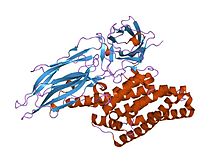 kristallstruktur av den insekticida bakterien del endotoxin Cry3Bb1 Bacillus thuringiensis
| |||||||||
| Identifiers | |||||||||
| Symbol | Endotoxin_N | ||||||||
| Pfam | PF03945 | ||||||||
| InterPro | IPR005639 | ||||||||
| SCOP2 | 1dlc / SCOPe / SUPFAM | ||||||||
| TCDB | 1.C.2 | ||||||||
| |||||||||
| delta-endotoxin, | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| mellandomänidentifierare | |||||||||
| Symbol | Endotoxin_M | ||||||||
| Pfam | PF00555 | ||||||||
| Pfam klan | CL0568 | ||||||||
| InterPro | IPR015790 | ||||||||
| SCOP2 | 1dlc / SCOPe / SUPFAM | ||||||||
| TCDB | 1.C.2 | ||||||||
| |||||||||
| delta-endotoxin, mellandomän, Cry2A och Cry18 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 insekticid kristallprotein cry2aa-
| |||||||||
| identifierare | |||||||||
| Symbol | Endotoxin_mid | ||||||||
| Pfam | PF09131 | ||||||||
| InterPro | IPR015214 | ||||||||
| SCOP2 | 1i5p / SCOPe / SUPFAM | ||||||||
| |||||||||
| delta-endotoxin, C-terminala | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| identifierare | |||||||||
| Symbol | Endotoxin_C | ||||||||
| Pfam | PF03944 | ||||||||
| Pfam klan | CL0202 | ||||||||
| InterPro | IPR005638 | ||||||||
| SCOP2 | 1dlc / SCOPe / SUPFAM | ||||||||
| TCDB | 1.C.2 | ||||||||
| CDD | cd04085 | ||||||||
| |||||||||
| Cytolytiska Delta-endotoxin Cyt1/2- | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| identifierare | |||||||||
| Symbol | CytB | ||||||||
| Pfam | PF01338 | ||||||||
| InterPro | IPR001615 | ||||||||
| SCOP2 | 1cby / SCOPe / SUPFAM | ||||||||
| TCDB | 1.C.71 | ||||||||
| |||||||||
Delta-endotoxiner ( δ-endotoxiner) är porbildande toxiner som produceras av Bacillus thuringiensis- arter av bakterier. De är användbara för sin insekticida verkan och är det primära toxinet som produceras av Bt-majs/majs . Under sporbildning producerar bakterierna kristaller av sådana proteiner (därav namnet Cry -toxiner) som också är kända som parasporala kroppar , bredvid endosporerna ; som ett resultat är vissa medlemmar kända som ett parasporin . Cyt (cytolytiska) toxingruppen är en grupp delta-endotoxiner som skiljer sig från Cry-gruppen .
Handlingsmekanism
När en insekt får i sig dessa proteiner aktiveras de av proteolytisk klyvning. N-terminalen klyvs i alla proteinerna och en C-terminal förlängning klyvs i vissa medlemmar. När endotoxinet väl har aktiverats binder det till tarmepitelet och orsakar cellys genom bildandet av katjonselektiva kanaler, vilket leder till döden.
Under många år fanns det ingen klarhet om förhållandet mellan aminopeptidas N och Bt-toxiner. Även om AP-N binder Cry-proteiner in vitro (recensat av Soberón et al. 2009 och Pigott & Ellar 2007), var inga fall av resistens – eller ens minskad in vitro-bindning – på grund av förändringar i AP-N-strukturen kända till och med 2002, och det fanns visst tvivel om att motståndsmekanismen var så rak fram. I själva verket har Luo et al. 1997, Mohammed et al. 1996, och Zhu et al. 2000 fann positivt att detta inte förekom i Lepidoptera-exempel. Därefter har emellertid Herrero et al. 2005 visade korrelation mellan icke-uttryck och Bt-resistens, och faktisk resistens hittades i Helicoverpa armigera av Zhang et al. 2009, i Ostrinia nubilalis av Khajuria et al. 2011, och i Trichoplusia ni av Baxter et al. 2011 och Tiewsiri & Wang 2011 (även alla Lepidoptera). Det fortsätter att finnas bekräftelse på att AP-N inte i sig själva påverkar resistens i vissa fall, möjligen på grund av att sekventiell bindning av toxinet krävs för att producera dess effekt. I denna sekvens är varje bindningssteg teoretiskt sett inte oumbärligt, men om det inträffar bidrar det till det slutliga porbildningsresultatet.
Strukturera
Den aktiverade regionen av deltatoxinet är sammansatt av tre distinkta strukturella domäner : en N-terminal helixdomän ( InterPro : IPR005639 ) involverad i membraninförande och porbildning; en av beta-ark involverad i receptorbindning; och en C-terminal beta-sandwich-domän ( InterPro : IPR005638 ) som interagerar med den N-terminala domänen för att bilda en kanal.
Typer
B. thuringiensis kodar för många proteiner från delta-endotoxinfamiljen ( InterPro : IPR038979 ), med vissa stammar som kodar för flera typer samtidigt. En gen som oftast finns på plasmider, delta-entotoxiner dyker ibland upp i genom från andra arter, om än i en lägre andel än de som finns i B. thuringiensis . Gennamnen ser ut som Cry3Bb , vilket i det här fallet indikerar ett Cry-toxin från superfamilj 3 familj B underfamilj b.
Cry -proteiner som är intressanta för cancerforskningen listas under en parasporin-nomenklatur (PS) förutom Cry-nomenklaturen. De dödar inte insekter, utan dödar istället leukemiceller. Cyt-toxiner tenderar att bilda sin egen grupp skild från Cry-toxiner. Inte alla Cry - kristallformade - toxiner delar direkt en gemensam rot. Exempel på icke-tredomäntoxiner som ändå har ett Cry - namn inkluderar Cry34/35Ab1 och relaterade beta-sandwich binära ( Bin -liknande) toxiner, Cry6Aa och många beta-sandwichparasporiner.
Specifika delta-endotoxiner som har infogats med genteknik inkluderar Cry3Bb1 som finns i MON 863 och Cry1Ab som finns i MON 810 , som båda är majs-/majs-sorter. Cry3Bb1 är särskilt användbart eftersom det dödar Coleopteran-insekter som majsrotmasken, en aktivitet som inte ses i andra Cry-proteiner. Andra vanliga toxiner inkluderar Cry2Ab och Cry1F i bomull och majs/majs . Dessutom Cry1Ac effektivt som vaccinadjuvans hos människor.
Vissa insektspopulationer har börjat utveckla resistens mot delta-endotoxin, med fem resistenta arter som hittades från och med 2013. Växter med två sorters delta-endotoxiner tenderar att få resistens att gå långsammare, eftersom insekterna måste utvecklas för att övervinna båda toxinerna på en gång. Att plantera icke-Bt-växter med de resistenta plantorna kommer att minska urvalstrycket för att utveckla toxinet. Slutligen bör tvåtoxinväxter inte planteras med entoxinväxter, eftersom entoxinväxter fungerar som en språngbräda för anpassning i detta fall.
Vidare läsning
- Bravo A, Gill SS, Soberón M (mars 2007). "Verkningssätt för Bacillus thuringiensis Cry och Cyt toxiner och deras potential för insektsbekämpning" . Toxikon . 49 (4): 423–435. doi : 10.1016/j.toxicon.2006.11.022 . PMC 1857359 . PMID 17198720 .
- Pigott CR, Ellar DJ (juni 2007). "Receptorernas roll i Bacillus thuringiensis kristalltoxinaktivitet" . Mikrobiologi och molekylärbiologi recensioner . 71 (2): 255–281. doi : 10.1128/MMBR.00034-06 . PMC 1899880 . PMID 17554045 .
- Palma L, Muñoz D, Berry C, Murillo J, Caballero P (december 2014). " Bacillus thuringiensis- toxiner: en översikt över deras biocidala aktivitet" . Toxiner . 6 (12): 3296–3325. doi : 10.3390/toxiner6123296 . PMC 4280536 . PMID 25514092 .