Mjältbrand toxin
| Mjältbrand toxin dödlig faktor mellandomän | |||||||||
|---|---|---|---|---|---|---|---|---|---|
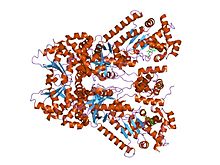 Röntgenkristallstruktur av mjältbrands dödlig faktor bunden till en liten molekylhämmare, bi-mfm3, 3-{5-[5-(4-klor-fenyl)-furan-2-ylmetylen]- 4-oxo-2-tioxo-tiazolidin-3-yl}-propionsyra.
| |||||||||
| Identifierare | |||||||||
| Symbol | Anthrax-tox_M | ||||||||
| Pfam | PF09156 | ||||||||
| InterPro | IPR015239 | ||||||||
| SCOP2 | 1j7n / SCOPe / SUPFAM | ||||||||
| OPM superfamilj | 35 | ||||||||
| |||||||||
| Mjältbrandstoxin dödlig faktor N- och C-terminala domäner | |||||||||
|---|---|---|---|---|---|---|---|---|---|
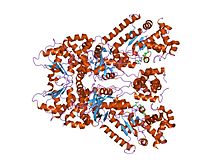 kristallstruktur av mjältbrandsdödlig faktor komplexbunden med tioacetyl-tyr-pro-met-amid, en metallkelaterande peptidylhämmare av små molekyler.
| |||||||||
| Identifierare | |||||||||
| Symbol | ATLF | ||||||||
| Pfam | PF07737 | ||||||||
| InterPro | IPR014781 | ||||||||
| MEROPS | M34 | ||||||||
| SCOP2 | 1pwq / SCOPe / SUPFAM | ||||||||
| |||||||||
| Identifierare av | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| mjältbrandstoxin LF subenhet | |||||||||
| Symbol | Anthrax_toxA | ||||||||
| Pfam | PF03497 | ||||||||
| SCOP2 | 1jky / SCOPe / SUPFAM | ||||||||
| |||||||||

Mjältbrandstoxin är ett exotoxin med tre proteiner som utsöndras av virulenta stammar av bakterien Bacillus anthracis - det orsakande medlet för mjältbrand . Toxinet upptäcktes först av Harry Smith 1954. Mjältbrandstoxin är sammansatt av ett cellbindande protein, känt som skyddande antigen (PA), och två enzymkomponenter, kallad ödemfaktor (EF) och dödlig faktor (LF). Dessa tre proteinkomponenter verkar tillsammans för att ge sina fysiologiska effekter. Sammansatta komplex som innehåller toxinkomponenterna endocyteras . I endosomen translokerar de enzymatiska komponenterna av toxinet till cytoplasman i en målcell. Väl i cytosolen stör de enzymatiska komponenterna i toxinet olika immuncellsfunktioner, nämligen cellulär signalering och cellmigration. Toxinet kan till och med inducera cellys, vilket observeras för makrofagceller . Mjältbrandstoxin gör att bakterierna kan undvika immunförsvaret , föröka sig och slutligen döda värddjuret. Forskning om mjältbrandstoxin ger också insikt i genereringen av makromolekylära sammansättningar och om proteintranslokation , porbildning, endocytos och andra biokemiska processer.
Bacillus anthracis virulensfaktorer
Mjältbrand är en sjukdom som orsakas av Bacillus anthracis , en sporbildande, grampositiv , stavformad bakterie (Fig. 1). Sjukdomens dödlighet orsakas av bakteriens två huvudsakliga virulensfaktorer: (i) polyglutaminsyrakapseln, som är antifagocytisk , och (ii) det tredelade proteintoxinet, kallat mjältbrandstoxin. Mjältbrandstoxin är en blandning av tre proteinkomponenter : (i) skyddande antigen (PA), (ii) ödemfaktor (EF) och (iii) dödlig faktor (LF).
Handlingsmekanism
Mjältbrandstoxin är ett AB- toxin . Varje enskilt mjältbrandstoxinprotein är icke-toxiskt. Toxiska symtom observeras inte när dessa proteiner injiceras individuellt i laboratoriedjur. Samtidig injektion av PA och EF orsakar ödem , och samtidig injektion av PA och LF är dödlig. Den förra kombinationen kallas ödemtoxin, och den senare kombinationen kallas dödligt toxin. Sålunda kräver manifestationen av fysiologiska symtom PA, i båda fallen.
PA-kravet som observerats i djurmodellexperiment visar ett vanligt paradigm för bakteriella toxiner, kallat A / B -paradigmet. A - komponenten är enzymatiskt aktiv och B -komponenten är den cellbindande komponenten. Mjältbrandstoxin är av formen A 2 B , där de två enzymerna , EF och LF, är A- komponenterna och PA är B - komponenten. Således fungerar PA som en trojansk häst , som bär EF och LF genom plasmamembranet in i cytosolen, där de sedan kan katalysera reaktioner som stör normal cellfysiologi. [ citat behövs ]
Anthrax toxin montering och translokation
Mjältbrandstoxinproteinkomponenter måste samlas till holotoxinkomplex för att fungera. För att LF och EF ska fungera inuti en målcell måste de lokalisera sig till cellen och gå in i dess cytoplasma. Genom en serie steg kan PA translokera EF och LF in i cellen (Fig. 2). Denna process startar när 83-kDa-formen av PA, kallad PA83, binder till en mjältbrandstoxinreceptor. Det finns två kända homologa receptorer, som binder till PA83, kallade tumörendotelmarkör - 8 ( TEM8 ) och kapillärmorfogenesprotein 2 ( CMG2 ) . Sedan klyvs ett 20 kDa fragment (PA20) från PA83:s aminoterminal av membranendoproteaser från furinfamiljen. När PA20 dissocierar kan den återstående receptorbundna delen av PA, kallad PA63, sammanfogas till antingen en heptamerisk eller oktamerisk ringformad oligomer . Denna ringformade oligomer hänvisas ofta till som pre-pore (eller pre-kanal) formen av PA, eftersom det senare i vägen kommer att bli en translokas por (eller kanal). Ytan av pre-pore-oligomeren, som exponerades vid frisättning av PA20-delen, kan sedan binda till LF och EF. De heptamera och oktamera formerna av PA-oligomeren kan sedan binda med upp till tre eller fyra molekyler av EF respektive/eller LF. Cellen endocyterar sedan dessa sammansatta komplex och transporterar dem till ett surt fack i cellen. Det låga pH som påträffas i endosomen gör att PA63-förkanalen omvandlas till en katjonselektiv kanal. EF och LF drivs genom kanalen av en pH-gradient, vilket gör att enzymfaktorerna kan komma in i cytosolen .
Enzymfunktion hos LF och EF
Väl i cytosolen utför EF och LF sina respektive skadeinducerande processer.
- EF fungerar som ett Ca 2+ och kalmodulinberoende adenylatcyklas som kraftigt ökar nivån av cAMP i cellen. Denna ökning av cAMP stör vattenhomeostasen , obalanserar allvarligt de intracellulära signalvägarna och försämrar makrofagernas funktion, vilket gör att bakterierna kan undkomma immunsystemet ytterligare.
- LF hjälper också bakterierna att undvika immunförsvaret genom att döda makrofager. Väl i dessa celler fungerar LF som ett Zn2 + -beroende endoproteas som klipper av N-terminalen av mitogenaktiverade proteinkinaskinaser (MAPKK) . Detta hämmar dessa kinaser genom att inte tillåta dem att effektivt binda till sina substrat, vilket leder till förändrade signalvägar och i slutändan till apoptos .
Således leder den synergistiska effekten av dessa tre proteiner till celldöd genom en kaskad av händelser som tillåter proteinerna att komma in i cellen och stör cellulär funktion.
Extracellulärt toxinstruktur-funktionsförhållande
Mekanismen för mjältbrandstoxinverkan är resultatet av de molekylära strukturerna hos de tre toxinproteinerna i kombination med värdcellens biomolekyler. De molekylära interaktionerna är uppenbara när man utför en detaljerad analys av strukturerna för PA, EF, LF och de cellulära receptorerna ( ANTXR1 och ANTXR2 ). Strukturer för toxinmolekylerna (fig. 3–5), receptorn och för molekylernas komplex gav alla insikt om dessa proteiners synergistiska verkan. Analyser av bindningsställen och konformationsförändringar förstärkte de strukturella studierna och klargjorde funktionerna för varje domän av PA, LF och EF, som kortfattat beskrivs i Tabell 1.
Strukturen hos PA var den första som bestämdes (fig. 3). Denna struktur och den hos dess cellulära receptor kastar mycket ljus över specificiteten för igenkänning och bindning. Denna specificitet för PA och receptorn CMG2 (liknar typ I-intergins) beror på interaktioner genom ett metalljonberoende adhesionsställe (MIDAS), ett hydrofobt spår och ett β-hårnålsutsprång. Dessa bidrar alla till en tät interaktion där mycket proteinyta på CMG2 (och TEM8) är begravd.

Petosa et al. löste strukturen för en PA63-heptamer vid 4,5 Å (0,45 nm). Strukturen som de löste var en icke-membranbunden pre-por, konformationen av heptameren innan komplexet sträcker sig en β-trumma genom plasmamembranet för att skjuta LF och EF in i cytosolen.
Heptamerisering och porbildning hindras steriskt av PA20-fragmentet, men när det avlägsnas från toppen av monomeren bildas förporen snabbt. Heptamerbildningen orsakar inga större förändringar i konformationen av varje enskild monomer, men genom att sammanföras begravs mer än 15400 Ų (154 nm 2 ) av proteinytan. Denna nedgrävda yta består mestadels av polära eller laddade sidogrupper från domänerna 1 och 2.
PA bildar också en oktamerisk förkanalstruktur. Den oktameriska formen visade sig vara mer termostabil än den heptameriska formen, och följaktligen kan den oktameriska oligomeren kvarstå i värdens plasma under en mjältbrandsinfektion.
Under oligomeriseringen av PA63 binder molekyler av EF och/eller LF snabbt och samtidigt till PA-förkanalen. Denna bindning uppstår eftersom efter avlägsnande av PA20-domänen, en stor hydrofob yta avtäcks på domän 1 av PA63. Domän 1 ger en stor yta som interagerar med N-terminalen av EF och LF, som är nästan helt homolog för de första ~36 resterna och liknande i tertiär struktur för de första ~250 resterna. Studier på bindningsregionen av LF och EF visade att en stor ytarea kommer i kontakt med domän 1 av två intilliggande PA63-molekyler när de är i heptamerkonformationen. Denna stora bindningsyta förklarar varför tidigare studier bara kunde binda upp till tre molekyler på en PA63-heptamer. Samkristallstrukturen för PA-oktameren i komplex med N-terminal LF avslöjade att bindningsinteraktionen i själva verket är två diskontinuerliga ställen. En plats, kallad C-terminal subsite, liknar en klassisk "hot-spot" med förutspådda saltbryggor och elektrostatiska interaktioner. Den andra platsen, som kallas alfa-klämmans underställe, är en djup klyfta som ospecifikt binder den N-terminala alfahelixen och den korta beta-strängen av LF, vilket leder substratets N-terminal mot PA-förkanalens lumen. På detta sätt hjälper alfa-klämman till proteintranslokation, binder ospecifikt och vecklar ut sekundär struktur när den vecklas ut från substratet. LF/EF-bindningsstället används nu för leverans av terapeutika via fusionsproteiner.
Vid bildning av prepore och vidhäftning av LF och/eller EF, migrerar heptameren till en lipidflotta där den snabbt endocytoseras. Endocytos uppstår som ett resultat av en rad händelser. Detta börjar när CMG2 eller TEM8 palmitoyleras, vilket hämmar associeringen av receptorn med lipidflottar. Detta hämmar receptorn från att endocytoseras innan PA83 klyvs och innan LF eller EF kan associeras med heptameren. Återassociering av receptorn med de kolesterol- och glykosfigolipidrika mikrodomänerna ( lipidflottar ) sker när PA63 binder till receptorn och heptameriseras. När receptorn och PA återvänder till lipidflotten, ubiquitinerar E3 ubiquitinligas Cb1 den cytoplasmatiska svansen av receptorn, vilket signalerar receptorn och associerade toxinproteiner för endocytos. Dynamin och Eps15 krävs för att denna endocytos ska inträffa, vilket indikerar att mjältbrandstoxin kommer in i cellen via den klatrinberoende vägen.
Som diskuterats interagerar varje molekyl med flera andra för att inducera endocytosen av mjältbrandstoxinet. Väl inuti överförs komplexet till ett surt fack, där heptameren, fortfarande i den icke-membranövergripande pre-pore-konformationen, förbereds för translokation av EF och LF till cytosolen.
Struktur-funktionsförhållande från vesikel till cytosol
Porbildning
Vid första anblicken ser den primära sekvensen av PA inte ut som den hos ett membranomspännande protein. En hydrofobicitetsplot saknar alla mönster som är gemensamma för möjliga membranomspännande domäner. Strukturerna hos andra multimera membranproteiner (som difteritoxin ) ger svaret på hur PA lyckas spänna över membranet. Man tror att PA fungerar som dessa multimera membranproteiner som bildar β-fat gjorda av sträckor av både polära och opolära aminosyror från varje monomer.
Bildandet av β-fatporen underlättas med en sänkning av pH. För att bilda fatet när pH sjunker måste PA63-domän 2 genomgå den största konformationsförändringen. Vid granskning av strukturen för domän 2 (fig. 7) kan man se att denna domän innehåller ett grekisk nyckelmotiv (gulddelen i fig. 7). Ett allmänt schema över ett grekisk nyckelmotiv visas i fig. 8. Till den grekiska nyckeln i domän 2 är en stor oordnad slinga fäst. Nödvändigheten av denna slinga vid porbildning visas genom att använda mutagenes och proteolys av slingan med kymotrypsin. Ytterligare elektrofysiologiska mätningar av cysteinsubstitutioner placerar aminosyrorna i denna loop inuti lumen av den membraninsatta poren. Den oordnade slingan i domän 2 har också ett mönster av alternerande hydrofoba och hydrofila aminosyror, vilket är ett mönster som bevaras i de membranomspännande delarna av poriner. Det enda problemet är att slingan inte är tillräckligt stor för att spänna över ett membran i en β-pipa. Denna membraninsättning kunde endast ske med ytterligare konformationsförändringar. En stor konformationsförändring äger rum där det grekiska nyckelmotivet vecklas ut och bildar en β-hårnål som skjuter ut nedåt i membranet och bildar en β-pipa med de andra 6 monomererna i komplexet (figur 9a och 9b). Den slutliga poren har en diameter på 12 Å (1,2 nm), vilket passar det teoretiska värdet av denna modell.
Denna modell skulle kräva stora konformationsförändringar i domän 2 tillsammans med brytningen av många vätebindningar när det grekiska nyckelmotivet lossnar från mitten av domänen. Petosa et al. föreslagit en modell för hur detta går till. Införande av PA grekiska nyckelmotiv i membranet sker när heptameren surgörs. På artificiella dubbelskikt inträffar detta när pH sänks från 7,4 till 6,5, vilket tyder på att utlösaren för insättning involverar en titrering av histidiner. Detta passar verkligen sekvensen av PA eftersom domän 2 innehåller ett antal histidiner (visas som asterisker i figur 9a). Tre histidinrester finns i den oordnade slingan, varav en ligger med en grekisk-nyckel histidin i ett kluster av polära aminosyror. Detta kluster (inklusive de två histidinerna, tre argininerna och ett glutamat) är inbäddat i toppen av det grekiska nyckelmotivet, så det är lätt att se att protoneringen av dessa histidiner skulle störa klustret. Vidare finns en annan histidin vid basen av det grekiska nyckelmotivet tillsammans med ett antal hydrofoba rester (på det gröna segmentet i figurerna 7 och 9a). Vid pH 7,4 ordnas detta segment, men när kristallerna odlas vid pH 6,0 blir det oordnat. Denna ordningsföljd till störningsövergång är det första steget av PA-membraninsättning.
PA endocyteras som en löslig heptamer fäst till dess receptorer, med LF eller EF fäst till heptameren som last. Det första steget efter endocytos är försurningen av den endocytotiska vesikeln. Försurningen spelar två roller i giftets livslängd. För det första hjälper det till att slappna av det hårda greppet av CMG2- eller TEM8-receptorn på PA, vilket underlättar porbildningen (de olika receptorerna tillåter insättning vid ett något annat pH). För det andra orsakar fallet i pH att en oordnad slinga och ett grekisk nyckelmotiv i PA-domän 2 viks ut ur heptamerförporen och förs in genom den sura vesikelns vägg, vilket leder till porbildning (figur 7–9) .
Santelli et al. förklarade mer om processen efter att de bestämt kristallstrukturen för PA/CMG2-komplexet. Strukturen av detta komplex visar bindningen av CMG2 av både domän 2 och 4 av PA. Denna interaktion visar mindre frihet att veckla ut den grekiska nyckeln. Ytterligare analys visar att sju av de nio histidinerna i PA finns på domän 2/domän 4-gränssnittet. Protonering av dessa histidiner gör att domänerna separeras tillräckligt för att tillåta den grekiska nyckeln att floppa ut och hjälpa till att bilda β-hårnålen som är involverad i insättningen. Dessutom, när PA binder till CMG2, sker inte längre insättning vid ett pH på 6,5, som det gör när det sätts in i ett konstgjort membran. Istället kräver det ett pH på 5,0 för införande i naturliga celler. Denna skillnad förklarades vara resultatet av fickan bredvid MIDAS-motivet i CMG2. Denna ficka innehåller en histidin begravd i botten där domän 2 fästs. Detta histidin protoneras vid ett lägre pH och tillför större stabilitet till PA. Denna extra stabilitet hindrar den grekiska nyckeln från att kunna röra sig tills mer sura förhållanden uppfylls. Dessa histidiner arbetar alla tillsammans för att förhindra att heptameren sätts in i förtid innan endocytos inträffar.
Santelli och kollegor (Fig. 10) byggde också en hypotetisk struktur av den membraninförda PA/CMG2-strukturen. Denna modell visar att β-pipan är cirka 70 Å (7 nm) lång, varav 30 Å (3 nm) spänner över membranet och gapet på 40 Å (4 nm) faktiskt fylls ut med resten av den extracellulära delen av CMG2-receptorn (~100 rester). CMG2 ger ytterligare stöd till poren.
Proteintranslokation
Flera nya studier visar hur PA63-poren tillåter EF och LF att komma in i cytoplasman när dess lumen är så liten. Lumen på PA63-poren är endast 15 Å (1,5 nm) tvärs över, vilket är mycket mindre än diametern på LF eller EF. Translokation sker genom en serie händelser som börjar i endosomen när den försuras. LF och EF är pH-känsliga, och när pH sjunker förlorar deras strukturer stabilitet. Under ett pH på 6,0 (pH i en endosom) blir både LF och EF oordnade smälta kulor . När en molekyl är i denna konformation frigörs N-terminalen och dras in i poren av protongradienten och positiv transmembranpotential. En ring av sju fenylalaniner vid munnendosomsidan av poren (fenylalaninklämma) hjälper till att veckla ut LF eller EF genom att interagera med de hydrofoba resterna som finns i LF eller EF. Protongradienten börjar sedan spetsa proteinet genom poren. Snörningsmekanismen drivs av gradienten, men kräver fenylalaninklämman för en spärrrörelse. De första 250 resterna av EF och LF har en oregelbunden alternerande sekvens av basiska, sura och hydrofoba rester. Samspelet mellan fenylalaninklämman och protonationstillståndet orsakar en spärreffekt som driver proteinet tills tillräckligt mycket har passerat in i cytoplasman för att dra resten genom poren när N-terminalen återveckas.
externa länkar
- "Månadens molekyl" april 2012
- Översikt över all strukturell information tillgänglig i PDB för UniProt : P15917 (Dödlig faktor) i PDBe-KB .



