Fumonisin B1

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
(2S , 2'S ) -2,2'-[(5S , 6R , 7R , 9R , 11S , 16R , 18S , 19S ) -19-amino-11,16,18 -trihydroxi-5,9-dimetylikosan-6,7-diyl]bis[oxi(2-oxoetan-2,1-diyl)]dibutandisyra |
|
| Andra namn Makrofusin
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ECHA InfoCard | 100.150.289 |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C 34 H 59 N O 15 | |
| Molar massa | 721,838 g-mol -1 |
| Utseende | Vitt till benvitt pulver |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Fumonisin B 1 är den vanligaste medlemmen av en familj av toxiner, kända som fumonisiner , producerade av flera arter av Fusarium- mögel , såsom Fusarium verticillioides , som förekommer huvudsakligen i majs (majs), vete och andra spannmål. Fumonisin B1-kontamination av majs har rapporterats över hela världen i mg/kg-nivåer. Människans exponering sker i nivåer av mikrogram till milligram per dag och är störst i regioner där majsprodukter är en bas i kosten.
Fumonisin B 1 är hepatotoxiskt och nefrotoxiskt i alla testade djurarter. Den tidigaste histologiska förändringen som uppträder i antingen levern eller njuren hos fumonisinbehandlade djur är ökad apoptos följt av regenerativ cellproliferation. Även om den akuta toxiciteten för fumonisin är låg, är det den kända orsaken till två sjukdomar som uppträder hos husdjur med snabbt debut: leukoencefalomalaci hos häst och lungödemsyndrom hos svin. Båda dessa sjukdomar involverar störd sfingolipidmetabolism och kardiovaskulär dysfunktion.
Historia
År 1970 associerades ett utbrott av leukoencefalomalaci hos hästar i Sydafrika med kontamineringen av majs med svampen Fusarium verticillioides . Det är en av de vanligaste utsädesburna svamparna förknippade med majs. En annan studie gjordes på den möjliga rollen av svamptoxiner i etiologin av human matstrupscancer i en region i Sydafrika. Dieten för människorna som bodde i detta område var egenodlad majs och F. verticillioides var den vanligaste svampen i majsen som konsumerades av människor med hög förekomst av matstrupscancer. Ytterligare utbrott av leukoencefalomalaci och personer i vissa regioner med hög incidens av matstrupscancer ledde till mer forskning om F. verticillioides . Snart fann de experimentellt att F. verticillioides orsakade leukoencefalomalaci hos hästar och lungödem hos svin hos grisar. Det visade sig vara mycket hepatotoxiskt och kardiotoxiskt hos råttor. 1984 visades det att svampen var leverkarcinogen hos råttor. Den kemiska naturen hos metaboliterna som orsakade allt detta hade fortfarande inte upptäckts 1984. Efter upptäckten av svampens cancerogenicitet var isolering och kemisk karakterisering av mykotoxiner och cancerframkallande ämnen som produceras av F. verticillioides brådskande. Det var inte förrän 1988 som cancerframkallningens kemiska natur reds ut. Fumonisin B 1 och fumonisin B 2 isolerades från kulturer av F. verticillioides vid programmet för mykotoxiner och experimentell karcinogenes. Strukturerna har belysts i samarbete med Rådet för vetenskaplig och industriell forskning. Flera isomerer av fumonisin B1 har påvisats i fast riskultur. Nu är mer än 100 olika fumonisiner kända, de viktigaste är fumonisin B 1 , B 2 och B 3 .
Toxikokinetik
När det gäller toxikokinetik finns inga mänskliga data tillgängliga, men forskning på djur har gjorts.
Absorption
FB 1 tas oralt via mat. Totalt sett absorberas FB 1 dåligt, mindre än 6%. Absorptionen av oralt administrerat fumonisin B 1 (10 mg/kg kroppsvikt) till råttor är låg (3,5 % av dosen) men snabb (Tmax = 1,02 timmar). FB 1 tränger inte nämnvärt igenom människans hud och har därför ingen signifikant systemisk hälsorisk efter hudexponering.
Distribution
Efter absorption verkar en del vara kvar i lever och njurar. För råttor som fick foder som innehöll fumonisiner under flera veckor var koncentrationerna av fumonisinerna i njurarna ungefär 10 gånger högre än i levern.
Plasmafördelningen av den absorberade dosen överensstämde med en öppen modell med två avdelningar och koncentrationstidsresultaten för vävnad (lever, njure) överensstämde med en öppen modell med en avdelning .
Exkretion
Eliminationshalveringstid hos råttor är 3,15 timmar för plasma, 4,07 timmar för lever och 7,07 timmar för njure. FB 1 utsöndras dock snabbt mestadels i sin ursprungliga form. Små mängder utsöndras i urinen; det mesta utsöndras i avföring.
Toxikodynamik
På grund av deras likhet kan fumonisiner hämma sfingosin -sfinganin-transferaser och ceramidsyntaser och är därför kompetitiva hämmare av sfingolipidbiosyntes och metabolism.
Figur 2 visar sfingolipidmetabolismen (schematisk) och hämningen orsakad av fumonisiner. Fumonisin B 1 hämmar enzymet ceramidsyntas (sfingosin N -acyltransferas), som acylerar sfingoida baser. Detta blockerar bildningen av ceramid via två vägar. Det hämmar bildningen via de novo sfinganin och fettacyl -CoA och via sfingosin som produceras genom nedbrytning av ceramid av ceramidas. Hämningen resulterar i ökade koncentrationer av sfinganin, sfingosin och deras 1-fosfatmetaboliter och i minskade koncentrationer av komplexa sfingolipider. Ackumuleringen av sfinganin och sfingosin är en primär orsak till toxiciteten av fumonisin B 1 Sfinganin och sfingosin är cytotoxiska och har tillväxthämmande effekter. Dessa sfingoida baser inducerar också apoptos. Ökad apoptos verkar spela en viktig roll i de toxiska effekterna inklusive tumörinduktion. Det bör dock nämnas att den minskade koncentrationen av ceramid och den ökade koncentrationen av sfingosin-1-fosfat (som ett resultat av FB 1- intag ) orsakar en hämning av apoptos och främjar mitos och regenerering. Balansen mellan den intracellulära koncentrationen av föreningar som hämmar apoptos och de som inducerar apoptos kommer att bestämma det cellulära svaret. De minskade koncentrationerna av komplexa sfingolipider verkar också spela en roll i det onormala beteendet och förändrade morfologin hos de påverkade cellerna.
Handlingsmekanism
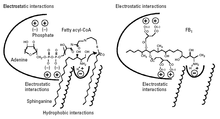
Den föreslagna verkningsmekanismen visas i figur 3. Fumonisin B 1 upptar utrymmet och elektrostatiska interaktioner mellan både sfinganin (eller sfingosin) och fettacyl-CoA i ceramidsyntas. Den del av FB 1 som har strukturell likhet med sfingoida baser (aminopentoldelen) kan interagera med sfinganinbindningsstället, medan de negativt laddade trikarbyllsyragrupperna kan interagera med fettacyl-CoA-bindningsstället.
Eftersom FB 1 också upptar fettacyl-CoA-utrymmet, acyleras det inte, eftersom acyl-CoA är nödvändigt för acyleringen; FB 1 hämmar bara ceramidsyntas. Men när trikarbillinsyragrupperna avlägsnas från FB 1 genom hydrolys, fungerar den resulterande produkten (aminopentol, AP1) inte bara som en inhibitor, utan också som ett substrat för ceramidsyntas; aminopentol acyleras av ceramidsyntas för att bilda N-palmitoyl-AP1. Detta stöder förslaget att aminopentoldelen av FB 1 upptar utrymmet för sfinganin i enzymet. N-palmitoyl-AP1 är en ännu mer potent hämmare av ceramidsyntas och kan därför spela en roll i toxiciteten av nixtamaliserade fumonisiner.
Toxiska effekter
Riskerna med fumonisin B1 har utvärderats av Världshälsoorganisationens internationella program för kemikaliesäkerhet och Europeiska kommissionens vetenskapliga kommitté för livsmedel. De bestämde ett tolererbart dagligt intag för FB 1 , FB 2 , FB 3 , enbart eller i kombination av 2 µg/kg kroppsvikt. Hittills har ingenting om kinetiken och metabolismen av fumonisin B 1 hos människor rapporterats. På andra djur har mycket forskning gjorts, men det kanske inte är jämförbart med människor. Hos möss är elimineringen av FB 1 mycket snabb, men hos människor kan det vara mycket långsammare med tanke på deras kroppsvikt. Det finns flera möjliga vägar som orsakar toxiska effekter av Fumonisin B 1 . De flesta toxiska effekterna beror på förändrad sfingolipidmetabolism genom hämning av ceramidsyntas. Produktion av reaktiva syrearter kan förekomma. Detta ökar oxidativ stress och inducerar lipidperoxidation och kan skada celler. I överensstämmelse med detta visade vissa studier minskade nivåer av glutation i levern, men andra studier visade till och med förhöjda nivåer av glutation. Cytotoxiska effekter har också rapporterats. En annan effekt av exponering för FB 1 är apoptos. Detta har observerats i ett antal olika celler och vävnader. Hämning av ceramidsyntas är inte ansvarig för denna effekt. Huvudfaktorerna kan vara DNA-fragmentering och kaspas-3-aktivering. FB 1 har också immuntoxiska effekter, men mycket mer forskning krävs för att få en tydlig överblick över effekterna på immunförsvaret.
Toxiska effekter på människor
Neuralrörsdefekter
Neuralrörsdefekt är abnormiteter i hjärnan och ryggmärgen i embryot som beror på att neuralröret inte stängs. Epidemiologiska studier och kliniska prövningar har pekat ut folatbrist som en viktig riskfaktor för neuralrörsdefekter. FB 1 stör sfingolipidmetabolismen och därför kan detta påverka folatupptaget och orsaka neuralrörsdefekter. 1990 och 1991 inträffade ett plötsligt utbrott av neuralrörsdefekter längs gränsen mellan Texas och Mexiko. Man tror att detta utbrott kan ha berott på höga nivåer av FB 1 som observerats i majs under tidigare år. Regioner i Kina och Sydafrika med hög majskonsumtion har också en hög förekomst av neuralrörsdefekter.
Cancer i matstrupen
Man tror att det finns ett samband mellan förekomsten av F. verticillioides och mänsklig matstrupscancer. En låg socioekonomisk status och en mindre varierad kost, som huvudsakligen består av majs och vete, är förknippad med uppkomsten av matstrupscancer. Detta härrör från epidemiologiska studier i olika länder. Andra studier visar att högre koncentrationer av FB 1 , FB 2 och F. verticillioides finns i majs som växer i regioner med en hög andel matstrupscancer. Detta till skillnad från regioner med låga nivåer av F. verticillioides , FB 1 och FB 2 i majs. Ovanpå detta verkar det som att personer med högt intag av majs löper högre risk att utveckla matstrupscancer än personer med lågt intag av majs. Detta observeras av människor i regioner i Italien, Iran, Kenia, Zimbabwe, USA och Brasilien med hög förekomst av matstrupscancer. En annan studie om sambandet mellan sfingolipidnivåer och cancerincidens visade inte något signifikant samband mellan serumsfingolipider och risken för matstrupscancer. Detta är ganska anmärkningsvärt, eftersom förhöjda nivåer av sfingolipider sfinganin och sfingosin tros vara biomarkörer för exponering av FB 1 .
Akut mykotoxikos
Akut mykotoxikos är matförgiftning av livsmedel som är förorenade av svampar. 1995 inträffade ett sjukdomsutbrott som kännetecknas av diarré och buksmärtor i 27 byar i Indien. Detta var resultatet av konsumtion av möglig sorghum och majs på grund av regnskador. Detta utbrott studerades och mykotoxikosen var kopplad till konsumtion av osyrat bröd. Majs- och sorghumprover samlades in från hushållen och undersöktes. Majsen och sorghumen var kontaminerade av Fusarium och Aspergillus och innehöll höga halter av FB 1 jämfört med prover från opåverkade hushåll.
Toxiska effekter på djur
Mycket forskning har gjorts på toxiska effekter av FB 1 hos djur. In vivo-studier indikerar att lever och njurar är de huvudsakliga målorganen. Fumonisiner absorberas dåligt, elimineras snabbt och metaboliseras inte hos djur. Hos grisar och råttor finns en bred spridning av FB 1 och små mängder har visat sig ackumuleras endast i lever och njurar. Hos vervetapor hydrolyseras en del FB 1 delvis i tarmen.
Cancerframkallande effekter
Hos råttor och möss som exponerades för FB 1 inträffade tumörbildning. Flera studier i detta ämne har gjorts. Beroende på vilken stam av möss som användes visades olika karcinom. FB 1 har visat sig vara icke-genotoxiskt. Därför bör de mekanismer som är ansvariga för cancerutveckling ligga någon annanstans. Viktiga mekanismer för cancerutveckling på grund av fumonisin B 1 kan vara oxidativ skada (produktion av reaktiva syrearter) och lipidperoxidation. Lever- och njurtumörer kan också bero på apoptos av FB 1 . Som ett svar på detta kan det ske en kontinuerlig regenerering av celler, vilket kan orsaka cancer. Det verkar vara så att störd sfingolipidmetabolism är den orsakande faktorn för FB 1 -inducerad carcinogenicitet, vilket är fallet med de toxiska effekterna. Baserat på alla dessa djurstudier klassificeras FB 1 av International Agency for Research on Cancer (IARC) som möjligen cancerframkallande för människor (Grupp 2B).
Svins lungödem
Lungödem från svin på grund av FB 1 studeras intensivt efter den första rapporten 1981 om svin med lungödem efter exponering för majs kontaminerad med F. verticillioides . Förändringar i sfingolipidbiosyntes har rapporterats, särskilt i lung-, hjärta-, njur- och levervävnad. Dödligt lungödem utvecklades inom 4–7 dagar efter exponering för foder med koncentrationer av FB 1 >16 mg/kg kroppsvikt (>92 delar per miljon). Doser på 10 delar per miljon orsakade en mildare form av lungödem.
Leukoencefalomalaci från häst
Leukoencefalomalaci är en neurotoxisk sjukdom hos hästar. Utbrott av denna sjukdom på 1900-talet resulterade i ett antal studier. Tydligen var FB 1 orsaken till denna sjukdom. Det visades förhöjda nivåer av serumenzymnivåer som indikerar leverskada. De observerades normalt genom en höjning av förhållandet sfinganin/sfingosin. FB 1 inducerar möjligen kardiovaskulär funktion på grund av det förhöjda förhållandet sfinganin/sfingosin. Detta kan vara en av huvudfaktorerna som orsakar leukoencefalomalaci.
Toxicitet hos försöksdjur
Effekter av att mata råttor med FB 1 i upp till 90 dagar var vanligtvis nefrotoxicitet. Mellan olika råttstammar varierade känsligheten för FB 1 . I njurarna var huvudeffekten apoptos. Även tubulär atrofi och regenerering samt minskad njurvikt rapporterades. Histopatologiska effekter på råttlever rapporterades efter både kort- och långtidsexponering. Den främsta orsaken var apoptos. Möss verkar inte vara särskilt känsliga för nefrotoxiska effekter i jämförelse med råttor. Hos musnjurar sågs små histologiska förändringar vid exponering för hög dos. Levern var också det huvudsakliga målorganet hos möss. Patologi är liknande som hos råttor, med apoptos och hepatocellulär hyperplasi. Fumonisin B 1 är möjligen embryotoxisk om dosen är giftig för modern. Ett antal studier på genotoxicitet indikerade inga mutagenetiska effekter. Även om fumonisin kan skada DNA direkt genom produktion av reaktiva syrearter. Musembryon exponerades för FB 1 och de visade hämmad sfingolipidsyntes och tillväxt. Det orsakade neuralrörsdefekter. Folsyraupptaget hämmades dramatiskt. Behandling efter exponering med folsyra minskade neuralrörsdefekter med 50–65 %.
Acceptabelt dagligt intag
Riskerna med fumonisin B1 har utvärderats av Världshälsoorganisationens internationella program för kemikaliesäkerhet och Europeiska kommissionens vetenskapliga kommitté för livsmedel. De bestämde ett tolerabelt dagligt intag för FB1, FB2, FB3, enbart eller i kombination med 2 µg/kg kroppsvikt.
Avgiftning
Hämningen av ceramidsyntas av FB 1 tros vara reversibel, eftersom bindningen bildas av icke-kovalenta interaktioner. Faktorer som troligen kommer att inducera denna reversibilitet är minskning av cellulär FBi - koncentration och ökning av cellulära koncentrationer av substraten för ceramidsyntas. Dessutom kommer hastigheten för avlägsnande av det ackumulerade sfinganinet och sfingosinet att påverka avgiftningen. Informationen om metabolism och biotransformation av FB 1 är mycket sparsam. Emellertid sker metabolism mest sannolikt i tarmen eftersom partiellt hydrolyserat och helt hydrolyserat FB 1 återfanns i avföring men inte i galla från vervetapor. Biotillgängligheten av FB 1 kan minskas genom att behandla fumonisin-kontaminerad majs med glukomannaner extraherade från cellväggen i jästen Saccharomyces cerevisiae. Dessa polysackarider kan binda vissa mykotoxiner och har en bindningskapacitet på 67 % för fumonisiner.