CDC42
| CDC42 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , CDC42Hs, G25K, TKS, celldelningscykel 42 | |||||||||||||||||||||||||||||||||||||||||||||||
| externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Celldelningskontrollprotein 42 homolog är ett protein som hos människor kodas av Cdc42 -genen. Cdc42 är involverad i regleringen av cellcykeln . Den identifierades ursprungligen i S. cerevisiae (jäst) som en förmedlare av celldelning , och är nu känd för att påverka en mängd olika signalhändelser och cellulära processer i en mängd olika organismer från jäst till däggdjur.
Fungera
Human Cdc42 är ett litet GTPas från Rho-familjen , som reglerar signalvägar som kontrollerar olika cellulära funktioner inklusive cellmorfologi, cellmigrering , endocytos och cellcykelprogression . Rho GTPaser är centrala för dynamisk aktincytoskelettsammansättning och omarrangemang som är grunden för cell-celladhesion och migration. Aktiverat Cdc42 aktiveras genom att orsaka konformationsförändringar i p21-aktiverade kinaser PAK1 och PAK2 , som i sin tur initierar aktinomorganisation och reglerar cellvidhäftning, migration och invasion.
Strukturera
Cdc42 är en homodimer med A- och B-kedjor. Dess totala längd är 191 aminosyror och dess teoretiska vikt är 21,33 kDa. Dess sekvensdomäner inkluderar en P-loop innehållande nukleosidtrifosfathydrolas och en liten GTP-bindande proteindomän.
Cdc42 cyklar mellan ett aktivt GTP-bundet tillstånd och ett inaktivt GDP-bundet tillstånd. Denna process regleras av guanin-nukleotidutbytesfaktorer (GEF) som främjar utbytet av bundet GDP mot fritt GTP, GTPas-aktiverande proteiner (GAPs) som ökar GTP-hydrolysaktiviteten och GDP-dissociationsinhibitorer som hämmar dissociationen av nukleotiden från GTPaset.
Roll i cancer
Nyligen har Cdc42 visat sig aktivt hjälpa till med cancerprogression. Flera studier har etablerat grunden för detta och hypoteser kring de bakomliggande mekanismerna.
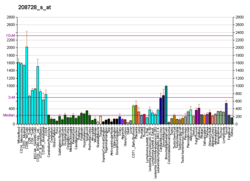
Cdc42 är överuttryckt i icke-småcellig lungcancer, kolorektalt adenokarcinom, melanom, bröstcancer och testikelcancer. Förhöjda nivåer av proteinet har korrelerats med negativ patientöverlevnad. Cdc42 har också visat sig krävas för både G1-S fasprogression och mitos, och det modulerar också transkriptionsfaktorerna SRF, STAT3 och NFkB. Det har antagits att inriktning på Cdc42 i samband med kemoterapi kan vara en effektiv cancerbehandlingsstrategi.
I en studie som studerade rollen av Cdc42 i livmoderhalscancer, användes immunhistokemi för att detektera Cdc42-uttryck i tre typer av vävnader: normal livmoderhalsvävnad, cervikal intraepitelial neoplasi (CIN) I eller lägre, CIN II eller högre och livmoderhalscancervävnader. Cdc42-uttryck ökade gradvis och visade signifikant skillnad och var signifikant högre i HeLa- celler än i vanliga celler. Migreringsförmågan för HeLa-celler transfekterade med Cdc42 var högre än för icke-transfekterade celler. Det föreslogs att överuttrycket av Cdc42 kan främja filopodiabildning i HeLa-celler. Cdc42-överuttryck förbättrade signifikant förmågan hos livmoderhalscancerceller att migrera, möjligen på grund av förbättrad pseudopodibildning .
En annan studie fann att Cdc42 driver processen att initiera en metastaserande tumör i en ny vävnad genom att främja uttrycket av β1- integrin , en adhesionsreceptor som är känd för att vara involverad i metastaser. Nivåer av β1-integrin reducerades i Cdc42-bristceller. β1-integrin är viktigt för vidhäftning till den extracellulära matrisen och kan också vara viktigt för den initiala bindningen till endotelceller. Att slå ner β1-integrin hämmade migration av cancerceller, medan överuttryck av integrinet i Cdc42-bristceller återställde endotelinvasion . Cdc42 främjade β1-integrinuttryck genom att aktivera en transkriptionsfaktor som kallas SRF. En kontinuerligt aktiv form av transkriptionsfaktorn kunde också återställa endotelinsättning till cancerceller som saknade Cdc42.
Normala cancerceller och cancerceller med brist på Cdc42 har också jämförts in vivo. När båda typerna av celler injicerades i musens svansvener spred sig kontrollcellerna mer på kärlets endotel inom några minuter, vilket tyder på att Cdc42 hjälper till med cellmigration. Efter sex veckor hade kontrollcellerna genererat fler metastaser än de Cdc42-bristceller. Invaderande cancerceller skickar ut utsprång som når ner mellan närliggande endotelceller för att komma i kontakt med det underliggande basalmembranet. Cancercellerna sprider sig sedan ut på denna extracellulära matris så att endotelcellerna drar sig tillbaka och låter inkräktarna föra in sig själva mellan dem. I frånvaro av Cdc42 misslyckades cancerceller med att spridas ut på basalmembranet, och Cdc42-bristceller visade minskad vidhäftning till extracellulära matrisbelagda täckglas. Cdc42 främjar därför fästet av cancerceller till både endotelceller och det underliggande basalmembranet under transendotelmigrering.
Den småmolekylära hämmaren AZA197 har använts för att hämma Cdc42 vid behandling av KRAS-mutanta kolorektala cancerformer. Det fanns bevis för att Cdc42-hämning av AZA197-behandling undertrycker proliferativa och pro-överlevnadssignalvägar via PAK1-ERK-signalering och minskar migration och invasion av tjocktarmscancerceller. Hos möss reducerade systemisk AZA197-behandling in vivo primär tumörtillväxt och förlängde överlevnaden. Terapi inriktad på Rho GTPase Cdc42-signalvägar kan vara effektiva för behandling av patienter med avancerad tjocktarmscancer som överuttrycker Cdc42, och särskilt de med KRAS-mutant sjukdom.
Takenouchi-Kosaki syndrom
Mutationer i CDC42-genen är ansvarig för Takenouchi-Kosaki-syndromet, en autosomalt dominant komplex medfödd utvecklingsstörning, vars symtom inkluderar trombocytopeni . Alleisk variant som är associerad med syndromet inkluderar mutationer i CDC42-genen som uttrycks på proteinnivå som Ile21Thr, Tyr64Cys, Arg66Gly, Cys81Phe, Ser83Pro eller Glu171Lys.
Interaktioner
CDC42 har visat sig interagera med:
externa länkar
- cdc42+GTP-Binding+Protein vid US National Library of Medicine Medical Subject Headings (MeSH)
- CDC42 Info med länkar i Cell Migration Gateway
- Human CDC42- genomplacering och CDC42- geninformationssida i UCSC Genome Browser .