Storleksuteslutningskromatografi
 Utrustning för att köra storleksuteslutningskromatografi. Bufferten pumpas genom kolonnen (höger) av en datorstyrd anordning.
| |
| Akronym | SEC |
|---|---|
| Klassificering | Kromatografi |
| Analyter |
makromolekyler syntetiska polymerer biomolekyler |
| Tillverkare | Cytiva, Bio-Rad, Bio-Works, emp Biotech, Knauer. |
| Andra tekniker | |
| Relaterad |
Högpresterande vätskekromatografi Vattenhaltig normalfaskromatografi Jonbyteskromatografi Micellär vätskekromatografi |
Size-exclusion chromatography ( SEC ), även känd som molecular sieve chromatography , är en kromatografisk metod där molekyler i lösning separeras av sin storlek och i vissa fall molekylvikt . Det appliceras vanligtvis på stora molekyler eller makromolekylära komplex som proteiner och industriella polymerer . Vanligtvis, när en vattenlösning används för att transportera provet genom kolonnen, är tekniken känd som gelfiltreringskromatografi, jämfört med namnet gelpermeationskromatografi , som används när ett organiskt lösningsmedel används som en mobil fas. Kromatografikolonnen är packad med fina, porösa pärlor som vanligtvis är sammansatta av dextran- , agaros- eller polyakrylamidpolymerer . Porstorlekarna på dessa pärlor används för att uppskatta dimensionerna av makromolekyler . SEC är en allmänt använd polymerkarakteriseringsmetod på grund av dess förmåga att ge goda resultat för molär massfördelning ( Mw) för polymerer.
Ansökningar
Den huvudsakliga tillämpningen av storleksuteslutningskromatografi är fraktionering av proteiner och andra vattenlösliga polymerer, medan gelpermeationskromatografi används för att analysera molekylviktsfördelningen av organiskt lösliga polymerer. Båda teknikerna bör inte förväxlas med gelelektrofores , där ett elektriskt fält används för att "dra" molekyler genom gelén beroende på deras elektriska laddningar. Mängden tid ett löst ämne förblir i en por beror på porstorleken. Större lösta ämnen kommer att ha tillgång till en mindre volym och vice versa. Därför kommer ett mindre löst ämne att stanna kvar i poren under en längre tid jämfört med ett större löst ämne.
En annan användning av storleksexklusionskromatografi är att undersöka stabiliteten och egenskaperna hos naturligt organiskt material i vatten. I denna metod testade Margit B. Muller, Daniel Schmitt och Fritz H. Frimmel vattenkällor från olika platser i världen för att avgöra hur stabilt det naturliga organiska materialet är över en tidsperiod. Även om storleksuteslutningskromatografi används allmänt för att studera naturligt organiskt material, finns det begränsningar. En av dessa begränsningar inkluderar att det inte finns någon standard molekylviktsmarkör; det finns alltså inget att jämföra resultaten med. Om exakt molekylvikt krävs bör andra metoder användas.
Fördelar
Fördelarna med denna metod inkluderar god separation av stora molekyler från de små molekylerna med en minimal volym av eluat, och att olika lösningar kan appliceras utan att störa filtreringsprocessen, allt samtidigt som den biologiska aktiviteten av partiklarna att separera bevaras. Tekniken kombineras i allmänhet med andra som ytterligare separerar molekyler genom andra egenskaper, såsom surhet, basicitet, laddning och affinitet för vissa föreningar. Med storleksexklusionskromatografi är det korta och väldefinierade separationstider och smala band, vilket leder till god känslighet. Det finns heller ingen provförlust eftersom lösta ämnen inte interagerar med den stationära fasen.
Den andra fördelen med denna experimentella metod är att det i vissa fall är möjligt att bestämma den ungefärliga molekylvikten för en förening. Formen och storleken på föreningen (eluenten) bestämmer hur föreningen interagerar med gelén (stationär fas). För att bestämma ungefärlig molekylvikt erhålls elueringsvolymerna för föreningar med deras motsvarande molekylvikter och sedan görs ett diagram av "K av " vs "log(Mw)", där och Mw är molekylmassan. Detta diagram fungerar som en kalibreringskurva, som används för att approximera den önskade föreningens molekylvikt. Ve - komponenten representerar volymen vid vilken de mellanliggande molekylerna eluerar, såsom molekyler som har partiell tillgång till pärlorna i kolonnen. Dessutom är Vt summan av den totala volymen mellan pärlorna och volymen inom pärlorna. V o -komponenten representerar volymen vid vilken de större molekylerna eluerar, som eluerar i början. Nackdelar är till exempel att endast ett begränsat antal band kan rymmas eftersom tidsskalan för kromatogrammet är kort, och generellt sett måste det vara 10 % skillnad i molekylmassa för att ha en bra upplösning.
Upptäckt
Tekniken uppfanns 1955 av Grant Henry Lathe och Colin R Ruthven, som arbetade på Queen Charlotte's Hospital, London. De fick senare John Scott Award för denna uppfinning. Medan Lathe och Ruthven använde stärkelsegeler som matris, Jerker Porath och Per Flodin senare dextrangeler; andra geler med storleksfraktioneringsegenskaper inkluderar agaros och polyakrylamid. En kort genomgång av denna utveckling har dykt upp.
Det gjordes också försök att fraktionera syntetiska högpolymerer; det var dock inte förrän 1964, när JC Moore från Dow Chemical Company publicerade sitt arbete om framställning av gelpermeationskromatografi (GPC)-kolonner baserade på tvärbunden polystyren med kontrollerad porstorlek, som en snabb ökning av forskningsaktiviteten i denna fältet började. Det insågs nästan omedelbart att med korrekt kalibrering kunde GPC tillhandahålla information om molmassa och molmassafördelning för syntetiska polymerer. Eftersom den sistnämnda informationen var svår att få fram med andra metoder, kom GPC snabbt till omfattande användning.
Teori och metod
SEC används främst för analys av stora molekyler som proteiner eller polymerer. SEC fungerar genom att fånga mindre molekyler i adsorbentens porer ( "stationär fas"). Denna process utförs vanligtvis i en kolonn, som vanligtvis består av ett ihåligt rör tätt packat med mikronskala polymerpärlor som innehåller porer av olika storlekar. Dessa porer kan vara fördjupningar på ytan eller kanaler genom pärlan. När lösningen färdas ner i kolonnen kommer vissa partiklar in i porerna. Större partiklar kan inte komma in i så många porer. Ju större partiklar, desto snabbare eluering. De större molekylerna passerar helt enkelt förbi porerna eftersom dessa molekyler är för stora för att komma in i porerna. Större molekyler strömmar därför snabbare genom kolonnen än mindre molekyler, det vill säga ju mindre molekylen är, desto längre retentionstid.
Ett krav för SEC är att analyten inte interagerar med ytan av de stationära faserna, med skillnader i elueringstid mellan analyter som helst baseras enbart på den lösta volymen som analyterna kan komma in i, snarare än kemiska eller elektrostatiska interaktioner med de stationära faserna. Således kan en liten molekyl som kan penetrera varje region av det stationära fasens porsystem komma in i en total volym som är lika med summan av hela porvolymen och interpartikelvolymen. Denna lilla molekyl eluerar sent (efter att molekylen har penetrerat hela por- och interpartikelvolymen - ungefär 80 % av kolonnvolymen). I den andra ytterligheten kan en mycket stor molekyl som inte kan penetrera några av de mindre porerna endast komma in i interpartikelvolymen (~35% av kolonnvolymen) och elueras tidigare när denna volym av mobil fas har passerat genom kolonnen. Den underliggande principen för SEC är att partiklar av olika storlekar eluerar (filtrerar) genom en stationär fas med olika hastigheter. Detta resulterar i separering av en lösning av partiklar baserat på storlek. Förutsatt att alla partiklar laddas samtidigt eller nästan samtidigt, bör partiklar av samma storlek eluera tillsammans.
Men eftersom det finns olika mått på storleken på en makromolekyl (till exempel gyrationsradien och den hydrodynamiska radien), har ett grundläggande problem i teorin för SEC varit valet av en lämplig molekylstorleksparameter genom vilken molekyler av olika slag är åtskilda. Experimentellt fann Benoit och medarbetare en utmärkt korrelation mellan elueringsvolym och en dynamiskt baserad molekylstorlek, den hydrodynamiska volymen , för flera olika kedjearkitektur och kemiska sammansättningar. Den observerade korrelationen baserad på den hydrodynamiska volymen blev accepterad som grunden för universell SEC-kalibrering.
Ändå är användningen av den hydrodynamiska volymen, en storlek baserad på dynamiska egenskaper, vid tolkningen av SEC-data inte helt klarlagd. Detta beror på att SEC vanligtvis körs under låga flödeshastighetsförhållanden där hydrodynamisk faktor bör ha liten effekt på separationen. Faktum är att både teori och datorsimuleringar antar en termodynamisk separationsprincip: separationsprocessen bestäms av jämviktsfördelningen (fördelningen) av lösta makromolekyler mellan två faser: en utspädd bulklösningsfas belägen i det interstitiella utrymmet och slutna lösningsfaser i porerna av kolonnpackningsmaterial. Baserat på denna teori har det visats att den relevanta storleksparametern för uppdelningen av polymerer i porer är medelspänndimensionen (medelvärde för maximal projektion på en linje). Även om detta problem inte har lösts helt, är det troligt att medelspännvidden och den hydrodynamiska volymen är starkt korrelerade.
Varje storleksexklusionskolonn har ett intervall av molekylvikter som kan separeras. Uteslutningsgränsen definierar molekylvikten i den övre änden av kolumnen "arbetande" intervall och är där molekyler är för stora för att fångas i den stationära fasen. Den nedre delen av intervallet definieras av permeationsgränsen, som definierar molekylvikten för en molekyl som är tillräckligt liten för att penetrera alla porer i den stationära fasen. Alla molekyler under denna molekylmassa är så små att de eluerar som ett enda band.
Den filtrerade lösningen som samlas upp i slutet kallas eluatet . Tomrumsvolymen , och lösningsmedelsvolymen är känd som kolonnvolymen .
Följande är de material som vanligtvis används för porösa gelpärlor vid storleksexklusionskromatografi
| Sr. Nej | Material Och handelsnamn |
Fraktioneringsintervall (Molekylmassa i Da) |
|---|---|---|
| 1 | Sephadex G-10 | 0 till 700 |
| 2 | Sephadex G-25 | 1000 till 5000 |
| 3 | Sephadex G-50 | 1500 till 30000 |
| 4 | Sephadex G-75 | 3000 till 70000 |
| 5 | Sephadex G-100 | 4000 till 150000 |
| 6 | Sephadex G-150 | 5000 till 300000 |
| 7 | Sephadex G-200 | 5000 till 800000 |
| 8 | Bio-gel P-2 | 100 till 1800 |
| 9 | Bio-gel P-6 | 1000 till 6000 |
| 10 | Bio-gel P-60 | 3000 till 60000 |
| 11 | Bio-gel P-150 | 15000 till 150000 |
| 12 | Bio-gel P-300 | 16000 till 400000 |
| 13 | Sepharose 2B | 2 x 10 6 till 25 x 10 6 |
| 14 | Sepharose 4B | 3 x 10 5 till 3 x 10 6 |
| 15 | Sepharose 6B | 10 4 till 20 x 10 6 |
Faktorer som påverkar filtrering
I verkliga situationer har partiklar i lösning inte en fast storlek, vilket resulterar i sannolikheten att en partikel som annars skulle hämmas av en por som passerar precis förbi den. Dessutom är de stationära faspartiklarna inte idealiskt definierade; både partiklar och porer kan variera i storlek. Elueringskurvor liknar därför Gaussfördelningar . Den stationära fasen kan också interagera på oönskade sätt med en partikel och påverka retentionstider, även om stor noggrannhet tas av kolonntillverkare för att använda stationära faser som är inerta och minimerar detta problem.
Liksom andra former av kromatografi, ökar kolonnlängden upplösningen, och ökning av kolonndiametern ökar kolonnkapaciteten. Korrekt kolonnpackning är viktigt för maximal upplösning: En överpackad kolonn kan kollapsa porerna i pärlorna, vilket resulterar i en förlust av upplösning. En underpackad kolonn kan minska den relativa ytan av den stationära fasen som är tillgänglig för mindre arter, vilket resulterar i att dessa arter spenderar mindre tid instängda i porer. Till skillnad från affinitetskromatografitekniker kan ett lösningsmedelshuvud i toppen av kolonnen drastiskt minska upplösningen när provet diffunderar före laddning, vilket breddar nedströmselueringen.
Analys
I enkla manuella kolonner samlas eluenten upp i konstanta volymer, så kallade fraktioner. Ju mer lika partiklarna är i storlek, desto mer sannolikt är de i samma fraktion och inte detekteras separat. Mer avancerade kolumner övervinner detta problem genom att ständigt övervaka elueringsmedlet.

De uppsamlade fraktionerna undersöks ofta med spektroskopiska tekniker för att bestämma koncentrationen av de eluerade partiklarna. Vanliga spektroskopi-detektionstekniker är brytningsindex (RI) och ultraviolett (UV). Vid eluering av spektroskopiskt liknande arter (såsom under biologisk rening) kan andra tekniker vara nödvändiga för att identifiera innehållet i varje fraktion. Det är också möjligt att analysera eluentflödet kontinuerligt med RI, LALLS , Multi-Angle Laser Light Scattering MALS, UV och/eller viskositetsmätningar.
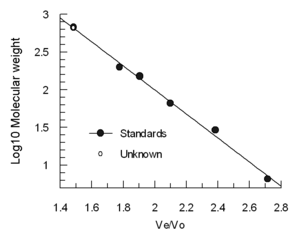
Elueringsvolymen (Ve) minskar ungefär linjärt med logaritmen för den molekylära hydrodynamiska volymen . Kolumner kalibreras ofta med 4-5 standardprover (t.ex. vikta proteiner med känd molekylvikt) och ett prov som innehåller en mycket stor molekyl såsom tyroglobulin för att bestämma tomrumsvolymen. (Blå dextran rekommenderas inte för Vo-bestämning eftersom det är heterogent och kan ge varierande resultat) Elueringsvolymerna för standarderna divideras med elueringsvolymen för tyroglobulinet (Ve/Vo) och plottas mot loggen för standardernas molekylvikter .
Ansökningar
Biokemiska tillämpningar
I allmänhet anses SEC vara en lågupplöst kromatografi eftersom den inte urskiljer liknande arter särskilt bra, och är därför ofta reserverad för det sista steget av en rening. Tekniken kan bestämma den kvartära strukturen hos renade proteiner som har långsamma utbytestider, eftersom den kan utföras under naturliga lösningsförhållanden, vilket bevarar makromolekylära interaktioner. SEC kan också analysera protein tertiär struktur , eftersom det mäter den hydrodynamiska volymen (inte molekylvikten), vilket gör att vikta och ovikta versioner av samma protein kan särskiljas. Till exempel kan den skenbara hydrodynamiska radien för en typisk proteindomän vara 14 Å och 36 Å för de vikta respektive ovikta formerna. SEC tillåter separation av dessa två former, eftersom den vikta formen elueras mycket senare på grund av dess mindre storlek.
Polymersyntes
SEC kan användas som ett mått på både storleken och polydispersiteten hos en syntetiserad polymer , det vill säga förmågan att hitta fördelningen av storleken på polymermolekyler. Om standarder av känd storlek körs tidigare, kan en kalibreringskurva skapas för att bestämma storleken på polymermolekyler av intresse i lösningsmedlet som valts för analys (ofta THF ). På ett alternativt sätt kan tekniker som ljusspridning och/eller viskometri användas online med SEC för att ge absoluta molekylvikter som inte är beroende av kalibrering med standarder med känd molekylvikt. På grund av skillnaden i storlek hos två polymerer med identiska molekylvikter är de absoluta bestämningsmetoderna i allmänhet mer önskvärda. Ett typiskt SEC-system kan snabbt (på ungefär en halvtimme) ge polymerkemister information om provets storlek och polydispersitet. Den preparativa SEC kan användas för polymerfraktionering i analytisk skala.
Nackdelar
I SEC mäts massan inte så mycket som polymermolekylernas hydrodynamiska volym, det vill säga hur mycket utrymme en viss polymermolekyl tar upp när den är i lösning. Den ungefärliga molekylvikten kan dock beräknas från SEC-data eftersom det exakta förhållandet mellan molekylvikt och hydrodynamisk volym för polystyren kan hittas. För detta används polystyren som standard. Men förhållandet mellan hydrodynamisk volym och molekylvikt är inte detsamma för alla polymerer, så endast en ungefärlig mätning kan erhållas. En annan nackdel är möjligheten till interaktion mellan den stationära fasen och analyten. Varje interaktion leder till en senare elueringstid och efterliknar således en mindre analytstorlek.
När man utför denna metod kan banden hos de eluerande molekylerna breddas. Detta kan inträffa genom turbulens orsakad av flödet av mobilfasmolekylerna som passerar genom molekylerna i den stationära fasen. Dessutom bidrar molekylär termisk diffusion och friktion mellan molekylerna i glasväggarna och eluentens molekyler till breddningen av banden. Förutom att breddas överlappar banden också varandra. Som ett resultat blir eluenten vanligtvis avsevärt utspädd. Några försiktighetsåtgärder kan vidtas för att förhindra sannolikheten för att banden breddas. Till exempel kan man applicera provet i ett smalt, högkoncentrerat band på toppen av kolonnen. Ju mer koncentrerad elueringsmedlet är, desto effektivare skulle förfarandet vara. Det är dock inte alltid möjligt att koncentrera eluenten, vilket kan betraktas som ytterligare en nackdel.
Absolut storleksuteslutningskromatografi
Absolute size-exclusion chromatography (ASEC) är en teknik som kopplar ett ljusspridningsinstrument, oftast multi-angle light scattering (MALS) eller annan form av statisk ljusspridning (SLS), men möjligen ett instrument för dynamisk ljusspridning (DLS), till ett storleksuteslutningskromatografisystem för absolut molmassa och/eller storleksmätningar av proteiner och makromolekyler när de eluerar från kromatografisystemet.
Definitionen av "absolut" i det här fallet är att kalibrering av retentionstid på kolonnen med en uppsättning referensstandarder inte krävs för att erhålla molär massa eller den hydrodynamiska storleken, ofta kallad hydrodynamisk diameter (DH i enheter av nm ) . Icke-ideala kolumninteraktioner, såsom elektrostatiska eller hydrofoba ytinteraktioner som modulerar retentionstiden i förhållande till standarder, påverkar inte det slutliga resultatet. Likaledes har skillnader mellan konformationen av analyten och standarden ingen effekt på en absolut mätning; till exempel, med MALS-analys, karakteriseras molmassan av naturligt störda proteiner exakt även om de eluerar vid mycket tidigare tidpunkter än globulära proteiner med samma molära massa, och detsamma gäller för grenade polymerer som eluerar sent jämfört med linjära referensstandarder med samma molmassa. En annan fördel med ASEC är att molmassan och/eller storleken bestäms vid varje punkt i en eluerande topp, och indikerar därför homogenitet eller polydispersitet inom toppen. Till exempel kommer SEC-MALS-analys av ett monodisperst protein att visa att hela toppen består av molekyler med samma molmassa, något som inte är möjligt med standard SEC-analys.
Bestämning av molmassa med SLS kräver att ljusspridningsmätningarna kombineras med koncentrationsmätningar. Därför inkluderar SEC-MALS typiskt ljusspridningsdetektorn och antingen en differentialrefraktometer eller UV/Vis absorbansdetektor. Dessutom bestämmer MALS rms-radien Rg för molekyler över en viss storleksgräns, vanligtvis 10 nm. SEC-MALS kan därför analysera konformationen av polymerer via förhållandet mellan molmassa och Rg . För mindre molekyler tillsätts antingen DLS eller, mer vanligt, en differentialviskosimeter för att bestämma hydrodynamisk radie och utvärdera molekylär konformation på samma sätt.
I SEC-DLS mäts storleken på makromolekylerna när de eluerar in i flödescellen i DLS-instrumentet från storleksexklusionskolonnuppsättningen. Den hydrodynamiska storleken på molekylerna eller partiklarna mäts och inte deras molekylvikter. För proteiner kan en Mark-Houwink-typ av beräkning användas för att uppskatta molekylvikten från den hydrodynamiska storleken.
En stor fördel med DLS i kombination med SEC är möjligheten att erhålla förbättrad DLS-upplösning. Batch DLS är snabbt och enkelt och ger ett direkt mått på den genomsnittliga storleken, men baslinjeupplösningen för DLS är ett förhållande på 3:1 i diameter. Med hjälp av SEC separeras proteinerna och proteinoligomererna, vilket möjliggör oligomer upplösning. Aggregationsstudier kan också göras med ASEC. Även om aggregatkoncentrationen kanske inte beräknas med ljusspridning (en onlinekoncentrationsdetektor som den som används i SEC-MALS för mätning av molmassa bestämmer också aggregatkoncentrationen), kan aggregatets storlek mätas, endast begränsat av den maximala storleken som eluerar från SEC-kolumnerna.
Begränsningar för ASEC med DLS-detektion inkluderar flödeshastighet, koncentration och precision. Eftersom en korrelationsfunktion kräver allt från 3–7 sekunder för att bygga korrekt, kan ett begränsat antal datapunkter samlas in över toppen. ASEC med SLS-detektion begränsas inte av flödeshastigheten och mättiden är i huvudsak momentan, och koncentrationsintervallet är flera storleksordningar större än för DLS. Molar massanalys med SEC-MALS kräver dock noggranna koncentrationsmätningar. MALS- och DLS-detektorer kombineras ofta i ett enda instrument för mer omfattande absolut analys efter separation av SEC.
Se även
externa länkar
|
Bibliotekets resurser om gelpermeationskromatografi |