Mutation
| Del av en serie om |
| genetik |
|---|
 |
| Del av en serie om |
| Evolutionsbiologi |
|---|

|


Inom biologi är en mutation en förändring i nukleinsyrasekvensen i genomet av en organism , virus eller extrakromosomalt DNA . Virala genom innehåller antingen DNA eller RNA . Mutationer är resultatet av fel under DNA eller virusreplikation , mitos eller meios eller andra typer av skador på DNA (såsom pyrimidindimerer orsakade av exponering för ultraviolett strålning), som sedan kan genomgå felbenägen reparation (särskilt mikrohomologimedierad ändskarvning ) , orsaka ett fel under andra former av reparation, eller orsaka ett fel under replikering ( translesionssyntes) . Mutationer kan också vara resultatet av insättning eller deletion av DNA-segment på grund av mobila genetiska element .
Mutationer kan eller kanske inte producerar detekterbara förändringar i en organisms observerbara egenskaper ( fenotyp ). Mutationer spelar en roll i både normala och onormala biologiska processer, inklusive: evolution , cancer , och utvecklingen av immunsystemet , inklusive kopplingsdiversitet . Mutation är den ultimata källan till all genetisk variation , och tillhandahåller det råmaterial som evolutionära krafter som naturligt urval kan verka på.
Mutation kan resultera i många olika typer av förändringar i sekvenser. Mutationer i gener kan inte ha någon effekt, förändra produkten av en gen eller hindra genen från att fungera korrekt eller helt. Mutationer kan också förekomma i icke-geniska regioner . En studie från 2007 om genetiska variationer mellan olika arter av Drosophila föreslog att, om en mutation förändrar ett protein som produceras av en gen, kommer resultatet sannolikt att vara skadligt, med uppskattningsvis 70 % av aminosyrapolymorfismerna som har skadliga effekter, och resten vara antingen neutral eller marginellt fördelaktig. På grund av de skadliga effekter som mutationer kan ha på gener, har organismer mekanismer som DNA-reparation för att förhindra eller korrigera mutationer genom att återställa den muterade sekvensen till sitt ursprungliga tillstånd.
Översikt
Mutationer kan involvera duplicering av stora delar av DNA, vanligtvis genom genetisk rekombination . Dessa dupliceringar är en viktig källa till råmaterial för att utveckla nya gener, med tiotals till hundratals gener duplicerade i djurens genom varje miljon år. De flesta gener tillhör större genfamiljer av delad härkomst, detekterbara genom deras sekvenshomologi . Nya gener produceras med flera metoder, vanligen genom duplicering och mutation av en förfäders gen, eller genom att rekombinera delar av olika gener för att bilda nya kombinationer med nya funktioner.
Här fungerar proteindomäner som moduler, var och en med en speciell och oberoende funktion, som kan blandas ihop för att producera gener som kodar för nya proteiner med nya egenskaper. Till exempel använder det mänskliga ögat fyra gener för att skapa strukturer som känner av ljus: tre för koncells- eller färgseende och en för stavceller eller mörkerseende; alla fyra uppstod från en enda förfäders gen. En annan fördel med att duplicera en gen (eller till och med ett helt genom) är att detta ökar teknisk redundans ; detta tillåter en gen i paret att förvärva en ny funktion medan den andra kopian utför den ursprungliga funktionen. Andra typer av mutationer skapar då och då nya gener från tidigare icke-kodande DNA .
Förändringar i kromosomantal kan innebära ännu större mutationer, där segment av DNA i kromosomerna går sönder och sedan omarrangeras. Till exempel, i Homininae , två kromosomer fusionerade för att producera mänsklig kromosom 2 ; denna sammansmältning inträffade inte i de andra apornas härstamning , och de behåller dessa separata kromosomer. I evolutionen kan den viktigaste rollen för sådana kromosomala omarrangemang vara att påskynda divergensen av en population till nya arter genom att göra populationer mindre benägna att korsa sig, och därigenom bevara genetiska skillnader mellan dessa populationer.
Sekvenser av DNA som kan röra sig i genomet, såsom transposoner , utgör en stor del av det genetiska materialet hos växter och djur, och kan ha varit viktiga i utvecklingen av genom. Till exempel finns mer än en miljon kopior av Alu-sekvensen i det mänskliga genomet , och dessa sekvenser har nu rekryterats för att utföra funktioner som att reglera genuttryck . En annan effekt av dessa mobila DNA-sekvenser är att när de rör sig inom ett genom kan de mutera eller ta bort befintliga gener och därigenom producera genetisk mångfald.
Icke-dödliga mutationer ackumuleras i genpoolen och ökar mängden genetisk variation. Överflödet av vissa genetiska förändringar inom genpoolen kan minskas genom naturligt urval , medan andra "mer gynnsamma" mutationer kan ackumuleras och resultera i adaptiva förändringar.
Till exempel kan en fjäril få avkomma med nya mutationer. Majoriteten av dessa mutationer kommer inte att ha någon effekt; men man kan ändra färgen på en av fjärilens avkommor, vilket gör det svårare (eller lättare) för rovdjur att se. Om denna färgförändring är fördelaktig är chanserna för denna fjäril att överleva och producera sin egen avkomma lite bättre, och med tiden kan antalet fjärilar med denna mutation utgöra en större andel av populationen.
Neutrala mutationer definieras som mutationer vars effekter inte påverkar en individs kondition . Dessa kan öka i frekvens med tiden på grund av genetisk drift . Man tror att den överväldigande majoriteten av mutationer inte har någon signifikant effekt på en organisms kondition. DNA-reparationsmekanismer kan också laga de flesta förändringar innan de blir permanenta mutationer, och många organismer har mekanismer för att eliminera annars permanent muterade somatiska celler .
Nyttiga mutationer kan förbättra reproduktiv framgång.
Orsaker
Fyra klasser av mutationer är (1) spontana mutationer (molekylärt sönderfall), (2) mutationer på grund av felbenägen replikationsbypass av naturligt förekommande DNA-skador (även kallad felbenägen translesionssyntes), (3) fel som introduceras under DNA-reparation, och (4) inducerade mutationer orsakade av mutagener . Forskare kan också medvetet introducera mutantsekvenser genom DNA-manipulation för vetenskapliga experiments skull.
En studie från 2017 hävdade att 66 % av cancerframkallande mutationer är slumpmässiga, 29 % beror på miljön (den studerade befolkningen sträckte sig över 69 länder) och 5 % är ärvda.
Människor skickar i genomsnitt 60 nya mutationer till sina barn, men fäder skickar fler mutationer beroende på deras ålder och varje år lägger till två nya mutationer till ett barn.
Spontan mutation
Spontana mutationer uppstår med en sannolikhet som inte är noll även med tanke på en frisk, oförorenad cell. Naturligt förekommande oxidativa DNA-skador uppskattas inträffa 10 000 gånger per cell och dag hos människor och 100 000 gånger per cell och dag hos råttor . Spontana mutationer kan karakteriseras av den specifika förändringen:
- Tautomerism – En bas förändras genom ompositionering av en väteatom , vilket ändrar vätebindningsmönstret för den basen, vilket resulterar i felaktig basparning under replikering. Teoretiska resultat tyder på att protontunnling är en viktig faktor i det spontana skapandet av GC- tautomerer .
- Depurinering – Förlust av en purinbas (A eller G) för att bilda ett apuriniskt ställe ( AP-ställe) .
- Deaminering – Hydrolys ändrar en normal bas till en atypisk bas som innehåller en ketogrupp i stället för den ursprungliga amingruppen . Exempel inkluderar C → U och A → HX ( hypoxantin ), som kan korrigeras genom DNA-reparationsmekanismer; och 5MeC ( 5-metylcytosin ) → T, som är mindre sannolikt att detekteras som en mutation eftersom tymin är en normal DNA-bas.
- Felparning av glidande sträng – Denaturering av den nya strängen från mallen under replikering, följt av renaturering på en annan plats ("glidning"). Detta kan leda till infogningar eller borttagningar.
Felbenägen replikeringsbypass
Det finns allt fler bevis för att majoriteten av spontant uppkomna mutationer beror på felbenägen replikation ( translesionssyntes ) tidigare DNA-skada i mallsträngen. Hos möss orsakas majoriteten av mutationerna av translesionssyntes. På samma sätt, i jäst , Kunz et al. fann att mer än 60 % av de spontana enkla basparsubstitutionerna och deletionerna orsakades av translesionssyntes.
Fel som introducerades under DNA-reparation
Även om naturligt förekommande dubbelsträngsbrott inträffar med en relativt låg frekvens i DNA, orsakar deras reparation ofta mutation. Icke-homolog ändskarvning (NHEJ) är en viktig väg för att reparera dubbelsträngsbrott. NHEJ involverar avlägsnande av ett fåtal nukleotider för att tillåta något inexakt inriktning av de två ändarna för återförening följt av tillsats av nukleotider för att fylla i luckor. Som en konsekvens introducerar NHEJ ofta mutationer.

Inducerad mutation
Inducerade mutationer är förändringar i genen efter att den har kommit i kontakt med mutagener och miljöorsaker.
Inducerade mutationer på molekylär nivå kan orsakas av:
- Kemikalier
- Hydroxylamin
- Basanaloger (t.ex. bromodeoxiuridin (BrdU))
- Alkyleringsmedel (t.ex. N -etyl- N -nitrosourea (ENU). Dessa medel kan mutera både replikerande och icke-replikerande DNA. Däremot kan en basanalog mutera DNA:t endast när analogen är inkorporerad i replikerande DNA. Varje av dessa klasser av kemiska mutagener har vissa effekter som sedan leder till övergångar , transversioner eller deletioner.
- Medel som bildar DNA-addukter (t.ex. ochratoxin A )
- DNA- interkalerande medel (t.ex. etidiumbromid )
- DNA-tvärbindare
- Oxidativ skada
- Salpetersyrlighet omvandlar amingrupper på A och C till diazogrupper , vilket förändrar deras vätebindningsmönster, vilket leder till felaktig basparning under replikering.
- Strålning
- Ultraviolett ljus (UV) (inklusive icke-joniserande strålning) . Två nukleotidbaser i DNA - cytosin och tymin - är mest känsliga för strålning som kan förändra deras egenskaper. UV-ljus kan få intilliggande pyrimidinbaser i en DNA-sträng att bli kovalent sammanfogade som en pyrimidindimer . UV-strålning, särskilt långvågig UVA, kan också orsaka oxidativ skada på DNA .
- Joniserande strålning . Exponering för joniserande strålning, såsom gammastrålning , kan resultera i mutationer, vilket kan leda till cancer eller dödsfall.
Medan mutationer tidigare antogs inträffa av en slump, eller inducerade av mutagener, har molekylära mutationsmekanismer upptäckts i bakterier och över livets träd. Som S. Rosenberg säger, "Dessa mekanismer avslöjar en bild av mycket reglerad mutagenes, uppreglerad temporärt av stressreaktioner och aktiveras när celler/organismer är missanpassade till sina miljöer - när de är stressade - potentiellt accelererande anpassning." Eftersom de är självinducerade mutagena mekanismer som ökar anpassningshastigheten för organismer, har de ibland kallats adaptiva mutagenesmekanismer och inkluderar SOS-svaret i bakterier, ektopisk intrakromosomal rekombination och andra kromosomala händelser såsom duplikationer.
Klassificering av typer
Genom inverkan på strukturen
Sekvensen för en gen kan ändras på ett antal sätt. Genmutationer har olika effekter på hälsan beroende på var de förekommer och om de förändrar essentiella proteiners funktion. Mutationer i geners struktur kan delas in i flera typer.
Storskaliga mutationer
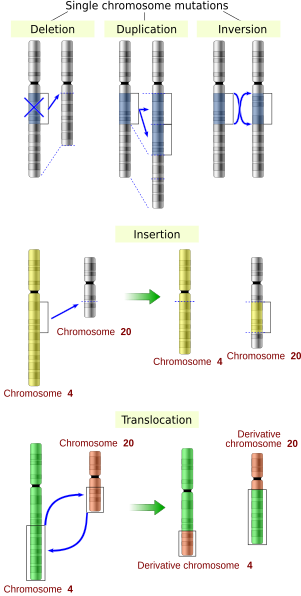
Storskaliga mutationer i kromosomal struktur inkluderar:
- Amplifieringar (eller genduplikationer ) eller upprepning av ett kromosomsegment eller närvaro av extra bit av en kromosom trasig kromosombit kan fästa till en homolog eller icke-homolog kromosom så att några av generna är närvarande i mer än två doser till flera kopior av alla kromosomala regioner, vilket ökar dosen av generna som finns inom dem.
- Polyploidi , duplicering av hela uppsättningar av kromosomer, vilket potentiellt kan resultera i en separat avelspopulation och artbildning .
- Borttagningar av stora kromosomala regioner, vilket leder till förlust av generna inom dessa regioner.
- Mutationer vars effekt är att sätta samman tidigare separata bitar av DNA, vilket potentiellt sammanför separata gener för att bilda funktionellt distinkta fusionsgener (t.ex. bcr-abl ) .
- Storskaliga förändringar av strukturen hos kromosomer som kallas kromosomomarrangemang som kan leda till minskad kondition men också till artbildning i isolerade, inavlade populationer. Dessa inkluderar:
- Kromosomala translokationer : utbyte av genetiska delar från icke-homologa kromosomer.
- Kromosomala inversioner : vända orienteringen av ett kromosomalt segment.
- Icke-homolog kromosomal korsning .
- Interstitiell deletion: en intrakromosomal deletion som tar bort ett DNA-segment från en enda kromosom, och därigenom applicerar tidigare avlägsna gener. Till exempel visade sig celler isolerade från ett mänskligt astrocytom , en typ av hjärntumör, ha en kromosomal deletion som tar bort sekvenser mellan genen Fused in Glioblastoma (FIG) och receptortyrosinkinas (ROS), som producerar ett fusionsprotein (FIG- ROS). Det onormala FIG-ROS-fusionsproteinet har konstitutivt aktiv kinasaktivitet som orsakar onkogen transformation (en transformation från normala celler till cancerceller).
- Förlust av heterozygositet : förlust av en allel , antingen genom en deletion eller en genetisk rekombinationshändelse, i en organism som tidigare hade två olika alleler.
Småskaliga mutationer
Småskaliga mutationer påverkar en gen i en eller några få nukleotider. (Om bara en enda nukleotid påverkas kallas de punktmutationer .) Småskaliga mutationer inkluderar:
- Insertioner lägger till en eller flera extra nukleotider i DNA:t. De orsakas vanligtvis av transponerbara element eller fel under replikering av upprepade element. Insertioner i den kodande regionen av en gen kan förändra splitsningen av mRNA ( splitsningsställemutation ), eller orsaka en förskjutning i läsramen ( frameshift ), som båda kan signifikant förändra genprodukten . Insättningar kan vändas genom excision av det transponerbara elementet.
- Deletioner tar bort en eller flera nukleotider från DNA:t. Liksom insertioner kan dessa mutationer förändra genens läsram. I allmänhet är de irreversibla: Även om exakt samma sekvens i teorin kan återställas genom en infogning, är det mycket osannolikt att transponerbara element som kan återställa en mycket kort deletion (säg 1–2 baser) på vilken plats som helst, antingen finns existerar inte alls.
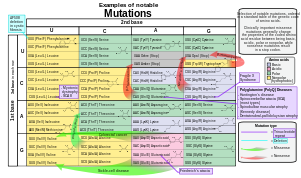
- Substitutionsmutationer , ofta orsakade av kemikalier eller felaktig funktion av DNA-replikation, byter ut en enskild nukleotid mot en annan. Dessa förändringar klassificeras som övergångar eller transversioner. Vanligast är övergången som byter ut en purin mot en purin (A ↔ G) eller en pyrimidin mot en pyrimidin, (C ↔ T). En övergång kan orsakas av salpetersyrlighet, basfelparning eller mutagena basanaloger som BrdU. Mindre vanlig är en transversion, som byter ut en purin mot en pyrimidin eller en pyrimidin mot en purin (C/T ↔ A/G). Ett exempel på en transversion är omvandlingen av adenin (A) till ett cytosin (C). Punktmutationer är modifieringar av enstaka baspar av DNA eller andra små baspar inom en gen. En punktmutation kan vändas genom en annan punktmutation, där nukleotiden ändras tillbaka till sitt ursprungliga tillstånd (sann reversion) eller genom reversion på andra plats (en komplementär mutation någon annanstans som resulterar i återvunnen genfunktionalitet). Som diskuteras nedan kan punktmutationer som förekommer inom den proteinkodande regionen av en gen klassificeras som synonyma eller icke-synonyma substitutioner , av vilka de senare i sin tur kan delas in i missense- eller nonsensmutationer .
Genom inverkan på proteinsekvensen

Effekten av en mutation på proteinsekvensen beror delvis på var i genomet den förekommer, särskilt om den är i en kodande eller icke-kodande region . Mutationer i de icke-kodande regulatoriska sekvenserna av en gen, såsom promotorer, förstärkare och ljuddämpare, kan förändra nivåer av genuttryck, men är mindre benägna att förändra proteinsekvensen. Mutationer inom introner och i regioner utan känd biologisk funktion (t.ex. pseudogener , retrotransposoner ) är i allmänhet neutrala och har ingen effekt på fenotypen – även om intronmutationer kan förändra proteinprodukten om de påverkar mRNA-splitsningen.
Mutationer som förekommer i kodande regioner av genomet är mer benägna att förändra proteinprodukten och kan kategoriseras efter deras effekt på aminosyrasekvensen:
- En ramförskjutningsmutation orsakas av insättning eller deletion av ett antal nukleotider som inte är jämnt delbara med tre från en DNA-sekvens. På grund av triplettkaraktären av genuttryck av kodoner, kan infogningen eller deletionen störa läsramen, eller grupperingen av kodonen, vilket resulterar i en helt annan translation från originalet. Ju tidigare i sekvensen deletionen eller infogningen sker, desto mer förändrat är det producerade proteinet. (Till exempel kodar koden CCU GAC UAC CUA för aminosyrorna prolin, asparaginsyra, tyrosin och leucin. Om U i CCU raderades skulle den resulterande sekvensen vara CCG ACU ACC UAx, som istället skulle koda för prolin, treonin, treonin och en del av en annan aminosyra eller kanske ett stoppkodon (där x står för följande nukleotid). Däremot kallas varje insättning eller deletion som är jämnt delbar med tre en mutation i läsramen .
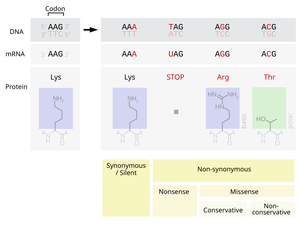
- En punktsubstitutionsmutation resulterar i en förändring i en enda nukleotid och kan vara antingen synonym eller icke-synonym.
- En synonym substitution ersätter ett kodon med ett annat kodon som kodar för samma aminosyra, så att den producerade aminosyrasekvensen inte modifieras. Synonyma mutationer uppstår på grund av den genetiska kodens degenererade natur . Om denna mutation inte resulterar i några fenotypiska effekter, kallas den tyst , men inte alla synonyma substitutioner är tysta. (Det kan också finnas tysta mutationer i nukleotider utanför de kodande regionerna, såsom intronerna, eftersom den exakta nukleotidsekvensen inte är lika avgörande som den är i de kodande regionerna, men dessa anses inte vara synonyma substitutioner.)
- En icke-synonym substitution ersätter ett kodon med ett annat kodon som kodar för en annan aminosyra, så att den producerade aminosyrasekvensen modifieras. Icke-synonyma substitutioner kan klassificeras som nonsens- eller missense-mutationer:
- En missense-mutation förändrar en nukleotid för att orsaka substitution av en annan aminosyra. Detta kan i sin tur göra det resulterande proteinet icke-funktionellt. Sådana mutationer är ansvariga för sjukdomar som Epidermolysis bullosa , sickle-cell disease och SOD1- medierad ALS . Å andra sidan, om en missense-mutation inträffar i ett aminosyrakodon som resulterar i användningen av en annan, men kemiskt liknande, aminosyra, så görs ibland liten eller ingen förändring i proteinet. Till exempel kommer en förändring från AAA till AGA att koda för arginin , en kemiskt liknande molekyl till det avsedda lysinet . I det senare fallet kommer mutationen att ha liten eller ingen effekt på fenotypen och därför vara neutral .
- En nonsensmutation är en punktmutation i en DNA-sekvens som resulterar i ett för tidigt stoppkodon, eller ett nonsenskodon i det transkriberade mRNA:t, och möjligen en trunkerad och ofta icke-funktionell proteinprodukt. Denna typ av mutation har kopplats till olika sjukdomar, såsom medfödd binjurehyperplasi . (Se Stoppkodon .)
Genom inverkan på funktion
En mutation blir en effekt på funktionsmutation när exaktheten av funktioner mellan ett muterat protein och dess direkta interaktör genomgår förändring. Interaktörerna kan vara andra proteiner, molekyler, nukleinsyror, etc. Det finns många mutationer som faller under kategorin av effekt på funktion, men beroende på förändringens specificitet kommer mutationerna som listas nedan att inträffa.
- Funktionsbortfallsmutationer, även kallade inaktiverande mutationer, resulterar i att genprodukten har mindre eller ingen funktion (blir helt eller delvis inaktiverad). När allelen har en fullständig funktionsförlust ( nollallel ) kallas den ofta för en amorf eller amorf mutation i Mullers morphs schema. Fenotyper associerade med sådana mutationer är oftast recessiva . Undantag är när organismen är haploid , eller när den reducerade dosen av en normal genprodukt inte räcker för en normal fenotyp (detta kallas haploinsufficiens ). En sjukdom som orsakas av en funktionsförlustmutation är Gitelmans syndrom och cystisk fibros.
- Gain-of-function mutationer, även kallade aktiverande mutationer, förändrar genprodukten så att dess effekt blir starkare (förstärkt aktivering) eller till och med ersätts av en annan och onormal funktion. När den nya allelen skapas kommer en heterozygot som innehåller den nyskapade allelen såväl som originalet att uttrycka den nya allelen; genetiskt definierar detta mutationerna som dominerande fenotyper. Flera av Mullers morfer motsvarar funktionsvinsten, inklusive hypermorf (ökat genuttryck) och neomorf (ny funktion). I december 2017 hävde den amerikanska regeringen ett tillfälligt förbud som implementerades 2014 som förbjöd federal finansiering av alla nya "gain-of-function"-experiment som förstärker patogener "såsom fågelinfluensa, SARS och Mellanösterns luftvägssyndrom eller MERS-virus. Många sjukdomar orsakas av denna mutation inklusive systemisk mastocytos och STAT3-sjukdom.
- Dominanta negativa mutationer (även kallade antimorfa mutationer) har en förändrad genprodukt som verkar antagonistiskt mot vildtypsallelen. Dessa mutationer resulterar vanligtvis i en förändrad molekylär funktion (ofta inaktiv) och kännetecknas av en dominant eller semi-dominant fenotyp. Hos människor har dominanta negativa mutationer varit inblandade i cancer (t.ex. mutationer i generna p53 , ATM , CEBPA och PPARgamm a]). Marfans syndrom orsakas av mutationer i FBN1 -genen, lokaliserad på kromosom 15 , som kodar för fibrillin-1, en glykoproteinkomponent i den extracellulära matrisen . Marfans syndrom är också ett exempel på dominant negativ mutation och haploinsufficiens.
- Dödliga mutationer resulterar i omedelbar död hos den utvecklande organismen. Dödliga mutationer kan också leda till en betydande förlust av organismens förväntade livslängd. Ett exempel på en sjukdom som orsakas av en dominant dödlig mutation är Huntingtons sjukdom .
- Nollmutationer, även kända som amorfa mutationer, är en form av funktionsförlustmutationer som helt förbjuder genens funktion. Mutationen leder till en fullständig funktionsbortfall på fenotypisk nivå, vilket också gör att ingen genprodukt bildas. Atopiskt eksem och dermatitsyndrom är vanliga sjukdomar som orsakas av en nollmutation av genen som aktiverar filaggrin.
- Suppressormutationer är en typ av mutation som gör att dubbelmutationen uppträder normalt. I suppressormutationer är den fenotypiska aktiviteten för en annan mutation helt undertryckt, vilket gör att dubbelmutationen ser normal ut. Det finns två typer av suppressormutationer, det finns intragena och extragena suppressormutationer. Intragena mutationer förekommer i genen där den första mutationen inträffar, medan extragena mutationer förekommer i genen som interagerar med produkten av den första mutationen. En vanlig sjukdom som härrör från denna typ av mutation är Alzheimers sjukdom .
- Neomorfa mutationer är en del av gain-of-function mutationer och kännetecknas av kontroll av syntesen av nya proteinprodukter. Den nyligen syntetiserade genen innehåller normalt ett nytt genuttryck eller molekylär funktion. Resultatet av den neomorfa mutationen är att genen där mutationen inträffar har en fullständig förändring i funktion.
- En bakmutation eller reversion är en punktmutation som återställer den ursprungliga sekvensen och därmed den ursprungliga fenotypen.
Genom effekt på konditionen (skadliga, fördelaktiga, neutrala mutationer)
Inom genetik är det ibland användbart att klassificera mutationer som antingen skadliga eller fördelaktiga (eller neutrala ):
- En skadlig eller skadlig mutation minskar kroppens kondition. Många, men inte alla mutationer i essentiella gener är skadliga (om en mutation inte ändrar aminosyrasekvensen i ett essentiellt protein är det i de flesta fall ofarligt).
- En fördelaktig eller fördelaktig mutation ökar kroppens kondition. Exempel är mutationer som leder till antibiotikaresistens hos bakterier (vilket är fördelaktigt för bakterier men vanligtvis inte för människor).
- En neutral mutation har ingen skadlig eller gynnsam effekt på organismen. Sådana mutationer sker med en jämn hastighet och utgör grunden för den molekylära klockan . I den neutrala teorin om molekylär evolution ger neutrala mutationer genetisk drift som grund för mest variation på molekylär nivå. Hos djur eller växter är de flesta mutationer neutrala, med tanke på att den stora majoriteten av deras genom antingen är icke-kodande eller består av repetitiva sekvenser som inte har någon uppenbar funktion (" skräp-DNA ").
Storskaliga kvantitativa mutagenesskärmar , där tusentals miljoner mutationer testas, finner alltid att en större del av mutationer har skadliga effekter men ger alltid tillbaka ett antal fördelaktiga mutationer också. Till exempel, i en screening av alla gendeletioner i E. coli , var 80 % av mutationerna negativa, men 20 % var positiva, även om många hade en mycket liten effekt på tillväxten (beroende på tillstånd). Observera att gendeletioner involverar borttagning av hela gener, så att punktmutationer nästan alltid har en mycket mindre effekt. I en liknande screening i Streptococcus pneumoniae , men denna gång med transposoninsättningar , klassificerades 76 % av insättningsmutanterna som neutrala, 16 % hade en signifikant nedsatt kondition, men 6 % var fördelaktiga.
Denna klassificering är uppenbarligen relativ och något artificiell: en skadlig mutation kan snabbt förvandlas till en fördelaktig mutation när förhållandena förändras. Det finns också en gradient från skadlig/nyttig till neutral, eftersom många mutationer kan ha små och mestadels försumbara effekter men under vissa förhållanden blir relevanta. Dessutom bestäms många egenskaper av hundratals gener (eller loci), så att varje lokus endast har en mindre effekt. Till exempel bestäms mänsklig längd av hundratals genetiska varianter ("mutationer"), men var och en av dem har en mycket liten effekt på höjden, bortsett från effekterna av näring . Höjd (eller storlek) i sig kan vara mer eller mindre fördelaktigt som det enorma utbudet av storlekar i djur- eller växtgrupper visar.
Fördelning av fitnesseffekter (DFE)
Försök har gjorts att sluta sig till fördelningen av fitnesseffekter (DFE) med hjälp av mutagenesexperiment och teoretiska modeller tillämpade på molekylära sekvensdata. DFE, som används för att bestämma den relativa förekomsten av olika typer av mutationer (dvs starkt skadliga, nästan neutrala eller fördelaktiga), är relevant för många evolutionära frågor, såsom upprätthållande av genetisk variation, graden av genomiskt förfall , upprätthållande av överskrider sexuell reproduktion i motsats till inavel och utvecklingen av kön och genetisk rekombination . DFE kan också spåras genom att spåra skevheten i fördelningen av mutationer med förmodat allvarliga effekter jämfört med fördelningen av mutationer med förmodat mild eller frånvarande effekt. Sammanfattningsvis spelar DFE en viktig roll för att förutsäga evolutionär dynamik . En mängd olika metoder har använts för att studera DFE, inklusive teoretiska, experimentella och analytiska metoder.
- Mutagenesexperiment: Den direkta metoden för att undersöka DFE är att inducera mutationer och sedan mäta mutationseffekterna, vilket redan har gjorts i virus, bakterier , jäst och Drosophila . Till exempel använde de flesta studier av DFE i virus platsriktad mutagenes för att skapa punktmutationer och mäta relativ kondition för varje mutant. I Escherichia coli använde en studie transposonmutagenes för att direkt mäta lämpligheten av en slumpmässig infogning av ett derivat av Tn10 . I jäst har en kombinerad mutagenes och djupsekvenseringsmetod utvecklats för att generera högkvalitativa systematiska mutantbibliotek och mäta kondition i hög genomströmning. Men med tanke på att många mutationer har effekter som är för små för att detekteras och att mutagenesexperiment endast kan detektera mutationer med måttligt stor effekt; DNA- sekvensanalys kan ge värdefull information om dessa mutationer.
-
Molekylär sekvensanalys: Med den snabba utvecklingen av DNA- sekvenseringsteknologi är en enorm mängd DNA-sekvensdata tillgänglig och ännu mer kommer i framtiden. Olika metoder har utvecklats för att sluta sig till DFE från DNA-sekvensdata. Genom att undersöka skillnader i DNA-sekvenser inom och mellan arter kan vi sluta oss till olika egenskaper hos DFE för neutrala, skadliga och fördelaktiga mutationer. För att vara specifik tillåter DNA-sekvensanalysmetoden oss att uppskatta effekterna av mutationer med mycket små effekter, som knappast kan detekteras genom mutagenesexperiment.
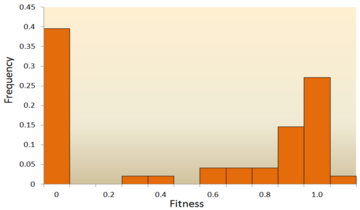
En av de tidigaste teoretiska studierna av fördelningen av fitnesseffekter gjordes av Motoo Kimura , en inflytelserik teoretisk populationsgenetiker . Hans neutrala teori om molekylär evolution föreslår att de flesta nya mutationer kommer att vara mycket skadliga, med en liten del som är neutral. Ett senare förslag från Hiroshi Akashi föreslog en bimodal modell för DFE, med lägen centrerade kring mycket skadliga och neutrala mutationer. Båda teorierna är överens om att den stora majoriteten av nya mutationer är neutrala eller skadliga och att fördelaktiga mutationer är sällsynta, vilket har stöds av experimentella resultat. Ett exempel är en studie gjord på DFE av slumpmässiga mutationer i vesikulärt stomatitvirus . Av alla mutationer var 39,6 % dödliga, 31,2 % var icke-dödliga skadliga och 27,1 % var neutrala. Ett annat exempel kommer från ett experiment med hög genomströmning av mutagenes med jäst. I detta experiment visades det att den totala DFE är bimodal, med ett kluster av neutrala mutationer och en bred fördelning av skadliga mutationer.
Även om relativt få mutationer är fördelaktiga, spelar de som är en viktig roll i evolutionära förändringar. Liksom neutrala mutationer kan svagt utvalda fördelaktiga mutationer gå förlorade på grund av slumpmässig genetisk drift, men starkt utvalda fördelaktiga mutationer är mer sannolikt att fixeras. Att känna till DFE för fördelaktiga mutationer kan leda till ökad förmåga att förutsäga den evolutionära dynamiken. Teoretiskt arbete på DFE för fördelaktiga mutationer har gjorts av John H. Gillespie och H. Allen Orr . De föreslog att fördelningen för fördelaktiga mutationer skulle vara exponentiell under ett brett spektrum av förhållanden, vilket i allmänhet har stöds av experimentella studier, åtminstone för starkt utvalda fördelaktiga mutationer.
I allmänhet är det accepterat att majoriteten av mutationer är neutrala eller skadliga, med fördelaktiga mutationer sällsynta; dock varierar andelen typer av mutationer mellan arterna. Detta indikerar två viktiga punkter: för det första kommer andelen effektivt neutrala mutationer sannolikt att variera mellan arter, vilket är ett resultat av beroende av effektiv populationsstorlek ; för det andra varierar den genomsnittliga effekten av skadliga mutationer dramatiskt mellan arter. Dessutom skiljer sig DFE också mellan kodande regioner och icke-kodande regioner , med DFE för icke-kodande DNA som innehåller svagare utvalda mutationer.
Genom arv

I flercelliga organismer med dedikerade reproduktionsceller kan mutationer delas in i könslinjemutationer , som kan överföras till ättlingar genom deras reproduktionsceller, och somatiska mutationer (även kallade förvärvade mutationer), som involverar celler utanför den dedikerade reproduktiva gruppen och som inte är vanligtvis överförs till ättlingar.
Diploida organismer (t.ex. människor) innehåller två kopior av varje gen - en faderlig och en moderns allel. Baserat på förekomsten av mutationer på varje kromosom kan vi klassificera mutationer i tre typer. En vildtyp eller homozygot icke-muterad organism är en där ingen av allelerna är muterade.
- En heterozygot mutation är en mutation av endast en allel.
- En homozygot mutation är en identisk mutation av både faderns och moderns alleler.
- Sammansatta heterozygota mutationer eller en genetisk förening består av två olika mutationer i faderns och moderns alleler.
Könslinjemutation
En könscellsmutation i en individs reproduktionsceller ger upphov till en konstitutionell mutation hos avkomman, det vill säga en mutation som finns i varje cell. En konstitutionell mutation kan också inträffa mycket snart efter befruktning , eller fortsätta från en tidigare konstitutionell mutation hos en förälder. En könscellsmutation kan överföras genom efterföljande generationer av organismer.
Skillnaden mellan könsceller och somatiska mutationer är viktig hos djur som har en dedikerad könslinje för att producera reproduktionsceller. Det är dock av ringa värde för att förstå effekterna av mutationer i växter, som saknar en dedikerad groddlinje. Skillnaden är också suddig hos de djur som förökar sig asexuellt genom mekanismer som knoppning , eftersom cellerna som ger upphov till dotterorganismerna också ger upphov till den organismens könslinje.
En ny könslinjemutation som inte ärvts från någon av föräldrarna kallas en de novo- mutation .
Somatisk mutation
GENMUTATIONER :
Genmutationer inkluderar antingen ersättning av en av nukleotiderna med nukleotiden med den andra nukleotiden eller kan vara genom tillägg eller deletion av nukleotiden. Detta skulle förklaras som den plötsliga förändringen eller förändringen i nukleotidsekvensen för DNA-molekylen, vilket skulle påverka ett par nukleotid eller den större konsten av genen på kromosomen. Dessa genmutationer kan ytterligare klassificeras som:
1. Punktmutationer : Detta uppstår när det bara finns skillnad i ett baspar av nukleotid som också kan kallas för basparsubstitution och detta är också en av de vanligaste typerna bland genmutationerna. Punktmutationer kan återigen delas in i tre typer av mutationer, nämligen Tysta mutationer, Nonsense mutationer, Missense mutationer.
a) Tysta mutationer :
Detta inträffar när det finns en förändring i kodonet för en aminosyramolekyl byts ut eller är in i det andra kodonet av samma aminosyramolekyl och kallas även "synonyma mutationer"
b) Missense-mutationer:
Detta inträffar när kodonet för en aminosyra byts ut med kodonet för en annan aminosyra och kan också hänvisas till som icke-synonyma mutationer.
c) Nonsensmutationer:
Detta inträffar när aminosyrans kodon ändras till stoppkodonet.
2. Frameshift-mutationer :
Denna typ av mutation uppstår när det finns tillägg eller radering av DNA-basmolekyler ändrar läsramen för genen. Dessa mutationer skulle vara insertioner eller deletioner.
a) Infogning:
Denna typ av mutation skiljer DNA-basnumret i genen genom att lägga till den del av DNA:t.
b) Radering:
Denna typ av mutation uppstår när det finns en skillnad i antalet DNA-baser genom att eliminera en bit av DNA.
3. Bassubstitutionsmutationer :
Denna typ av mutationer uppstår när det ena basparet ersätts med det andra basparet. Dessa mutationer klassificeras vidare som övergångsmutation och transversionsmutation,
a) Övergångsmutation : Detta inträffar när basen av en kemikalie ersätts av den andra basen av samma kemiska molekyl (4). Det händer främst när det sker transponering av purinmolekylerna, dvs. A transponeras av G eller genom transponering av pyrimidinmolekyler, dvs. C av T i DNA-molekylen.
b) Transvsionsmutation : Detta inträffar när det finns en motsatt ersättning av en kategoribaskemikalie med en annan bas av den andra kategorin. Detta beror främst på felaktig ersättning av DNA-baserna, dvs när en pyrimidin ersätts med purinmolekyl.
En förändring i den genetiska strukturen som inte ärvs från en förälder, och inte heller överförs till avkomman, kallas en somatisk mutation . Somatiska mutationer ärvas inte av en organisms avkomma eftersom de inte påverkar könslinjen . Men de överförs till alla avkommor till en muterad cell inom samma organism under mitos. En större del av en organism kan därför bära på samma mutation. Dessa typer av mutationer orsakas vanligtvis av miljömässiga orsaker, såsom ultraviolett strålning eller exponering för vissa skadliga kemikalier, och kan orsaka sjukdomar inklusive cancer.
Med växter kan vissa somatiska mutationer förökas utan behov av fröproduktion, till exempel genom ympning och stamsticklingar. Dessa typer av mutationer har lett till nya typer av frukter, såsom "Delicious" äpplet och "Washington" navel orange .
Somatiska celler från människa och mus har en mutationshastighet som är mer än tio gånger högre än könslinjemutationshastigheten för båda arterna; möss har en högre frekvens av både somatiska mutationer och könslinjemutationer per celldelning än människor. Skillnaden i mutationshastighet mellan könsceller och somatiska vävnader återspeglar sannolikt den större betydelsen av genomupprätthållande i könslinjen än i soma.
Specialklasser
- Villkorlig mutation är en mutation som har vildtyp (eller mindre allvarlig) fenotyp under vissa "tillåtande" miljöförhållanden och en mutant fenotyp under vissa "restriktiva" förhållanden. Till exempel kan en temperaturkänslig mutation orsaka celldöd vid hög temperatur (restriktivt tillstånd), men kan inte ha några skadliga konsekvenser vid en lägre temperatur (tillåtande tillstånd). Dessa mutationer är icke-autonoma, eftersom deras manifestation beror på närvaron av vissa tillstånd, i motsats till andra mutationer som uppträder autonomt. De tillåtande förhållandena kan vara temperatur , vissa kemikalier, ljus eller mutationer i andra delar av genomet . In vivo -mekanismer som transkriptionella switchar kan skapa villkorade mutationer. Till exempel kan association av Steroid Binding Domain skapa en transkriptionell switch som kan ändra uttrycket av en gen baserat på närvaron av en steroidligand. Villkorade mutationer har tillämpningar inom forskning eftersom de tillåter kontroll över genuttryck. Detta är särskilt användbart när man studerar sjukdomar hos vuxna genom att tillåta uttryck efter en viss tillväxtperiod, vilket eliminerar den skadliga effekten av genuttryck som ses under utvecklingsstadier i modellorganismer. DNA-rekombinassystem som Cre-Lox-rekombination som används i samband med promotorer som aktiveras under vissa förhållanden kan generera villkorade mutationer. Dual Recombinase-teknologi kan användas för att inducera flera villkorade mutationer för att studera de sjukdomar som manifesterar sig som ett resultat av samtidiga mutationer i flera gener. Vissa inteiner har identifierats som splitsar endast vid vissa tillåtande temperaturer, vilket leder till felaktig proteinsyntes och därmed förlust av funktionsmutationer vid andra temperaturer. Villkorade mutationer kan också användas i genetiska studier kopplade till åldrande, eftersom uttrycket kan förändras efter en viss tidsperiod i organismens livslängd.
- Replikationstidspunkten kvantitativa egenskaper loci påverkar DNA-replikation.
Nomenklatur
För att kategorisera en mutation som sådan måste den "normala" sekvensen erhållas från DNA från en "normal" eller "frisk" organism (i motsats till en "mutant" eller "sjuk"), den bör identifieras och rapporterad; helst bör den göras allmänt tillgänglig för en enkel nukleotid-för-nukleotid-jämförelse och godkännas av forskarsamhället eller av en grupp experter på genetiker och biologer , som har ansvaret för att fastställa standarden eller så kallad "konsensus" sekvens. Detta steg kräver en enorm vetenskaplig ansträngning. När konsensussekvensen är känd kan mutationerna i ett genom fastställas, beskrivas och klassificeras. Kommittén för Human Genome Variation Society (HGVS) har utvecklat standardnomenklaturen för humana sekvensvarianter, som bör användas av forskare och DNA-diagnostiska centra för att generera entydiga mutationsbeskrivningar. I princip kan denna nomenklatur även användas för att beskriva mutationer i andra organismer. Nomenklaturen specificerar typen av mutation och bas- eller aminosyraförändringar.
- Nukleotidsubstitution (t.ex. 76A>T) – Siffran är positionen för nukleotiden från 5'-änden; den första bokstaven representerar nukleotiden av vildtyp och den andra bokstaven representerar nukleotiden som ersatte vildtypen. I det givna exemplet ersattes adeninet på den 76:e positionen med en tymin.
- Om det blir nödvändigt att skilja mellan mutationer i genomiskt DNA , mitokondrie-DNA och RNA , används en enkel konvention. Till exempel, om den 100:e basen av en nukleotidsekvens muterades från G till C, skulle den skrivas som g.100G>C om mutationen inträffade i genomiskt DNA, m.100G>C om mutationen inträffade i mitokondrie-DNA, eller r.100g>c om mutationen inträffade i RNA. Observera att för mutationer i RNA skrivs nukleotidkoden med små bokstäver.
- Aminosyrasubstitution (t.ex. D111E) – Den första bokstaven är enbokstavskoden för vildtypsaminosyran, numret är positionen för aminosyran från N-terminalen och den andra bokstaven är enbokstavskoden för aminosyran som finns i mutationen. Nonsensmutationer representeras med ett X för den andra aminosyran (t.ex. D111X).
- Aminosyradeletion (t.ex. ΔF508) – Den grekiska bokstaven Δ ( delta ) indikerar en radering. Bokstaven hänvisar till aminosyran som finns i vildtypen och numret är positionen från N-terminalen av aminosyran om den skulle vara närvarande som i vildtypen.
Mutationshastigheter
Mutationshastigheterna varierar avsevärt mellan arter, och de evolutionära krafterna som generellt bestämmer mutation är föremål för pågående utredning.
Hos människor är mutationshastigheten cirka 50-90 de novo -mutationer per genom per generation, det vill säga varje människa ackumulerar cirka 50-90 nya mutationer som inte fanns hos hans eller hennes föräldrar . Detta antal har fastställts genom att sekvensera tusentals mänskliga trios, det vill säga två föräldrar och minst ett barn.
Genomen av RNA-virus är baserade på RNA snarare än DNA. Det virala RNA-genomet kan vara dubbelsträngat (som i DNA) eller enkelsträngat. I vissa av dessa virus (som det enkelsträngade humana immunbristviruset ) sker replikation snabbt och det finns inga mekanismer för att kontrollera genomet för noggrannhet. Denna felbenägna process resulterar ofta i mutationer.
Slumpmässighet av mutationer
Det finns ett utbrett antagande att mutationer är (helt) "slumpmässiga" med avseende på deras konsekvenser (i termer av sannolikhet). Detta visade sig vara fel eftersom mutationsfrekvensen kan variera mellan regioner i genomet, med sådan DNA-reparation - och mutationsfördomar som är associerade med olika faktorer. Till exempel visade sig biologiskt viktiga regioner vara skyddade från mutationer och mutationer som var fördelaktiga för den studerade växten visade sig vara mer sannolika – dvs mutation är "icke-slumpmässig på ett sätt som gynnar växten".
Sjukdomens orsakssamband
Förändringar i DNA orsakade av mutation i en kodande region av DNA kan orsaka fel i proteinsekvensen som kan resultera i delvis eller helt icke-funktionella proteiner. Varje cell, för att fungera korrekt, är beroende av tusentals proteiner för att fungera på rätt ställen vid rätt tidpunkt. När en mutation förändrar ett protein som spelar en avgörande roll i kroppen, kan ett medicinskt tillstånd uppstå. En studie om jämförelse av gener mellan olika arter av Drosophila tyder på att om en mutation förändrar ett protein, kommer mutationen troligen att vara skadlig, med uppskattningsvis 70 procent av aminosyrapolymorfismerna som har skadliga effekter, och resten är antingen neutrala eller svagt fördelaktigt. Vissa mutationer förändrar en gens DNA-bassekvens men förändrar inte det protein som genen gör. Studier har visat att endast 7 % av punktmutationer i icke-kodande DNA från jäst är skadliga och 12 % i kodande DNA är skadliga. Resten av mutationerna är antingen neutrala eller något fördelaktiga.
Ärftliga störningar
Om en mutation finns i en könscell kan den ge upphov till avkomma som bär mutationen i alla sina celler. Så är fallet vid ärftliga sjukdomar. I synnerhet, om det finns en mutation i en DNA-reparationsgen i en könscell, kan människor som bär sådana könslinjemutationer ha en ökad risk för cancer. En lista över 34 sådana könscellsmutationer ges i artikeln DNA-reparationsbriststörning . Ett exempel på en är albinism , en mutation som förekommer i OCA1- eller OCA2-genen. Individer med denna sjukdom är mer benägna att drabbas av många typer av cancer, andra störningar och har nedsatt syn.
DNA-skada kan orsaka ett fel när DNA:t replikeras, och detta replikationsfel kan orsaka en genmutation som i sin tur kan orsaka en genetisk störning. DNA-skador repareras av cellens DNA-reparationssystem. Varje cell har ett antal vägar genom vilka enzymer känner igen och reparerar skador i DNA. Eftersom DNA kan skadas på många sätt, är processen för DNA-reparation ett viktigt sätt på vilket kroppen skyddar sig mot sjukdomar. När DNA-skadan har gett upphov till en mutation kan mutationen inte repareras.
Roll i karcinogenesen
Å andra sidan kan en mutation inträffa i en somatisk cell i en organism. Sådana mutationer kommer att finnas i alla avkomlingar till denna cell inom samma organism. Ackumuleringen av vissa mutationer under generationer av somatiska celler är en del av orsaken till malign transformation , från normal cell till cancercell.
Celler med heterozygota mutationer med förlust av funktion (en bra kopia av genen och en muterad kopia) kan fungera normalt med den omuterade kopian tills den goda kopian spontant har muterats somatiskt. Denna typ av mutation sker ofta i levande organismer, men det är svårt att mäta hastigheten. Att mäta denna hastighet är viktigt för att förutsäga i vilken takt människor kan utveckla cancer.
Punktmutationer kan uppstå från spontana mutationer som uppstår under DNA-replikation. Mutationshastigheten kan ökas av mutagener. Mutagener kan vara fysiska, såsom strålning från UV-strålar , röntgenstrålar eller extrem värme, eller kemiska (molekyler som tar bort baspar eller stör den spiralformade DNA-formen). Mutagener associerade med cancer studeras ofta för att lära sig om cancer och dess förebyggande.
Prionmutationer
Prioner är proteiner och innehåller inget genetiskt material. Men prionreplikation har visat sig vara föremål för mutation och naturligt urval precis som andra former av replikation. Den mänskliga genen PRNP kodar för det stora prionproteinet, PrP, och är föremål för mutationer som kan ge upphov till sjukdomsframkallande prioner.
Nyttiga mutationer
Även om mutationer som orsakar förändringar i proteinsekvenser kan vara skadliga för en organism, kan effekten ibland vara positiv i en given miljö. I detta fall kan mutationen göra det möjligt för den muterade organismen att motstå speciella miljöpåfrestningar bättre än vildtypsorganismer, eller föröka sig snabbare. I dessa fall tenderar en mutation att bli vanligare i en population genom naturligt urval. Exempel inkluderar följande:
HIV-resistens : en specifik 32 baspar deletion i human CCR5 ( CCR5-Δ32 ) ger HIV- resistens till homozygoter och fördröjer AIDS -debut hos heterozygoter. En möjlig förklaring till etiologin för den relativt höga frekvensen av CCR5-Δ32 i den europeiska befolkningen är att den gav resistens mot böldpest i mitten av 1300-talets Europa . Personer med denna mutation var mer benägna att överleva infektion; sålunda ökade dess frekvens i befolkningen. Denna teori kan förklara varför denna mutation inte finns i södra Afrika , som förblev orörd av böldpest. En nyare teori tyder på att det selektiva trycket på CCR5 Delta 32-mutationen orsakades av smittkoppor istället för böldpest.
Malariaresistens : Ett exempel på en skadlig mutation är sickle-cell disease , en blodsjukdom där kroppen producerar en onormal typ av det syrebärande ämnet hemoglobin i de röda blodkropparna . En tredjedel av alla inhemska invånare i Afrika söder om Sahara bär på allelen, eftersom det i områden där malaria är vanligt finns ett överlevnadsvärde i att bara bära en enskild sicklecell-allel ( sicklecell-egenskap) . De med endast en av de två allelerna av sicklecellssjukdomen är mer resistenta mot malaria, eftersom angreppet av malaria Plasmodium stoppas av sickling av cellerna som den angriper.
Antibiotikaresistens : Praktiskt taget alla bakterier utvecklar antibiotikaresistens när de utsätts för antibiotika. Faktum är att bakteriepopulationer redan har sådana mutationer som väljs ut under antibiotikaselektion. Uppenbarligen är sådana mutationer bara fördelaktiga för bakterierna men inte för de infekterade.
Laktas persistens . En mutation gjorde det möjligt för människor att uttrycka enzymet laktas efter att de naturligt avvänjts från bröstmjölk, vilket gör att vuxna kan smälta laktos , vilket troligen är en av de mest fördelaktiga mutationerna i den senaste mänskliga evolutionen .
Kompenserade patogena avvikelser
Kompenserade patogena avvikelser avser aminosyrarester i en proteinsekvens som är patogena i en art men är vildtypsrester i det funktionellt ekvivalenta proteinet i en annan art. Även om aminosyraresten är patogen i den första arten, är den inte så i den andra arten eftersom dess patogenicitet kompenseras av en eller flera aminosyrasubstitutioner i den andra arten. Den kompensatoriska mutationen kan ske i samma protein eller i ett annat protein som det interagerar med.
Det är viktigt att förstå effekterna av kompensatoriska mutationer i samband med fixerade skadliga mutationer på grund av att befolkningens kondition minskar på grund av fixering. Effektiv populationsstorlek avser en population som reproducerar sig. En ökning av denna populationsstorlek har korrelerats med en minskad grad av genetisk mångfald. Positionen för en population i förhållande till den kritiska effekten på populationsstorleken är väsentlig för att bestämma vilken effekt skadliga alleler kommer att ha på konditionen. Om populationen är under den kritiska effektiva storleken kommer konditionen att minska drastiskt, men om populationen är över den kritiska effektstorleken kan konditionen öka oavsett skadliga mutationer på grund av kompenserande alleler.
Kompensatoriska mutationer i RNA
Eftersom funktionen hos en RNA-molekyl är beroende av dess struktur, är strukturen hos RNA-molekyler evolutionärt bevarad. Därför måste varje mutation som förändrar den stabila strukturen hos RNA-molekyler kompenseras av andra kompensatoriska mutationer. I RNA-sammanhang kan RNA-sekvensen betraktas som "genotyp" och strukturen av RNA:n kan betraktas som dess "fenotyp". Eftersom RNA har relativt enklare sammansättning än proteiner, kan strukturen av RNA-molekyler beräkningsmässigt förutsägas med hög grad av noggrannhet. På grund av denna bekvämlighet har kompensatoriska mutationer studerats i beräkningssimuleringar med RNA-vikningsalgoritmer.
Evolutionär kompensationsmekanism
Kompensatoriska mutationer kan förklaras av det genetiska fenomenet epistasis, varvid den fenotypiska effekten av en mutation är beroende av mutation(er) på andra loci. Medan epistas ursprungligen uppfattades i samband med interaktion mellan olika gener, har intragen epistas också studerats nyligen. Förekomsten av kompenserade patogena avvikelser kan förklaras med "teckenepistas", där effekterna av en skadlig mutation kan kompenseras av närvaron av en epistatisk mutation i andra loci. För ett givet protein kan en skadlig mutation (D) och en kompensatorisk mutation (C) övervägas, där C kan vara i samma protein som D eller i ett annat interagerande protein beroende på sammanhanget. Konditionseffekten av C i sig kan vara neutral eller något skadlig så att den fortfarande kan existera i befolkningen, och effekten av D är skadlig till den grad att den inte kan existera i befolkningen. Men när C och D uppträder samtidigt blir den kombinerade fitnesseffekten neutral eller positiv. Således kan kompensatoriska mutationer tillföra nyhet till proteiner genom att skapa nya vägar för proteinevolution: det tillåter individer att resa från en konditionstopp till en annan genom dalarna med lägre kondition.
DePristo et al. 2005 skisserade två modeller för att förklara dynamiken i kompenserande patogena avvikelser (CPD). I den första hypotesen är P en patogen aminosyramutation som och C är en neutral kompensatorisk mutation. Under dessa förhållanden, om den patogena mutationen uppstår efter en kompensatorisk mutation, kan P fixeras i populationen. Den andra modellen av CPD säger att P och C båda är skadliga mutationer som resulterar i fitnessdalar när mutationer inträffar samtidigt. Med hjälp av allmänt tillgängliga, Ferrer-Costa et al. 2007 erhöll kompensatoriska mutationer och humana patogena mutationsdatauppsättningar som karakteriserades för att bestämma vad som orsakar CPD. Resultaten indikerar att de strukturella begränsningarna och platsen i proteinstrukturen avgör om kompenserade mutationer kommer att inträffa.
Experimentella bevis på kompensatoriska mutationer
Experiment med bakterier
Lunzer et al. testade resultatet av att byta divergerande aminosyror mellan två ortologa proteiner av isopropymalatdehydrogenas (IMDH). De ersatte 168 aminosyror i Escherichia coli IMDH som är vildtypsrester i IMDH Pseudomonas aeruginosa . De fann att över en tredjedel av dessa substitutioner äventyrade IMDH-enzymatisk aktivitet i den genetiska bakgrunden av Escherichia coli . Detta visade att identiska aminosyratillstånd kan resultera i olika fenotypiska tillstånd beroende på den genetiska bakgrunden. Corrigan et al. 2011 visade hur Staphylococcus aureus kunde växa normalt utan närvaro av lipoteichoic syra på grund av kompensatoriska mutationer. Helgenomsekvenseringsresultat avslöjade att när Cyclic-di-AMP fosfodiesteras (GdpP) stördes i denna bakterie, kompenserade det för försvinnandet av cellväggspolymeren, vilket resulterade i normal celltillväxt.
Forskning har visat att bakterier kan få läkemedelsresistens genom kompenserande mutationer som inte hindrar eller har liten effekt på konditionen. Tidigare forskning från Gagneux et al. 2006 har funnit att laboratorieodlade M. tuberculosis-stammar med rifampicinresistens har minskat konditionen, men läkemedelsresistenta kliniska stammar av denna patogena bakterie har inte nedsatt kondition. Comas et al. 2012 använde jämförelser av hela genomet mellan kliniska stammar och labbhärledda mutanter för att bestämma rollen och bidraget av kompensatoriska mutationer i läkemedelsresistens mot rifampicin. Genomanalys visar att rifampicinresistenta stammar har en mutation i rpoA och rpoC. En liknande studie undersökte den bakteriella konditionen associerad med kompensatoriska mutationer i rifampinresistenta Escherichia coli. Resultat från denna studie visar att läkemedelsresistens är kopplat till bakteriell kondition eftersom högre träningskostnader är kopplade till större transkriptionsfel.
Experimentera med virus
Gong et al. samlade erhållna genotypdata för influensanukleoprotein från olika tidslinjer och ordnade dem temporärt efter deras ursprungstid. Sedan isolerade de 39 aminosyrasubstitutioner som inträffade i olika tidslinjer och ersatte dem i en genetisk bakgrund som närmade sig den förfäders genotyp. De fann att 3 av de 39 substitutionerna avsevärt minskade konditionen hos den förfäders bakgrund. Kompensatoriska mutationer är nya mutationer som uppstår och har en positiv eller neutral inverkan på en populations kondition. Tidigare forskning har visat att populationer har kan kompensera skadliga mutationer. Burch och Chao testade Fishers geometriska modell av adaptiv evolution genom att testa om bakteriofag φ6 utvecklas med små steg. Deras resultat visade att bakteriofag φ6 kondition minskade snabbt och återhämtade sig i små steg. Virala nukleoproteiner har visat sig undvika cytotoxiska T-lymfocyter (CTL) genom arginin-till glycin-substitutioner. Dessa substitutionsmutationer påverkar konditionen hos virala nukleoproteiner, men kompenserande sammutationer hindrar konditionsminskningar och hjälper viruset att undvika igenkänning från CTL. Mutationer kan ha tre olika effekter; mutationer kan ha skadliga effekter, vissa ökar konditionen genom kompensatoriska mutationer, och slutligen kan mutationer vara motviktande vilket resulterar i kompenserande neutrala mutationer.
Historia

Mutationism är ett av flera alternativ till darwinistisk evolution som har funnits både före och efter publiceringen av Charles Darwins bok från 1859, On the Origin of Species . I teorin var mutation källan till nyhet, skapade nya former och nya arter , potentiellt omedelbart, i ett plötsligt hopp. Detta ansågs driva evolutionen, som begränsades av tillgången på mutationer.
Före Darwin trodde biologer vanligen på saltationism , möjligheten till stora evolutionära hopp, inklusive omedelbar artbildning . Till exempel, 1822 Étienne Geoffroy Saint-Hilaire att arter kunde bildas genom plötsliga transformationer, eller vad som senare skulle kallas makromutation. Darwin motsatte sig saltning och insisterade på gradualism i evolution som i geologi . 1864 Albert von Kölliker Geoffroys teori. År 1901 genetikern Hugo de Vries namnet "mutation" till till synes nya former som plötsligt uppstod i hans experiment på nattljussöna Oenothera lamarckiana , och under 1900-talets första decennium, mutationism, eller som de Vries kallade det mutationsteori , blev en rival till darwinismen stödd ett tag av genetiker inklusive William Bateson , Thomas Hunt Morgan och Reginald Punnett .
Förståelsen för mutationism fördunklas av mitten av 1900-talets skildring av de tidiga mutationisterna av anhängare av den moderna syntesen som motståndare till darwinistisk evolution och rivaler till den biometriska skolan som hävdade att urvalet fungerade på kontinuerlig variation. I denna skildring besegrades mutationismen av en syntes av genetik och naturligt urval som förmodligen startade senare, runt 1918, med arbete av matematikern Ronald Fisher . Men anpassningen av Mendelsk genetik och naturligt urval började redan 1902 med en artikel av Udny Yule , och byggdes upp med teoretiskt och experimentellt arbete i Europa och Amerika. Trots kontroversen hade de tidiga mutationisterna redan 1918 accepterat naturligt urval och förklarat kontinuerlig variation som ett resultat av flera gener som verkar på samma egenskap, såsom höjd.
Mutationism, tillsammans med andra alternativ till darwinism som lamarckism och ortogenes , förkastades av de flesta biologer när de kom att inse att mendelsk genetik och naturligt urval lätt kunde samverka; mutation tog dess plats som en källa till den genetiska variation som är nödvändig för att naturligt urval ska kunna arbeta på. Men mutationismen försvann inte helt. År 1940 Richard Goldschmidt återigen för enstegsspeciering genom makromutation, och beskrev de organismer som på så sätt producerades som "hoppfulla monster", vilket tjänade till utbredd förlöjligande. 1987 Masatoshi Nei kontroversiellt att evolutionen ofta var mutationsbegränsad. Moderna biologer som Douglas J. Futuyma drar slutsatsen att i stort sett alla påståenden om evolution som drivs av stora mutationer kan förklaras av darwinistisk evolution.
Se även
externa länkar
- Jones S , Woolfson A, Partridge L (6 december 2007). "Genetisk mutation" . I vår tid . BBC Radio 4 . Hämtad 18 oktober 2015 .
- Liou S (5 februari 2011). "Allt om mutationer" . HOPPAS . Huntington's Disease Outreach Project for Education i Stanford . Hämtad 18 oktober 2015 .
- "Locusspecifika mutationsdatabaser" . Leiden, Nederländerna: Leiden University Medical Center . Hämtad 18 oktober 2015 .
- "Välkommen till Mutalyzers webbplats" . Leiden, Nederländerna: Leiden University Medical Center . Hämtad 18 oktober 2015 . – Mutalyzers webbplats.