Virus

|
|
| Virus | |
|---|---|
| SARS-CoV-2 , en medlem av underfamiljen Coronavirinae | |
| Virusklassificering | |
| (orankad): | Virus |
| Realms | |
Ett virus är ett submikroskopiskt smittämne som replikerar endast inuti en organisms levande celler . Virus infekterar alla livsformer , från djur och växter till mikroorganismer , inklusive bakterier och arkéer . Sedan Dmitri Ivanovskys artikel från 1892 som beskriver en icke-bakteriell patogen som infekterar tobaksväxter och upptäckten av tobaksmosaikviruset av Martinus Beijerinck 1898, har mer än 9 000 av miljontals virusarter beskrivits i detalj. Virus finns i nästan alla ekosystem på jorden och är den mest talrika typen av biologiska enheter. Studiet av virus är känt som virologi , en subspecialitet inom mikrobiologi .
När en värdcell är infekterad tvingas den ofta snabbt producera tusentals kopior av det ursprungliga viruset. När de inte är inne i en infekterad cell eller håller på att infektera en cell, existerar virus i form av oberoende viruspartiklar, eller virioner , bestående av (i) det genetiska materialet , dvs långa DNA- eller RNA - molekyler som kodar för strukturen av proteinerna genom vilka viruset verkar; (ii) ett proteinhölje , kapsiden , som omger och skyddar det genetiska materialet; och i vissa fall (iii) ett yttre hölje av lipider . Formerna på dessa viruspartiklar sträcker sig från enkla spiralformade och ikosaedriska former till mer komplexa strukturer. De flesta virusarter har virioner för små för att kunna ses med ett optiskt mikroskop och är en hundradel så stora som de flesta bakterier.
Ursprunget till virus i livets evolutionära historia är oklara: vissa kan ha utvecklats från plasmider - bitar av DNA som kan röra sig mellan celler - medan andra kan ha utvecklats från bakterier. I evolutionen är virus ett viktigt medel för horisontell genöverföring , vilket ökar den genetiska mångfalden på ett sätt som är analogt med sexuell reproduktion . Virus anses av vissa biologer vara en livsform, eftersom de bär genetiskt material, reproducerar sig och utvecklas genom naturligt urval , även om de saknar nyckelegenskaperna, såsom cellstruktur, som allmänt anses vara nödvändiga kriterier för att definiera liv . Eftersom de besitter vissa men inte alla sådana egenskaper, har virus beskrivits som "organismer på kanten av livet" och som replikatorer .
Virus sprids på många sätt. En överföringsväg är genom sjukdomsbärande organismer som kallas vektorer : till exempel överförs virus ofta från växt till växt av insekter som livnär sig på växtsaft , såsom bladlöss ; och virus hos djur kan bäras av blodsugande insekter. Många virus, inklusive influensavirus , SARS-CoV-2 , vattkoppor , smittkoppor och mässling , sprids i luften genom hosta och nysningar. Norovirus och rotavirus , vanliga orsaker till viral gastroenterit , överförs via fekal-oral väg , passerar genom hand-till-mun-kontakt eller i mat eller vatten. Den infektionsdos av norovirus som krävs för att producera infektion hos människor är färre än 100 partiklar. HIV är ett av flera virus som överförs genom sexuell kontakt och genom exponering för infekterat blod. Variationen av värdceller som ett virus kan infektera kallas dess värdområde . Detta kan vara smalt, vilket betyder att ett virus kan infektera få arter, eller brett, vilket betyder att det kan infektera många.
Virusinfektioner hos djur framkallar ett immunsvar som vanligtvis eliminerar det infekterande viruset. Immunsvar kan också produceras av vacciner , som ger en artificiellt förvärvad immunitet mot den specifika virusinfektionen. Vissa virus, inklusive de som orsakar HIV/AIDS , HPV-infektion och viral hepatit , undviker dessa immunsvar och resulterar i kroniska infektioner. Flera klasser av antivirala läkemedel har utvecklats.
Etymologi
Ordet kommer från latinets neutrum virus som syftar på gift och andra skadliga vätskor, från samma indoeuropeiska bas som sanskrit viṣa , avestan vīša och antika grekiska ἰός (allt betyder "gift"), först intygad på engelska 1398 i John Trevisas översättning av Bartholomeus Anglicus De Proprietatibus Rerum . Virulent , från latin virulentus ('giftig'), dateras till ca. 1400. En betydelse av 'agens som orsakar infektionssjukdomar' registrerades första gången 1728, långt före upptäckten av virus av Dmitri Ivanovsky 1892. Den engelska pluralen är viruses (ibland också vira ), medan det latinska ordet är ett masssubstantiv , som inte har någon klassiskt bestyrkt plural ( vīra används i nylatin ). Adjektivet viral dateras till 1948. Termen virion (plural virions ), som är från 1959, används också för att hänvisa till en enda viral partikel som frigörs från cellen och kan infektera andra celler av samma typ.
Ursprung
Virus finns varhelst det finns liv och har förmodligen funnits sedan levande celler först utvecklades. Ursprunget till virus är oklart eftersom de inte bildar fossiler, så molekylära tekniker används för att undersöka hur de uppstod. Dessutom integreras viralt genetiskt material ibland i värdorganismernas könslinje , genom vilket de kan överföras vertikalt till värdens avkomma i många generationer. Detta ger en ovärderlig informationskälla för paleovirologer att spåra gamla virus som har funnits för upp till miljoner år sedan. Det finns tre huvudhypoteser som syftar till att förklara ursprunget till virus:
- Regressiv hypotes
- Virus kan en gång ha varit små celler som parasiterade större celler. Med tiden gick gener som inte krävdes av deras parasitism förlorade. Bakterierna rickettsia och klamydia är levande celler som, precis som virus, bara kan föröka sig inuti värdceller. De ger stöd till denna hypotes, eftersom deras beroende av parasitism sannolikt har orsakat förlusten av gener som gjorde det möjligt för dem att överleva utanför en cell. Detta kallas också "degenerationshypotesen", eller "reduktionshypotesen".
- Hypotes om cellulärt ursprung
- Vissa virus kan ha utvecklats från bitar av DNA eller RNA som "rymt" från generna hos en större organism. Det förrymda DNA:t kan ha kommit från plasmider (bitar av naket DNA som kan röra sig mellan celler) eller transposoner (molekyler av DNA som replikerar och rör sig runt till olika positioner i cellens gener). En gång kallade hoppgener , transposoner är exempel på mobila genetiska element och kan vara ursprunget till vissa virus. De upptäcktes i majs av Barbara McClintock 1950. Detta kallas ibland "vagrancy-hypotesen", eller "flykthypotesen".
- Samevolutionshypotes
- Detta kallas också "virus-första hypotesen" och föreslår att virus kan ha utvecklats från komplexa molekyler av protein och nukleinsyra samtidigt som celler först dök upp på jorden och skulle ha varit beroende av cellulärt liv i miljarder år. Viroider är molekyler av RNA som inte klassificeras som virus eftersom de saknar proteinhölje. De har egenskaper som är gemensamma för flera virus och kallas ofta subvirala medel . Viroider är viktiga patogener hos växter. De kodar inte för proteiner utan interagerar med värdcellen och använder värdmaskineriet för sin replikering. hepatit delta-virus har ett RNA- genom som liknar viroider men har en proteinhölje som härrör från hepatit B-virus och kan inte producera ett eget. Det är därför ett defekt virus. Även om hepatit delta-virusgenomet kan replikera oberoende en gång inuti en värdcell, kräver det hjälp av hepatit B-virus för att tillhandahålla ett proteinhölje så att det kan överföras till nya celler. På liknande sätt sputnikvirofagen beroende av mimivirus , som infekterar protozoen Acanthamoeba castellanii . Dessa virus, som är beroende av närvaron av andra virusarter i värdcellen, kallas " satelliter " och kan representera evolutionära mellanprodukter av viroider och virus.
Tidigare fanns det problem med alla dessa hypoteser: den regressiva hypotesen förklarade inte varför inte ens de minsta av cellparasiter liknar virus på något sätt. Rymningshypotesen förklarade inte de komplexa kapsiderna och andra strukturer på viruspartiklar. Virus-första hypotesen stred mot definitionen av virus genom att de kräver värdceller. Virus är nu erkända som uråldriga och som har ett ursprung som föregår livets divergens i de tre domänerna . Denna upptäckt har fått moderna virologer att ompröva och omvärdera dessa tre klassiska hypoteser.
Bevisen för en förfäders värld av RNA- celler och datoranalys av virus- och värd-DNA-sekvenser ger en bättre förståelse av de evolutionära förhållandena mellan olika virus och kan hjälpa till att identifiera förfäderna till moderna virus. Hittills har sådana analyser inte visat vilken av dessa hypoteser som är korrekta. Det verkar osannolikt att alla för närvarande kända virus har en gemensam förfader, och virus har förmodligen uppstått flera gånger tidigare genom en eller flera mekanismer.
Mikrobiologi
Livsegenskaper
Vetenskapliga åsikter går isär om huruvida virus är en form av liv eller organiska strukturer som interagerar med levande organismer. De har beskrivits som "organismer på kanten av liv", eftersom de liknar organismer genom att de besitter gener , utvecklas genom naturligt urval och reproducerar genom att skapa flera kopior av sig själva genom självmontering. Även om de har gener har de ingen cellstruktur, vilket ofta ses som livets grundläggande enhet. Virus har ingen egen ämnesomsättning och kräver en värdcell för att göra nya produkter. De kan därför inte naturligt reproducera sig utanför en värdcell – även om vissa bakterier som rickettsia och klamydia anses vara levande organismer trots samma begränsning. Accepterade livsformer använder celldelning för att reproducera sig, medan virus spontant samlas i celler. De skiljer sig från autonom tillväxt av kristaller eftersom de ärver genetiska mutationer samtidigt som de är föremål för naturligt urval. Självsammansättning av virus i värdceller har implikationer för studiet av livets ursprung , eftersom det ger ytterligare trovärdighet till hypotesen att livet kunde ha börjat som självmonterande organiska molekyler .
Strukturera
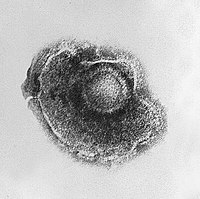
Virus uppvisar en stor mångfald av storlekar och former, så kallade " morfologier ". I allmänhet är virus mycket mindre än bakterier och mer än tusen bakteriofagvirus skulle passa in i en Escherichia coli- bakteries cell. Många virus som har studerats är sfäriska och har en diameter mellan 20 och 300 nanometer . Vissa filovirus , som är filament, har en total längd på upp till 1400 nm; deras diametrar är endast cirka 80 nm. De flesta virus kan inte ses med ett optiskt mikroskop , så skannings- och transmissionselektronmikroskop används för att visualisera dem. För att öka kontrasten mellan virus och bakgrunden används elektrontäta "fläckar". Dessa är lösningar av salter av tungmetaller, såsom volfram , som sprider elektronerna från områden täckta med fläcken. När virioner är belagda med fläckar (positiv färgning) döljs fina detaljer. Negativ färgning övervinner detta problem genom att endast färga bakgrunden.
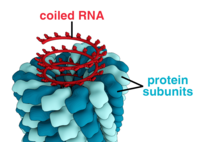
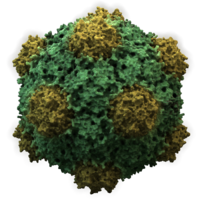
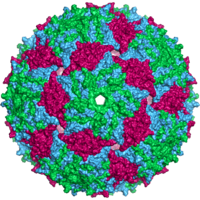
En komplett viruspartikel, känd som en virion , består av nukleinsyra omgiven av ett skyddande proteinskikt som kallas en kapsid . Dessa bildas av proteinsubenheter som kallas kapsomerer . Virus kan ha ett lipidhölje " som härrör från värdcellmembranet . Kapsiden är gjord av proteiner som kodas av det virala genomet och dess form fungerar som grund för morfologisk distinktion. Viralt kodade proteinsubenheter kommer att självmontera för att bilda en kapsid, vilket i allmänhet kräver närvaron av virusgenomet. Komplexa virus kodar för proteiner som hjälper till att bygga deras kapsid. Proteiner associerade med nukleinsyra är kända som nukleoproteiner , och associeringen av virala kapsidproteiner med viral nukleinsyra kallas nukleokapsid. Kapsiden och hela virusstrukturen kan undersökas mekaniskt (fysiskt) genom atomkraftsmikroskopi . I allmänhet finns det fem huvudsakliga morfologiska virustyper:
- Helical
- Dessa virus är sammansatta av en enda typ av kapsomer staplade runt en central axel för att bilda en spiralformad struktur, som kan ha en central hålighet eller ett rör. Detta arrangemang resulterar i virioner som kan vara korta och mycket styva stavar, eller långa och mycket flexibla filament. Det genetiska materialet (typiskt enkelsträngat RNA, men enkelsträngat DNA i vissa fall) binds in i proteinspiralen genom interaktioner mellan den negativt laddade nukleinsyran och positiva laddningar på proteinet. Totalt sett är längden av en spiralformad kapsid relaterad till längden av nukleinsyran som finns i den, och diametern är beroende av storleken och arrangemanget av kapsomerer. Det väl studerade tobaksmosaikviruset och inoviruset är exempel på spiralformade virus.
- Ikosaedriska
- De flesta djurvirus är ikosaedriska eller nästan sfäriska med kiral ikosaedrisk symmetri . En vanlig ikosaeder är det optimala sättet att bilda ett slutet skal från identiska underenheter. Det minsta antalet kapsomerer som krävs för varje triangulär yta är 3, vilket ger 60 för ikosaedern. Många virus, som rotavirus, har mer än 60 kapsomerer och verkar sfäriska men de behåller denna symmetri. För att uppnå detta är kapsomererna vid topparna omgivna av fem andra kapsomerer och kallas pentoner. Capsomerer på de triangulära ytorna är omgivna av sex andra och kallas hexoner . Hexoner är i huvudsak platta och pentoner, som bildar de 12 hörnen, är krökta. Samma protein kan fungera som underenheten för både pentamererna och hexamererna eller så kan de vara sammansatta av olika proteiner.
- Prolat
- Detta är en ikosaeder som är förlängd längs den femfaldiga axeln och är ett vanligt arrangemang av bakteriofagers huvuden. Denna struktur består av en cylinder med ett lock i vardera änden.
- Enveloped
- Vissa arter av virus omsluter sig själva i en modifierad form av ett av cellmembranen , antingen det yttre membranet som omger en infekterad värdcell eller interna membran såsom ett kärnmembran eller endoplasmatiskt retikulum , och får på så sätt ett yttre lipiddubbelskikt känt som ett viralt hölje . . Detta membran är översållat med proteiner som kodas för av det virala genomet och värdgenomet; själva lipidmembranet och eventuella närvarande kolhydrater kommer helt och hållet från värden. Influensavirus , HIV (som orsakar AIDS ) och allvarligt akut respiratoriskt syndrom coronavirus 2 (som orsakar COVID-19 ) använder denna strategi. De flesta höljeförsedda virus är beroende av höljet för sin smittsamhet.
- Komplex
- Dessa virus har en kapsid som varken är helt spiralformad eller rent icosaedrisk, och som kan ha extra strukturer som proteinsvansar eller en komplex yttervägg. Vissa bakteriofager, såsom Enterobacteria fag T4 , har en komplex struktur som består av ett icosaedriskt huvud bundet till en spiralformad svans, som kan ha en hexagonal basplatta med utskjutande proteinsvansfibrer. Denna svansstruktur fungerar som en molekylär spruta, fäster vid bakterievärden och injicerar sedan virusgenomet i cellen.
Poxvirusen är stora, komplexa virus som har en ovanlig morfologi . Det virala genomet är associerat med proteiner inom en central skivstruktur som kallas en nukleoid . Nukleoiden är omgiven av ett membran och två laterala kroppar med okänd funktion. Viruset har ett yttre hölje med ett tjockt lager av protein översatt över ytan. Hela virionen är något pleomorf , allt från äggformad till tegelformad.
Jättevirus
Mimivirus är ett av de största karakteriserade virusen, med en kapsiddiameter på 400 nm. Proteinfilament som mäter 100 nm sticker ut från ytan. Kapsiden verkar hexagonal under ett elektronmikroskop, därför är kapsiden troligen ikosaedrisk. År 2011 upptäckte forskare det största då kända viruset i vattenprover som samlats in från havsbotten utanför kusten i Las Cruces, Chile. Det provisoriskt namngivna Megavirus chilensis , kan ses med ett grundläggande optiskt mikroskop. 2013 upptäcktes släktet Pandoravirus i Chile och Australien och har genom ungefär dubbelt så stort som Megavirus och Mimivirus. Alla jättevirus har dsDNA-genom och de klassificeras i flera familjer: Mimiviridae , Pithoviridae, Pandoraviridae , Phycodnaviridae och Mollivirus - släktet.
Vissa virus som infekterar Archaea har komplexa strukturer som inte är relaterade till någon annan form av virus, med en mängd olika ovanliga former, allt från spindelformade strukturer till virus som liknar krokade stavar, tårar eller till och med flaskor. Andra arkeala virus liknar svansbakteriofager och kan ha flera svansstrukturer.
Genom
| Fast egendom | Parametrar |
|---|---|
| Nukleinsyra |
|
| Form |
|
| Strandning |
|
| Känsla |
|
En enorm variation av genomiska strukturer kan ses bland virala arter ; som en grupp innehåller de mer strukturell genomisk mångfald än växter, djur, arkéer eller bakterier. Det finns miljontals olika typer av virus, även om färre än 7 000 typer har beskrivits i detalj. Från och med januari 2021 NCBI Virus-genomdatabasen mer än 193 000 kompletta genomsekvenser, men det finns utan tvekan många fler att upptäcka.
Ett virus har antingen ett DNA- eller ett RNA- genom och kallas ett DNA-virus respektive ett RNA-virus . De allra flesta virus har RNA-genom. Växtvirus tenderar att ha enkelsträngade RNA-genom och bakteriofager tenderar att ha dubbelsträngade DNA-genom.
Virala genom är cirkulära, som i polyomavirusen , eller linjära, som i adenovirusen . Typen av nukleinsyra är irrelevant för genomets form. Bland RNA-virus och vissa DNA-virus delas arvsmassan ofta upp i separata delar, då kallas det segmenterat. För RNA-virus kodar varje segment ofta för endast ett protein och de finns vanligtvis tillsammans i en kapsid. Alla segment behöver inte vara i samma virion för att viruset ska vara smittsamt, vilket framgår av brommosaikvirus och flera andra växtvirus.
Ett viralt genom, oavsett nukleinsyratyp, är nästan alltid antingen enkelsträngat (ss) eller dubbelsträngat (ds). Enkelsträngade genom består av en oparad nukleinsyra, analogt med hälften av en stege delad på mitten. Dubbelsträngade genom består av två komplementära parade nukleinsyror, analogt med en stege. Viruspartiklarna i vissa virusfamiljer, såsom de som tillhör Hepadnaviridae , innehåller ett genom som är delvis dubbelsträngat och delvis enkelsträngat.
För de flesta virus med RNA-genom och vissa med enkelsträngade DNA (ssDNA)-genom, sägs de enkla strängarna vara antingen positiv känsla (kallad 'plus-sträng') eller negativ känsla (kallad 'minus-sträng') ), beroende på om de är komplementära till det virala budbärar-RNA (mRNA). Positivt-sens viralt RNA är i samma mening som viralt mRNA och därför kan åtminstone en del av det omedelbart översättas av värdcellen. Negativt-sens viralt RNA är komplementärt till mRNA och måste därför omvandlas till positiv-sens-RNA av ett RNA-beroende RNA-polymeras före translation. DNA-nomenklaturen för virus med genomiskt ssDNA liknar RNA-nomenklaturen, genom att positiv-strängad viral ssDNA är identisk i sekvens med det virala mRNA:t och är således en kodande sträng, medan negativ-sens viralt ssDNA är komplementärt till det virala mRNA:t och är således en mallsträng. Flera typer av ssDNA- och ssRNA-virus har genom som är ambisense genom att transkription kan ske från båda strängarna i en dubbelsträngad replikativ mellanprodukt. Exempel inkluderar geminivirus , som är ssDNA-växtvirus och arenavirus , som är ssRNA-virus från djur.
Genomstorlek
Genomstorleken varierar mycket mellan arterna. De minsta — ssDNA-cirkovirusen, familjen Circoviridae — kodar endast för två proteiner och har en genomstorlek på endast två kilobaser; de största - pandoravirusen - har genomstorlekar på cirka två megabaser som kodar för cirka 2500 proteiner. Virusgener har sällan introner och är ofta ordnade i genomet så att de överlappar varandra .
I allmänhet har RNA-virus mindre genomstorlekar än DNA-virus på grund av en högre felfrekvens vid replikering och har en maximal övre storleksgräns. Utöver detta gör fel vid replikering viruset värdelöst eller okonkurrenskraftigt. För att kompensera har RNA-virus ofta segmenterade genom – genomet är uppdelat i mindre molekyler – vilket minskar risken för att ett fel i ett enkomponentgenom kommer att göra hela genomet oförmöget. Däremot har DNA-virus i allmänhet större genom på grund av den höga troheten hos deras replikationsenzymer. Enkelsträngade DNA-virus är ett undantag från denna regel, eftersom mutationshastigheter för dessa genom kan närma sig det yttersta av fallet med ssRNA-virus.
Genetisk mutation och rekombination

Virus genomgår genetisk förändring genom flera mekanismer. Dessa inkluderar en process som kallas antigen drift där enskilda baser i DNA eller RNA muterar till andra baser. De flesta av dessa punktmutationer är "tysta" - de ändrar inte proteinet som genen kodar för - men andra kan ge evolutionära fördelar som resistens mot antivirala läkemedel . Antigenförskjutning inträffar när det finns en stor förändring i virusets genom. Detta kan vara ett resultat av rekombination eller omsortiment . När detta händer med influensavirus kan pandemier uppstå. RNA-virus existerar ofta som kvasiarter eller svärmar av virus av samma art men med något olika genomets nukleosidsekvenser. Sådana kvasiarter är ett främsta mål för naturligt urval.
Segmenterade genom ger evolutionära fördelar; olika stammar av ett virus med ett segmenterat genom kan blanda och kombinera gener och producera avkommavirus (eller avkomma) som har unika egenskaper. Detta kallas omsortiment eller "viralt sex".
Genetisk rekombination är en process genom vilken en sträng av DNA (eller RNA) bryts och sedan förenas med änden av en annan DNA (eller RNA) molekyl. Detta kan inträffa när virus infekterar celler samtidigt och studier av viral utveckling har visat att rekombination har varit utbredd i den studerade arten. Rekombination är gemensam för både RNA- och DNA-virus.
Coronavirus har ett enkelsträngat positiv-sens RNA- genom . Replikation av genomet katalyseras av ett RNA-beroende RNA-polymeras . Mekanismen för rekombination som används av koronavirus involverar sannolikt mallbyte av polymeraset under genomreplikering. Denna process verkar vara en anpassning för att klara av genomskador.
Replikeringscykel

Viruspopulationer växer inte genom celldelning, eftersom de är acellulära. Istället använder de en värdcells maskineri och ämnesomsättning för att producera flera kopior av sig själva, och de sätts ihop i cellen. När den är infekterad tvingas värdcellen att snabbt producera tusentals kopior av det ursprungliga viruset.
Deras livscykel skiljer sig mycket mellan arter, men det finns sex grundläggande stadier i deras livscykel:
Vidhäftning är en specifik bindning mellan virala kapsidproteiner och specifika receptorer på värdcellytan. Denna specificitet bestämmer värdområdet och typen av värdcell för ett virus. Till exempel infekterar HIV ett begränsat antal humana leukocyter . Detta beror på att dess ytprotein, gp120 , specifikt interagerar med CD4- molekylen - en kemokinreceptor - som oftast finns på ytan av CD4+ T-celler . Denna mekanism har utvecklats för att gynna de virus som endast infekterar celler där de kan replikeras. Vidfästning till receptorn kan inducera det virala höljesproteinet att genomgå förändringar som resulterar i sammansmältning av virala och cellulära membran, eller förändringar av icke-höljeförsedda virusytproteiner som tillåter viruset att komma in.
Penetration eller viral inträngning följer fastsättning: Virioner kommer in i värdcellen genom receptormedierad endocytos eller membranfusion . Infektionen av växt- och svampceller skiljer sig från den hos djurceller. Växter har en stel cellvägg gjord av cellulosa , och svampar en av kitin, så de flesta virus kan komma in i dessa celler först efter trauma mot cellväggen. Nästan alla växtvirus (som tobaksmosaikvirus) kan också flytta direkt från cell till cell, i form av enkelsträngade nukleoproteinkomplex, genom porer som kallas plasmodesmata . Bakterier, liksom växter, har starka cellväggar som ett virus måste bryta för att infektera cellen. Med tanke på att bakteriecellsväggar är mycket tunnare än växtcellväggar på grund av sin mycket mindre storlek, har vissa virus utvecklat mekanismer som injicerar deras genom i bakteriecellen över cellväggen, medan den virala kapsiden förblir utanför.
Uncoating är en process där den virala kapsiden avlägsnas: Detta kan vara genom nedbrytning av virala enzymer eller värdenzymer eller genom enkel dissociation; slutresultatet är frisättningen av den virala genomiska nukleinsyran.
Replikation av virus involverar i första hand multiplikation av genomet. Replikation involverar syntesen av viralt budbärar-RNA (mRNA) från "tidiga" gener (med undantag för positiv-sens RNA-virus), viral proteinsyntes , eventuell sammansättning av virala proteiner, sedan viral genomreplikation medierad av tidigt eller regulatoriskt proteinuttryck. Detta kan följas, för komplexa virus med större genom, av en eller flera ytterligare omgångar av mRNA-syntes: "sen" genuttryck är i allmänhet av strukturella proteiner eller virionproteiner.
Montering – Efter den strukturmedierade självsammansättningen av viruspartiklarna sker ofta en viss modifiering av proteinerna. I virus som HIV sker denna modifiering (ibland kallad mognad) efter att viruset har frigjorts från värdcellen.
Frisättning – Virus kan frigöras från värdcellen genom lysering , en process som dödar cellen genom att spränga dess membran och cellvägg om det finns: detta är ett kännetecken för många bakteriella och vissa djurvirus. Vissa virus genomgår en lysogen cykel där det virala genomet inkorporeras genom genetisk rekombination till en specifik plats i värdens kromosom. Det virala genomet är då känt som ett " provirus " eller, i fallet med bakteriofager en " profag ". Närhelst värden delar sig replikeras det virala genomet också. Det virala genomet är mestadels tyst inom värden. Vid någon tidpunkt kan proviruset eller profagen ge upphov till det aktiva viruset, som kan lysera värdcellerna. Höljeförsedda virus (t.ex. HIV) frisätts vanligtvis från värdcellen genom knoppning . Under denna process förvärvar viruset sitt hölje, som är en modifierad del av värdens plasma eller annat inre membran.
Genomreplikation
Det genetiska materialet i viruspartiklar, och metoden för att materialet replikeras, varierar avsevärt mellan olika typer av virus.
- DNA-virus
- Genomreplikationen av de flesta DNA-virus sker i cellens kärna . Om cellen har den lämpliga receptorn på sin yta kommer dessa virus in i cellen antingen genom direkt fusion med cellmembranet (t.ex. herpesvirus) eller – mer vanligt – genom receptormedierad endocytos. De flesta DNA-virus är helt beroende av värdcellens DNA- och RNA-syntesmaskiner och RNA-bearbetningsmaskineri. Virus med större genom kan koda för mycket av detta maskineri själva. Hos eukaryoter måste virusgenomet passera cellens kärnmembran för att komma åt detta maskineri, medan det hos bakterier bara behöver komma in i cellen.
- RNA-virus
- Replikation av RNA-virus sker vanligtvis i cytoplasman . RNA-virus kan placeras i fyra olika grupper beroende på deras replikationssätt. Polariteten (oavsett om den kan användas direkt av ribosomer för att göra proteiner) hos enkelsträngade RNA-virus bestämmer till stor del den replikativa mekanismen ; det andra huvudkriteriet är om det genetiska materialet är enkelsträngat eller dubbelsträngat. Alla RNA-virus använder sina egna RNA-replikasenzymer för att skapa kopior av sina genom.
- Omvänt transkriberande virus
- Omvänt transkriberande virus har ssRNA ( Retroviridae , Metaviridae , Pseudoviridae ) eller dsDNA ( Caulimoviridae och Hepadnaviridae ) i sina partiklar. Omvänt transkriberande virus med RNA-genom ( retrovirus ) använder en DNA-intermediär för att replikera, medan de med DNA-genom ( pararetrovirus ) använder en RNA-intermediär under genomreplikering. Båda typerna använder ett omvänt transkriptas , eller RNA-beroende DNA-polymerasenzym, för att utföra nukleinsyraomvandlingen. Retrovirus integrerar DNA som produceras genom omvänd transkription i värdgenomet som ett provirus som en del av replikationsprocessen; Det gör inte pararetrovirus, även om integrerade genomkopior av särskilt växtpararetrovirus kan ge upphov till infektiöst virus. De är mottagliga för antivirala läkemedel som hämmar enzymet omvänt transkriptas, t.ex. zidovudin och lamivudin . Ett exempel på den första typen är HIV, som är ett retrovirus. Exempel på den andra typen är Hepadnaviridae , som inkluderar hepatit B-virus.
Cytopatiska effekter på värdcellen
Utbudet av strukturella och biokemiska effekter som virus har på värdcellen är omfattande. Dessa kallas " cytopatiska effekter ". De flesta virusinfektioner resulterar så småningom i att värdcellen dör. Dödsorsakerna inkluderar cellys, förändringar av cellens ytmembran och apoptos . Ofta orsakas celldöd av att dess normala aktiviteter upphör på grund av undertryckande av virusspecifika proteiner, som inte alla är komponenter i viruspartikeln. Skillnaden mellan cytopatisk och ofarlig är gradvis. Vissa virus, såsom Epstein-Barr-virus , kan få celler att föröka sig utan att orsaka malignitet, medan andra, såsom papillomvirus , är etablerade orsaker till cancer.
Vilande och latenta infektioner
Vissa virus orsakar inga uppenbara förändringar i den infekterade cellen. Celler där viruset är latent och inaktivt visar få tecken på infektion och fungerar ofta normalt. Detta orsakar ihållande infektioner och viruset är ofta vilande i många månader eller år. Detta är ofta fallet med herpesvirus .
Värdsortiment
Virus är den absolut vanligaste biologiska varelserna på jorden och de är fler än alla andra tillsammans. De infekterar alla typer av cellulärt liv inklusive djur, växter, bakterier och svampar . Olika typer av virus kan bara infektera ett begränsat antal värdar och många är artspecifika. Vissa, som smittkoppsvirus till exempel, kan bara infektera en art – i det här fallet människor, och sägs ha ett smalt värdområde . Andra virus, som rabiesvirus, kan infektera olika arter av däggdjur och sägs ha ett brett spektrum. Virusen som infekterar växter är ofarliga för djur, och de flesta virus som infekterar andra djur är ofarliga för människor. Värdområdet för vissa bakteriofager är begränsat till en enda bakteriestam och de kan användas för att spåra källan till infektionsutbrott med en metod som kallas fagtypning . Den kompletta uppsättningen av virus i en organism eller livsmiljö kallas virom ; till exempel utgör alla mänskliga virus det mänskliga viromet .
Nya virus
Ett nytt virus är ett som inte tidigare har registrerats. Det kan vara ett virus som är isolerat från sin naturliga reservoar eller isolerat som ett resultat av spridning till en djur- eller mänsklig värd där viruset inte hade identifierats tidigare. Det kan vara ett framväxande virus , ett som representerar ett nytt virus, men det kan också vara ett bevarat virus som inte har identifierats tidigare . SARS -CoV-2- coronaviruset som orsakade pandemin av covid-sjukdomen är ett exempel på ett nytt virus.
Klassificering
Klassificering försöker beskriva mångfalden av virus genom att namnge och gruppera dem på basis av likheter. 1962 André Lwoff , Robert Horne och Paul Tournier de första att utveckla ett sätt för virusklassificering, baserat på Linnés hierarkiska system. Denna systembaserade klassificering på filum , klass , ordning , familj , släkte och art . Virus grupperades efter deras gemensamma egenskaper (inte deras värdars) och typen av nukleinsyra som bildar deras genom. 1966 bildades International Committee on Taxonomy of Viruses (ICTV). Systemet som föreslogs av Lwoff, Horne och Tournier accepterades till en början inte av ICTV eftersom virusens lilla genomstorlek och deras höga mutationshastighet gjorde det svårt att fastställa deras härkomst utöver ordning. Som sådant Baltimores klassificeringssystem kommit att användas för att komplettera den mer traditionella hierarkin. Från och med 2018 började ICTV att erkänna djupare evolutionära relationer mellan virus som har upptäckts över tiden och antog ett klassificeringssystem med 15 rankningar som sträcker sig från rike till art. Dessutom är vissa arter inom samma genus grupperade i en genogrupp .
ICTV-klassificering
ICTV utvecklade det nuvarande klassificeringssystemet och skrev riktlinjer som lägger större vikt vid vissa virusegenskaper för att upprätthålla familjens enhetlighet. En enhetlig taxonomi (ett universellt system för att klassificera virus) har etablerats. Endast en liten del av den totala mångfalden av virus har studerats. Från och med 2021 har 6 riken, 10 kungadömen, 17 phyla, 2 subphyla, 39 klasser, 65 ordnar, 8 underordnar, 233 familjer, 168 underfamiljer, 2 606 släkten, 84 undersläkten och 10 434 TV- arter definierats av virus.
Den allmänna taxonomiska strukturen för taxonområden och suffixen som används i taxonomiska namn visas nedan. Från och med 2021 är raden av underrike, underrike och underklass oanvända, medan alla andra led är i bruk.
- Rike ( -viria )
Baltimore klassificering

Den nobelprisbelönte biologen David Baltimore utarbetade Baltimores klassificeringssystem . ICTV-klassificeringssystemet används tillsammans med Baltimores klassificeringssystem i modern virusklassificering.
Baltimore-klassificeringen av virus är baserad på mekanismen för mRNA- produktion. Virus måste generera mRNA från sina genom för att producera proteiner och replikera sig själva, men olika mekanismer används för att uppnå detta i varje virusfamilj. Virala genom kan vara enkelsträngade (ss) eller dubbelsträngade (ds), RNA eller DNA, och kan eventuellt inte använda omvänt transkriptas (RT). Dessutom kan ssRNA-virus vara antingen sense (+) eller antisense (−). Denna klassificering delar in virus i sju grupper:
- I: dsDNA-virus (t.ex. adenovirus , herpesvirus , poxvirus )
- II: ssDNA-virus (+ sträng eller "sense") DNA (t.ex. Parvovirus )
- III: dsRNA-virus (t.ex. Reovirus )
- IV: (+)ssRNA-virus (+ sträng eller sens) RNA (t.ex. Coronavirus , Picornavirus , Togavirus )
- V: (−)ssRNA-virus (− sträng eller antisens) RNA (t.ex. Orthomyxovirus , Rhabdovirus )
- VI: ssRNA-RT-virus (+ sträng eller sens) RNA med DNA mellanliggande i livscykeln (t.ex. retrovirus )
- VII: dsDNA-RT-virus DNA med RNA-intermediär i livscykeln (t.ex. Hepadnavirus )
Roll i mänskliga sjukdomar
Exempel på vanliga mänskliga sjukdomar som orsakas av virus är förkylning , influensa , vattkoppor och munsår . Många allvarliga sjukdomar som rabies , ebolavirussjukdom , AIDS (HIV) , fågelinfluensa och SARS orsakas av virus. Virusens relativa förmåga att orsaka sjukdom beskrivs i termer av virulens . Andra sjukdomar är under utredning för att upptäcka om de har ett virus som orsakande medel, såsom det möjliga sambandet mellan humant herpesvirus 6 (HHV6) och neurologiska sjukdomar som multipel skleros och kroniskt trötthetssyndrom . Det råder kontroverser om huruvida bornaviruset , som tidigare ansågs orsaka neurologiska sjukdomar hos hästar, kan vara ansvarigt för psykiska sjukdomar hos människor.
Virus har olika mekanismer genom vilka de producerar sjukdomar i en organism, vilket till stor del beror på den virala arten. Mekanismer på cellulär nivå inkluderar i första hand celllys, uppbrytning och efterföljande död av cellen. I flercelliga organismer , om tillräckligt många celler dör, kommer hela organismen att börja drabbas av effekterna. Även om virus orsakar störningar av hälsosam homeostas , vilket resulterar i sjukdom, kan de existera relativt ofarligt i en organism. Ett exempel skulle inkludera förmågan hos herpes simplex-viruset , som orsakar munsår, att förbli i ett vilande tillstånd i människokroppen. Detta kallas latens och är ett kännetecken för herpesvirus, inklusive Epstein-Barr-virus, som orsakar körtelfeber, och varicella zoster-virus , som orsakar vattkoppor och bältros . De flesta människor har blivit infekterade med minst en av dessa typer av herpesvirus. Dessa latenta virus kan ibland vara fördelaktiga, eftersom närvaron av viruset kan öka immuniteten mot bakteriella patogener, såsom Yersinia pestis .
Vissa virus kan orsaka livslånga eller kroniska infektioner, där virusen fortsätter att replikera i kroppen trots värdens försvarsmekanismer. Detta är vanligt vid hepatit B-virus och hepatit C-virusinfektioner. Människor som är kroniskt infekterade är kända som bärare, eftersom de fungerar som reservoarer av infektiöst virus. I populationer med en hög andel bärare sägs sjukdomen vara endemisk .
Epidemiologi
Viral epidemiologi är den gren av medicinsk vetenskap som sysslar med överföring och kontroll av virusinfektioner hos människor. Överföring av virus kan vara vertikal, vilket betyder från mor till barn, eller horisontell, vilket betyder från person till person. Exempel på vertikal överföring inkluderar hepatit B-virus och HIV, där barnet föds redan infekterat med viruset. Ett annat, mer sällsynt, exempel är varicella zoster-viruset , som, även om det orsakar relativt milda infektioner hos barn och vuxna, kan vara dödligt för fostret och det nyfödda barnet.
Horisontell överföring är den vanligaste mekanismen för spridning av virus i populationer. Horisontell överföring kan ske när kroppsvätskor byts ut under sexuell aktivitet, genom utbyte av saliv eller när förorenad mat eller vatten intas. Det kan också uppstå när aerosoler som innehåller virus andas in eller av insektsvektorer som när infekterade myggor penetrerar huden på en värd. De flesta typer av virus är begränsade till bara en eller två av dessa mekanismer och de kallas för "respiratoriska virus" eller "enteriska virus" och så vidare. Hastigheten eller hastigheten för överföring av virusinfektioner beror på faktorer som inkluderar befolkningstäthet, antalet mottagliga individer (dvs. de som inte är immuna), kvaliteten på sjukvården och vädret.
Epidemiologi används för att bryta infektionskedjan i populationer under utbrott av virussjukdomar . Kontrollåtgärder används som baseras på kunskap om hur viruset överförs. Det är viktigt att hitta källan, eller källorna, till utbrottet och att identifiera viruset. När viruset väl har identifierats kan överföringskedjan ibland brytas av vacciner. När vaccin inte är tillgängliga kan sanitet och desinfektion vara effektivt. Ofta isoleras infekterade människor från resten av samhället och de som har exponerats för viruset sätts i karantän . För att kontrollera utbrottet av mul- och klövsjuka hos nötkreatur i Storbritannien 2001 slaktades tusentals nötkreatur. De flesta virusinfektioner hos människor och andra djur har inkubationsperioder under vilka infektionen inte orsakar några tecken eller symtom. Inkubationsperioder för virussjukdomar sträcker sig från några dagar till veckor, men är kända för de flesta infektioner. Något överlappande, men främst efter inkubationsperioden, finns det en period av smittbarhet - en tid då en infekterad individ eller ett infekterat djur är smittsamt och kan infektera en annan person eller ett annat djur. Även detta är känt för många virusinfektioner och kunskap om längden på båda menstruationerna är viktig för att kontrollera utbrott. När utbrott orsakar en ovanligt hög andel fall i en befolkning, ett samhälle eller en region kallas de epidemier. Om utbrott sprids över hela världen kallas de för pandemier .
Epidemier och pandemier
En pandemi är en världsomspännande epidemi . 1918 års influensapandemi , som varade till 1919, var en kategori 5- influensapandemi orsakad av ett ovanligt allvarligt och dödligt influensa A-virus. Offren var ofta friska unga vuxna, till skillnad från de flesta influensautbrott, som främst drabbar ungdomar, äldre eller på annat sätt försvagade patienter. Äldre uppskattningar säger att den dödade 40–50 miljoner människor, medan nyare forskning tyder på att den kan ha dödat så många som 100 miljoner människor, eller 5 % av världens befolkning 1918.
Även om virala pandemier är sällsynta händelser, har HIV - som utvecklats från virus som hittats i apor och schimpanser - varit pandemi sedan åtminstone 1980-talet. Under 1900-talet fanns det fyra pandemier orsakade av influensavirus och de som inträffade 1918, 1957 och 1968 var allvarliga. De flesta forskare tror att hiv uppstod i Afrika söder om Sahara under 1900-talet; det är nu en pandemi, med uppskattningsvis 37,9 miljoner människor som nu lever med sjukdomen världen över. Det var cirka 770 000 dödsfall i aids under 2018. Det gemensamma FN-programmet för hiv/aids (UNAIDS) och Världshälsoorganisationen (WHO) uppskattar att aids har dödat mer än 25 miljoner människor sedan det först erkändes den 5 juni 1981, vilket gör det till en av de mest destruktiva epidemierna i historien. Under 2007 fanns det 2,7 miljoner nya hiv-infektioner och 2 miljoner hiv-relaterade dödsfall.
Flera mycket dödliga virala patogener är medlemmar av Filoviridae . Filovirus är filamentliknande virus som orsakar viral hemorragisk feber och inkluderar ebolavirus och marburgvirus . Marburgviruset , som först upptäcktes 1967, väckte stor uppmärksamhet i pressen i april 2005 för ett utbrott i Angola . Ebolavirussjukdomen har också orsakat intermittenta utbrott med hög dödlighet sedan 1976 då den först identifierades. Den värsta och senaste är epidemin i Västafrika 2013–2016 .
Förutom smittkoppor orsakas de flesta pandemier av nyutvecklade virus. Dessa "emergenta" virus är vanligtvis mutanter av mindre skadliga virus som tidigare har cirkulerat antingen hos människor eller andra djur.
Svårt akut respiratoriskt syndrom ( SARS ) och Mellanöstern respiratoriskt syndrom (MERS) orsakas av nya typer av coronavirus . Andra koronavirus är kända för att orsaka milda infektioner hos människor, så virulensen och den snabba spridningen av SARS-infektioner – som i juli 2003 hade orsakat cirka 8 000 fall och 800 dödsfall – var oväntad och de flesta länder var inte förberedda.
Ett relaterat coronavirus, allvarligt akut respiratoriskt syndrom coronavirus 2 (SARS-Cov-2), som tros ha sitt ursprung i fladdermöss, dök upp i Wuhan , Kina i november 2019 och spred sig snabbt över världen. Infektioner med viruset orsakade covid-19-pandemin som startade 2020. Oöverträffade restriktioner i fredstid lades på internationella resor, och utegångsförbud infördes i flera större städer världen över som svar på pandemin.
Cancer
Virus är en etablerad orsak till cancer hos människor och andra arter. Viruscancer förekommer endast hos en minoritet av infekterade personer (eller djur). Cancervirus kommer från en rad virusfamiljer, inklusive både RNA- och DNA-virus, och så det finns ingen enskild typ av " onkovirus " (en föråldrad term som ursprungligen användes för akut transformerande retrovirus). Utvecklingen av cancer bestäms av en mängd olika faktorer såsom värdimmunitet och mutationer i värden. Virus som accepteras för att orsaka cancer hos människor inkluderar vissa genotyper av humant papillomvirus , hepatit B-virus , hepatit C-virus , Epstein-Barr-virus , Kaposis sarkom-associerat herpesvirus och humant T-lymfotropiskt virus . Det senast upptäckta humana cancerviruset är ett polyomavirus ( Merkelcellspolyomavirus ) som orsakar de flesta fall av en sällsynt form av hudcancer som kallas Merkelcellscancer . Hepatitvirus kan utvecklas till en kronisk virusinfektion som leder till levercancer . Infektion med humant T-lymfotropiskt virus kan leda till tropisk spastisk parapares och vuxen T-cellsleukemi . Humant papillomvirus är en etablerad orsak till cancer i livmoderhalsen , hud, anus och penis . Inom Herpesviridae orsakar Kaposis sarkom-associerade herpesvirus Kaposis sarkom och kroppshålrumslymfom , och Epstein-Barr-virus orsakar Burkitts lymfom , Hodgkins lymfom , B - lymfoproliferativ störning och nasofaryngeal karcinom . Merkel cell polyomavirus nära besläktat med SV40 och mus polyomavirus som har använts som djurmodeller för cancervirus i över 50 år.
Värdförsvarsmekanismer
Kroppens första försvarslinje mot virus är det medfödda immunförsvaret . Detta innefattar celler och andra mekanismer som försvarar värden från infektion på ett ospecifikt sätt. Detta innebär att cellerna i det medfödda systemet känner igen och svarar på patogener på ett generiskt sätt, men till skillnad från det adaptiva immunsystemet ger det inte långvarig eller skyddande immunitet till värden.
RNA-interferens är ett viktigt medfödd försvar mot virus. Många virus har en replikationsstrategi som involverar dubbelsträngat RNA (dsRNA). När ett sådant virus infekterar en cell frigör det sin RNA-molekyl eller -molekyler, som omedelbart binder till ett proteinkomplex som kallas en dicer som skär RNA:t i mindre bitar. En biokemisk väg – RISC-komplexet – aktiveras, vilket säkerställer cellöverlevnad genom att bryta ner det virala mRNA:t. Rotavirus har utvecklats för att undvika denna försvarsmekanism genom att inte avbelägga helt inuti cellen och släppa ut nyproducerat mRNA genom porerna i partikelns inre kapsid. Deras genomiska dsRNA förblir skyddat inuti virionens kärna.
När det adaptiva immunsystemet hos ett ryggradsdjur stöter på ett virus, producerar det specifika antikroppar som binder till viruset och ofta gör det icke-smittsamt. Detta kallas humoral immunitet . Två typer av antikroppar är viktiga. Den första, som kallas IgM , är mycket effektiv för att neutralisera virus men produceras av cellerna i immunsystemet endast under några veckor. Den andra, kallad IgG , produceras på obestämd tid. Närvaron av IgM i värdens blod används för att testa för akut infektion, medan IgG indikerar en infektion någon gång i det förflutna. IgG-antikropp mäts när immunitetstester utförs .
Antikroppar kan fortsätta att vara en effektiv försvarsmekanism även efter att virus har lyckats ta sig in i värdcellen. Ett protein som finns i celler, kallat TRIM21 , kan fästa till antikropparna på viruspartikelns yta. Detta förbereder den efterföljande förstörelsen av viruset av enzymerna i cellens proteosomsystem .

Ett andra försvar av ryggradsdjur mot virus kallas cellmedierad immunitet och involverar immunceller som kallas T-celler . Kroppens celler visar ständigt korta fragment av sina proteiner på cellens yta, och om en T-cell känner igen ett misstänkt viralt fragment där, förstörs värdcellen av "mördar-T"-celler och de virusspecifika T-cellerna förökar sig. Celler som makrofagen är specialister på denna antigenpresentation . Produktionen av interferon är en viktig värdförsvarsmekanism. Detta är ett hormon som produceras av kroppen när virus finns. Dess roll i immunitet är komplex; det stoppar så småningom virusen från att reproducera sig genom att döda den infekterade cellen och dess nära grannar.
Inte alla virusinfektioner ger ett skyddande immunsvar på detta sätt. HIV undviker immunsystemet genom att ständigt ändra aminosyrasekvensen för proteinerna på ytan av virion. Detta är känt som "flyktmutation" eftersom de virala epitoperna undkommer igenkänning av värdens immunsvar. Dessa ihållande virus undviker immunkontroll genom sekvestrering, blockad av antigenpresentation , cytokinresistens , undanflykt från naturliga mördarcellaktiviteter , flykt från apoptos och antigenskifte . Andra virus, kallade " neurotropa virus ", sprids genom neural spridning där immunsystemet kanske inte kan nå dem på grund av immunprivilegier .
Förebyggande och behandling
Eftersom virus använder viktiga metaboliska vägar inom värdceller för att replikera, är de svåra att eliminera utan att använda läkemedel som orsakar toxiska effekter på värdceller i allmänhet. De mest effektiva medicinska metoderna för virussjukdomar är vaccinationer för att ge immunitet mot infektioner och antivirala läkemedel som selektivt stör virusreplikationen.
Vacciner
Vaccination är ett billigt och effektivt sätt att förebygga infektioner av virus. Vacciner användes för att förhindra virusinfektioner långt innan upptäckten av själva virusen. Deras användning har resulterat i en dramatisk minskning av sjuklighet (sjukdom) och dödlighet (död) i samband med virusinfektioner som polio , mässling , påssjuka och röda hund . Smittkoppsinfektioner har utrotats. Vacciner finns tillgängliga för att förhindra över tretton virusinfektioner hos människor, och fler används för att förhindra virusinfektioner hos djur. Vacciner kan bestå av levande försvagade eller dödade virus, virala proteiner ( antigener ) eller RNA . Levande vacciner innehåller försvagade former av viruset, som inte orsakar sjukdomen men som ändå ger immunitet. Sådana virus kallas försvagade. Levande vacciner kan vara farliga när de ges till personer med svag immunitet (som beskrivs som immunsupprimerade ), eftersom det hos dessa människor kan det försvagade viruset orsaka den ursprungliga sjukdomen. Bioteknik och gentekniker används för att producera subenhetsvacciner. Dessa vacciner använder endast kapsidproteinerna från viruset. Hepatit B-vaccin är ett exempel på denna typ av vaccin. Subenhetsvacciner är säkra för immunsupprimerade patienter eftersom de inte kan orsaka sjukdomen. Vaccinet mot gula febern , en levande försvagad stam som kallas 17D, är förmodligen det säkraste och mest effektiva vaccinet som någonsin genererats.
Antivirala läkemedel
Antivirala läkemedel är ofta nukleosidanaloger (falska DNA-byggstenar), som virus av misstag införlivar i sina genom under replikering. Virusets livscykel stoppas sedan eftersom det nysyntetiserade DNA:t är inaktivt. Det beror på att dessa analoger saknar hydroxylgrupperna , som tillsammans med fosforatomer länkar samman för att bilda DNA-molekylens starka "ryggrad". Detta kallas DNA- kedjeterminering . Exempel på nukleosidanaloger är aciklovir för Herpes simplex-virusinfektioner och lamivudin för HIV- och hepatit B-virusinfektioner. Aciclovir är ett av de äldsta och mest föreskrivna antivirala läkemedlen. Andra antivirala läkemedel som används riktar sig mot olika stadier av den virala livscykeln. HIV är beroende av ett proteolytiskt enzym som kallas HIV-1-proteaset för att det ska bli fullt smittsamt. Det finns en stor klass av läkemedel som kallas proteashämmare som inaktiverar detta enzym. Det finns omkring tretton klasser av antivirala läkemedel var och en riktar sig mot olika virus eller stadier av viral replikation.
Hepatit C orsakas av ett RNA-virus. Hos 80 % av de smittade är sjukdomen kronisk och utan behandling är de infekterade resten av livet. Det finns effektiva behandlingar som använder direktverkande antivirala medel . Behandlingen av kroniska bärare av hepatit B-viruset har också utvecklats genom att använda liknande strategier som inkluderar lamivudin och andra antivirala läkemedel.
Smitta hos andra arter
Virus infekterar allt cellulärt liv och även om virus förekommer universellt har varje cellulär art sitt eget specifika område som ofta infekterar bara den arten. Vissa virus, som kallas satelliter , kan replikera endast inom celler som redan har infekterats av ett annat virus.
Djurvirus
Virus är viktiga patogener för boskap. Sjukdomar som mul- och klövsjuka och bluetongue orsakas av virus. Sällskapsdjur som katter, hundar och hästar är, om de inte vaccineras, mottagliga för allvarliga virusinfektioner. Hundparvovirus orsakas av ett litet DNA-virus och infektioner är ofta dödliga hos valpar. Liksom alla ryggradslösa djur är honungsbiet mottagligt för många virusinfektioner. De flesta virus samexisterar ofarligt i sin värd och orsakar inga tecken eller symtom på sjukdom.
Växtvirus

Det finns många typer av växtvirus, men ofta orsakar de bara en förlust av avkastning , och det är inte ekonomiskt lönsamt att försöka kontrollera dem. Växtvirus sprids ofta från växt till växt av organismer, kända som vektorer . Dessa är vanligtvis insekter, men vissa svampar, nematodmaskar , encelliga organismer och parasitiska växter är vektorer. När kontroll av växtvirusinfektioner anses ekonomiskt, för fleråriga frukter, till exempel, koncentreras ansträngningarna på att döda vektorerna och ta bort alternativa värdar som ogräs. Växtvirus kan inte infektera människor och andra djur eftersom de bara kan föröka sig i levande växtceller.
Potatisen kommer ursprungligen från Peru och har blivit en basgröda över hela världen. Potatisviruset Y orsakar sjukdomar hos potatis och relaterade arter inklusive tomater och paprika. På 1980-talet fick detta virus ekonomisk betydelse när det visade sig vara svårt att kontrollera i utsädespotatisgrödor. överförs av bladlöss och kan minska skördarna med upp till 80 procent, vilket orsakar betydande förluster för potatisskörden.
Växter har utarbetade och effektiva försvarsmekanismer mot virus. En av de mest effektiva är närvaron av så kallade resistensgener (R). Varje R-gen ger resistens mot ett visst virus genom att utlösa lokaliserade områden av celldöd runt den infekterade cellen, som ofta kan ses med blotta ögat som stora fläckar. Detta hindrar infektionen från att spridas. RNA-interferens är också ett effektivt försvar i växter. När de är infekterade producerar växter ofta naturliga desinfektionsmedel som dödar virus, såsom salicylsyra , kväveoxid och reaktiva syremolekyler .
Växtviruspartiklar eller virusliknande partiklar (VLP) har tillämpningar inom både bioteknik och nanoteknik . Kapsiderna hos de flesta växtvirus är enkla och robusta strukturer och kan produceras i stora mängder antingen genom infektion av växter eller genom uttryck i en mängd olika heterologa system. Växtviruspartiklar kan modifieras genetiskt och kemiskt för att inkapsla främmande material och kan inkorporeras i supramolekylära strukturer för användning inom bioteknik.
Bakteriella virus
Bakteriofager är en vanlig och mångfaldig grupp av virus och är den vanligaste biologiska enheten i vattenmiljöer - det finns upp till tio gånger fler av dessa virus i haven än det finns bakterier, och når nivåer på 250 000 000 bakteriofager per milliliter havsvatten. Dessa virus infekterar specifika bakterier genom att binda till ytreceptormolekyler och sedan komma in i cellen. Inom en kort tid, i vissa fall, bara några minuter, börjar bakteriellt polymeras att översätta viralt mRNA till protein. Dessa proteiner fortsätter att bli antingen nya virioner i cellen, hjälpproteiner, som hjälper till att sätta ihop nya virioner, eller proteiner involverade i cellys. Virala enzymer hjälper till med nedbrytningen av cellmembranet och, i fallet med T4-fagen , kunde över trehundra fager frigöras inom drygt tjugo minuter efter injektion.
Det främsta sättet för bakterier att försvara sig från bakteriofager är genom att producera enzymer som förstör främmande DNA. Dessa enzymer, som kallas restriktionsendonukleaser , skär upp det virala DNA som bakteriofager injicerar i bakterieceller. Bakterier innehåller också ett system som använder CRISPR- sekvenser för att behålla fragment av arvsmassan från virus som bakterierna har kommit i kontakt med tidigare, vilket gör att de kan blockera virusets replikation genom en form av RNA- interferens . Detta genetiska system ger bakterier förvärvad immunitet mot infektion.
Arkeala virus
Vissa virus replikerar inom archaea : dessa är DNA-virus med ovanliga och ibland unika former. Dessa virus har studerats i detalj i den termofila archaea, särskilt ordningarna Sulfolobales och Thermoproteales . Försvar mot dessa virus involverar RNA-interferens från repetitiva DNA- sekvenser inom arkeiska genom som är relaterade till virusens gener. De flesta arkéer har CRISPR-Cas-system som ett adaptivt försvar mot virus. Dessa gör det möjligt för archaea att behålla delar av viralt DNA, som sedan används för att rikta in sig på och eliminera efterföljande infektioner av viruset med hjälp av en process som liknar RNA-interferens.
Roll i akvatiska ekosystem
Virus är den vanligaste biologiska enheten i vattenmiljöer. Det finns cirka tio miljoner av dem i en tesked havsvatten. De flesta av dessa virus är bakteriofager som infekterar heterotrofa bakterier och cyanofager som infekterar cyanobakterier och de är väsentliga för regleringen av saltvatten- och sötvattenekosystem. Bakteriofager är ofarliga för växter och djur, och är viktiga för regleringen av marina och sötvattensekosystem är viktiga dödlighetsmedel för växtplankton , basen i näringskedjan i vattenmiljöer. De infekterar och förstör bakterier i vattenlevande mikrobiella samhällen, och är en av de viktigaste mekanismerna för att återvinna kol och näringsämnens kretslopp i marina miljöer. De organiska molekylerna som frigörs från de döda bakteriecellerna stimulerar färsk bakterie- och algtillväxt, i en process som kallas viral shunt . I synnerhet har lysering av bakterier genom virus visat sig förbättra kvävecirkulationen och stimulera växtplanktontillväxt. Viral aktivitet kan också påverka den biologiska pumpen , processen där kol binds i djuphavet.
Mikroorganismer utgör mer än 90 % av biomassan i havet. Det uppskattas att virus dödar cirka 20 % av denna biomassa varje dag och att det finns 10 till 15 gånger så många virus i haven som det finns bakterier och arkéer. Virus är också viktiga medel som är ansvariga för förstörelsen av växtplankton inklusive skadliga algblomningar. Antalet virus i haven minskar längre till havs och djupare ner i vattnet, där det finns färre värdorganismer.
ursprung , deponeras dagligen från jordens atmosfär på varje kvadratmeter av planetens yta, som ett resultat av en global atmosfärisk ström av virus, som cirkulerar ovanför vädersystemet men under höjden av vanliga flygresor, sprider virus runt planeten.
Som vilken organism som helst är marina däggdjur mottagliga för virusinfektioner. Åren 1988 och 2002 dödades tusentals knubbsälar i Europa av phocine distemper-virus . Många andra virus, inklusive calicivirus , herpesvirus , adenovirus och parvovirus , cirkulerar i marina däggdjurspopulationer.
I december 2022 rapporterade forskare den första observationen av virovory via ett experiment på dammvatten som innehåller klorovirus , som vanligtvis infekterar gröna alger i sötvattensmiljöer. När alla andra mikrobiella födokällor togs bort från vattnet, observerades ciliaten Halteria ha ökat i antal på grund av den aktiva konsumtionen av klorovirus som födokälla istället för dess typiska bakterivordiet .
Roll i evolutionen
Virus är ett viktigt naturligt sätt att överföra gener mellan olika arter, vilket ökar den genetiska mångfalden och driver evolutionen. Man tror att virus spelade en central roll i den tidiga evolutionen, innan diversifieringen av den sista universella gemensamma förfadern till bakterier, arkéer och eukaryoter. Virus är fortfarande en av de största reservoarerna av outforskad genetisk mångfald på jorden.
Ansökningar
Livsvetenskap och medicin

Virus är viktiga för studiet av molekylär- och cellbiologi eftersom de tillhandahåller enkla system som kan användas för att manipulera och undersöka cellers funktioner. Studien och användningen av virus har gett värdefull information om aspekter av cellbiologi. Till exempel har virus varit användbara i studiet av genetik och hjälpt vår förståelse av de grundläggande mekanismerna för molekylär genetik , såsom DNA-replikation , transkription , RNA-bearbetning , translation , proteintransport och immunologi .
Genetiker använder ofta virus som vektorer för att introducera gener i celler som de studerar. Detta är användbart för att få cellen att producera en främmande substans, eller för att studera effekten av att introducera en ny gen i genomet. På liknande sätt viroterapi virus som vektorer för att behandla olika sjukdomar, eftersom de specifikt kan rikta in sig på celler och DNA. Den visar lovande användning vid behandling av cancer och genterapi . Östeuropeiska forskare har använt fagterapi som ett alternativ till antibiotika under en tid, och intresset för detta tillvägagångssätt ökar på grund av den höga nivån av antibiotikaresistens som nu finns hos vissa patogena bakterier. Expressionen av heterologa proteiner av virus är grunden för flera tillverkningsprocesser som för närvarande används för produktion av olika proteiner såsom vaccinantigener och antikroppar. Industriella processer har nyligen utvecklats med användning av virala vektorer och flera farmaceutiska proteiner är för närvarande i prekliniska och kliniska prövningar.
Viroterapi
Viroterapi innebär användning av genetiskt modifierade virus för att behandla sjukdomar. Virus har modifierats av forskare för att reproducera sig i cancerceller och förstöra dem men inte infektera friska celler. Talimogene laherparepvec (T-VEC), till exempel, är ett modifierat herpes simplex-virus som har haft en gen, som krävs för att virus ska replikera i friska celler, raderad och ersatt med en mänsklig gen ( GM-CSF ) som stimulerar immunitet. När detta virus infekterar cancerceller, förstör det dem och på så sätt attraherar närvaron av GM-CSF-genen dendritiska celler från de omgivande vävnaderna i kroppen. De dendritiska cellerna bearbetar de döda cancercellerna och presenterar komponenter av dem till andra celler i immunsystemet . Efter att ha genomfört framgångsrika kliniska prövningar fick viruset godkännande för behandling av melanom i slutet av 2015. Virus som har omprogrammerats för att döda cancerceller kallas onkolytiska virus .
Materialvetenskap och nanoteknik
Nuvarande trender inom nanoteknik lovar att använda virus mycket mer mångsidigt. Ur materialforskarens synvinkel kan virus betraktas som organiska nanopartiklar. Deras yta bär specifika verktyg som gör det möjligt för dem att passera barriärerna för sina värdceller. Storleken och formen på virus och antalet och arten av de funktionella grupperna på deras yta är exakt definierade. Som sådana används virus vanligtvis inom materialvetenskap som byggnadsställningar för kovalent kopplade ytmodifieringar. En speciell egenskap hos virus är att de kan skräddarsys genom riktad evolution. De kraftfulla tekniker som utvecklats av biovetenskaper håller på att bli grunden för tekniska tillvägagångssätt för nanomaterial, vilket öppnar ett brett spektrum av tillämpningar långt bortom biologi och medicin.
På grund av deras storlek, form och väldefinierade kemiska strukturer har virus använts som mallar för att organisera material på nanoskala. Nya exempel inkluderar arbete vid Naval Research Laboratory i Washington, DC, med användning av Cowpea mosaic virus (CPMV) partiklar för att förstärka signaler i DNA-mikroarraybaserade sensorer. I denna applikation separerar viruspartiklarna de fluorescerande färgämnena som används för signalering för att förhindra bildandet av icke-fluorescerande dimerer som fungerar som släckare . Ett annat exempel är användningen av CPMV som en nanoskala för molekylär elektronik.
Syntetiska virus
Många virus kan syntetiseras de novo ("från grunden"). Det första syntetiska viruset skapades 2002. Även om det är något av en missuppfattning, är det inte det faktiska viruset som syntetiseras, utan snarare dess DNA-genom (vid ett DNA-virus), eller en cDNA-kopia av dess genom (i fall av RNA-virus). För många virusfamiljer är det nakna syntetiska DNA:t eller RNA:t (en gång enzymatiskt omvandlat tillbaka från det syntetiska cDNA) smittsamt när det introduceras i en cell. Det vill säga, de innehåller all nödvändig information för att producera nya virus. Denna teknik används nu för att undersöka nya vaccinstrategier. Möjligheten att syntetisera virus har långtgående konsekvenser, eftersom virus inte längre kan betraktas som utdöda, så länge informationen om deras genomsekvens är känd och tillåtande celler finns tillgängliga. Från och med juni 2021 är genomsekvenserna i full längd av 11 464 olika virus, inklusive smittkoppor, allmänt tillgängliga i en onlinedatabas som underhålls av National Institutes of Health .
Vapen
Virusens förmåga att orsaka förödande epidemier i mänskliga samhällen har lett till oro för att virus skulle kunna beväpnas för biologisk krigföring . Ytterligare oro väcktes av den framgångsrika återskapandet av det ökända influensaviruset från 1918 i ett laboratorium. Smittkoppsviruset ödelade många samhällen genom historien innan det utrotades. Det finns bara två centra i världen som godkänts av WHO för att hålla lager av smittkoppsvirus: State Research Center of Virology and Biotechnology VECTOR i Ryssland och Centers for Disease Control and Prevention i USA. Det kan användas som ett vapen, eftersom vaccinet mot smittkoppor ibland hade allvarliga biverkningar, används det inte längre rutinmässigt i något land. Således har mycket av den moderna mänskliga befolkningen nästan ingen etablerad resistens mot smittkoppor och skulle vara sårbara för viruset.
Se även
- Överföring mellan arter
- Ordlista för virologi
- Lagen om avtagande virulens – Motbevisad hypotes från epidemiologen Theobald Smith
- Icke-cellulärt liv
- Retrozyme
- Teori om virulens – Teori av biologen Paul W. Ewald
- Viral metagenomik
- Viroplasm
- Zoonos
Anteckningar
Bibliografi
- Collier L, Balows A, Sussman M (1998). Mahy B, Collier LA (red.). Topley och Wilsons mikrobiologi och mikrobiella infektioner . Virologi. Vol. 1 (nionde upplagan). ISBN 0-340-66316-2 .
- Dimmock NJ, Easton AJ, Leppard K (2007). Introduktion till modern virologi (sjätte upplagan). Blackwell Publishing. ISBN 978-1-4051-3645-7 .
- Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B, Straus SE (2007). Fältvirologi . Lippincott Williams & Wilkins. ISBN 978-0-7817-6060-7 .
- Krasner, Robert (2014). Den mikrobiella utmaningen: ett folkhälsoperspektiv . Burlington, Mass: Jones & Bartlett Learning. ISBN 978-1-4496-7375-8 . OCLC 794228026 . </ref>
- Shors T (2017). Förstå virus . Jones och Bartlett Publishers. ISBN 978-1-284-02592-7 .
externa länkar
-
 Media relaterade till virus på Wikimedia Commons
Media relaterade till virus på Wikimedia Commons -
 Data relaterade till virus på Wikispecies
Data relaterade till virus på Wikispecies - ViralZone En schweizisk institut för bioinformatik resurs för alla virala familjer, som tillhandahåller allmän molekylär och epidemiologisk information