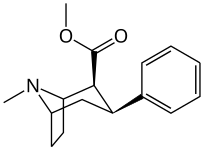
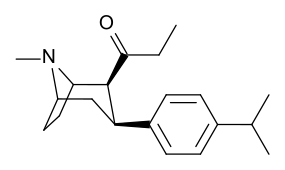
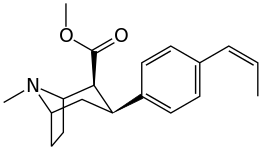
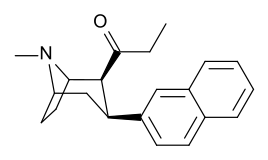
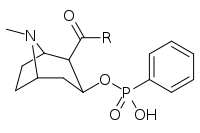
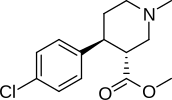
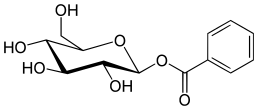
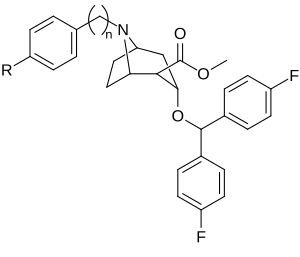
Lista över kokainanaloger
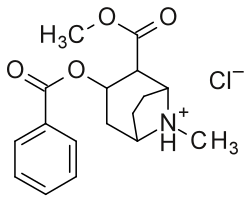
Överst: Kokain i stolkonformationen av tropanringen, med endast dess tropanlokanter angivna. Mitten: Kokain med dess numeriska substitutionspositioner . 2′ ( 6′ ) = orto , 3′ ( 5′ ) = meta & 4′ = para Botten: Alternativt tvådimensionellt molekyldiagram av kokain; visas specifikt som en protonerad , NH+, hydroklorid , och utan hänsyn till 3D-stereokemi
Detta är en lista över kokainanaloger . En kokainanalog är en (vanligtvis) konstgjord konstruktion av en ny kemisk förening från (ofta utgångspunkten för naturliga) kokainets molekylära struktur, med resultatprodukten tillräckligt lik kokain för att uppvisa likhet i, men förändring av, dess kemiska funktion. Inom ramen för analoga föreningar skapade från strukturen av kokain, behåller så kallade "kokainanaloger" 3 β -bensoyloxi eller liknande funktionalitet (den term som används specifikt skiljer vanligtvis från fenyltropaner , men i vid mening i allmänhet, som en kategori, inkluderar dem) på ett tropanskelett, jämfört med andra stimulantia av detta slag. Många av de egentliga semisyntetiska kokainanalogerna som har tillverkats och studerats har bestått av bland de nio följande klasserna av föreningar:
- stereoisomerer av kokain
- 3 p -fenylringsubstituerade analoger
- 2 p- substituerade analoger
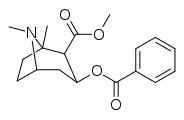
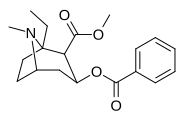
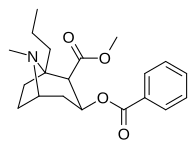
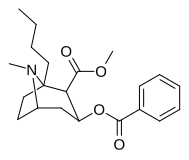
- N- modifierade analoger av kokain
- 3 p -karbamoylanaloger
- 3p - alkyl-3-bensyltropaner
- 6/7-substituerade kokain
- 6-alkyl-3-bensyltropaner
- piperidinhomologer av kokain
Men strikta analoger av kokain skulle också innefatta sådana andra potentiella kombinationer som fenacyltropaner och andra kolförgrenade ersättningar som inte anges ovan. Termen kan också användas löst för att hänvisa till droger som tillverkats av kokain eller har sin grund som en total syntes av kokain, men modifierad för att ändra deras effekt & QSAR . Dessa inkluderar både intracellulära natriumkanalblockerare anestetika och stimulerande dopaminåterupptagshämmande ligander (såsom vissa, nämligen tropanöverbryggade, utskurna, piperidiner ). Dessutom har forskare stött kombinatoriska tillvägagångssätt för att ta de mest lovande analogerna som för närvarande har belysts och blanda dem till slutet av upptäckten av nya och effektiva föreningar för att optimera deras användning för olika distinkta specificerade syften.
Analoger sensu stricto
Kokain stereoisomerer
| Strukturera | Stereoisomer |
S. Singhs alfanumeriska uppgift |
IC 50 ( nM ) [ 3 H] WIN 3542 hämning av striatala membran hos råtta Medelfelstandard ≤ 5 % i alla fall |
IUPAC nomenklatur |
|---|---|---|---|---|

|
R -kokain (erytroxylin) |
102 | metyl(lR,2R,3S,5S)-3-(bensoyloxi)-8-metyl-8-azabicyklo[3.2.1]oktan-2-karboxylat | |

|
R-pseudokokain (Delcaine, Depsokokain, Dextrokain, Isokokain, Psicaine.) |
172 | 15800 | metyl(lR, 2S ,3S,5S)-3-(bensoyloxi)-8-metyl-8-azabicyklo[3.2.1]oktan-2-karboxylat |

|
R-allokokain | 173 | 6160 | metyl(lR,2R, 3R ,5S)-3-(bensoyloxi)-8-metyl-8-azabicyklo[3.2.1]oktan-2-karboxylat |
|
R-allopseudokokain | 174 | 28500 | metyl(lR, 2S , 3R ,5S)-3-(bensoyloxi)-8-metyl-8-azabicyklo[3.2.1]oktan-2-karboxylat |

|
S-kokain | 175 | 15800 | metyl(lS,3R,4R,5R)-3-(bensoyl)oxi-8-metyl-8-azabicyklo[3.2.1]oktan- 4 -karboxylat |

|
S-pseudokokain | 176 | 22500 | metyl(lS,3R, 4S ,5R)-3-(bensoyl)oxi-8-metyl-8-azabicyklo[3.2.1]oktan- 4- karboxylat |

|
S-allokokain | 177 | 9820 | metyl(lS, 3S ,4R,5R)-3-(bensoyl)oxi-8-metyl-8-azabicyklo[3.2.1]oktan- 4 -karboxylat |

|
S-allopseudokokain | 178 | 67700 | metyl(lS, 3S , 4S ,5R)-3-(bensoyl)oxi-8-metyl-8-azabicyklo[3.2.1]oktan- 4- karboxylat |

Strukturen av kokain med relevanta strukturella motiv för aktivitet vid dopamintransportören framhävd . Även om man ursprungligen trodde att 2β-karbometoxidelen interagerade med DAT genom vätebindning, har efterföljande forskning visat att elektrostatiska (joniska) interaktioner är det primära sättet för interaktioner med DAT.
Det finns åtta stereoisomerer av kokain (exklusive mesomerer och modifieringar av den inre delen av tropanringen). På grund av närvaron av fyra asymmetriska kolatomer i 1- och 5- till 8 (N)-positionsbindningsbryggan som kan anta R- & S- konfigurationer, kan kokain anses ha så många som sexton stereoisomerer. Emellertid tillåter geometriska begränsningar som förmedlas av brohuvudsaminen endast åtta att skapas.
Den naturliga isomerismen av kokain är instabil och benägen att epimeriseras . Till exempel innehåller slutprodukten av kokainbiosyntes en axiell C2-karbometoxidel som lätt genomgår epimerisering till ekvatorpositionen via förtvålning .
För alla 2D-strukturdiagram där stereokemi inte är indikerad, bör det antas att den avbildade analogen delar den stereokemiska konformationen av R -kokain om inte annat anges.
Arenbensen-ring 2′, 3′, 4′ (5′ & 6′) positioner ( aryl )
para- substituerade bensoylmetylekgoniner
| Strukturera |
S. Singhs alfanumeriska tilldelning (namn) |
4′= R | DAT [ 3 H]VINN 35428 |
5-HTT [ ^ H]Paroxetin |
NETTO [ ^ H]Nisoxetin |
Selektivitet 5-HTT/DAT |
Selektivitet NET/DAT |
|---|---|---|---|---|---|---|---|
| Kokain | H | 249 ± 37 | 615 ± 120 | 2500 ± 70 | 2.5 | 10,0 | |
|
icke-bensoyloxianalog jämförande ligander icke-tropananalog jämförande ligander |
11b (WIN 35428) (nisoxetin) (fluoxetin) |
F — — |
24 ± 4 775 ± 20 5200 ± 1270 |
690 ± 14 762 ± 90 15 ± 3 |
258 ± 40 135 ± 21 963 ± 158 |
28,7 1,0 0,003 |
10,7 0,2 0,2 |

|
|||||||
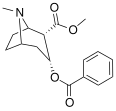
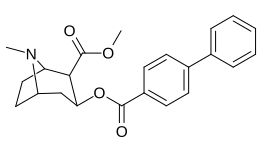
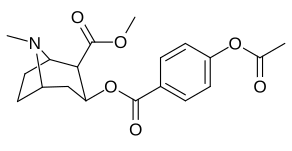
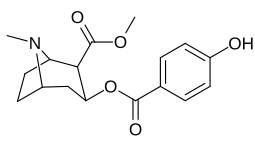
| 183a | jag | 2522 ± 4 | 1052 ± 23 | 18458 ± 1073 | 0,4 | 7.3 | |
| 183b | Ph | 486 ± 63 | - | - | - | - | |
| 183c | OAc | 144 ± 2 | - | - | - | - | |
| 183d | ÅH | 158 ± 8 | 3104 ± 148 | 601 ± 11 | 19.6 | 3.8 | |
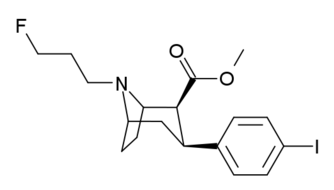
| ( 4′-fluorokokain ) | F | - | - | - | - | - | |
|
( para -Isothiocyanatobenzoylecgonine methyl ester ) ( p -Isococ) |
NCS | - | - | - | - | - |
| 183a | 183b | 183c |
|---|---|---|
 |
 |
|
| 183d | 4'-Fluorokokain | P-ISOCOC |
 |
 |

|
MAT- bindningsfickan som är analog med den lipofila platsen på kokainliknande föreningar, inklusive bensenringen, är ungefär 9 Å lång. Som bara är något större än en fenylring i sig.
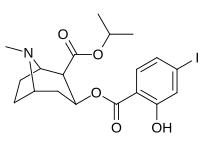
meta -substituerade bensoylmetylekgoniner
| Strukturera |
S. Singhs alfanumeriska tilldelning (namn) |
3'=R | DAT [ 3 H]VINN 35428 |
5-HTT [ ^ H]Paroxetin |
NETTO [ ^ H]Nisoxetin |
Selektivitet 5-HTT/DAT |
Selektivitet NET/DAT |
|---|---|---|---|---|---|---|---|
| (kokain) | H | 249 ± 37 | 615 ± 120 | 2500 ± 70 | 2.5 | 10,0 | |
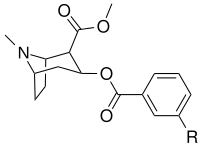
|
|||||||
| 184a | jag | 325 ɑ | - | - | - | - | |
| 184b | ÅH | 1183 ± 115 | 793 ± 33 | 3760 ± 589 | 0,7 | 3.2 | |
| 191 | O Bn | - | - | - | - | - | |
| ( m -Isococ) | NCS | - | - | - | - | - |
- ɑ IC50 - värde för undanträngning av [ 3H ]kokain
| 184a | 184b | m-ISOCOC | C3-bensyloxikokain |
|---|---|---|---|
 |
 |
 |

|
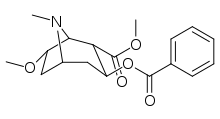
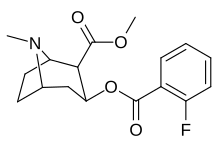
orto -substituerade bensoylmetylekgoniner
| Strukturera |
S. Singhs alfanumeriska tilldelning (namn) |
2'=R | DAT [ 3 H]VINN 35428 |
5-HTT [ ^ H]Paroxetin |
NETTO [ ^ H]Nisoxetin |
Selektivitet 5-HTT/DAT |
Selektivitet NET/DAT |
|---|---|---|---|---|---|---|---|
| Kokain | H | 249 ± 37 | 615 ± 120 | 2500 ± 70 | 2.5 | 10,0 | |

|
|||||||
| 185a | jag | 350 ɑ | - | - | - | - | |
| 185b | F | 604 ± 67 | 1770 ± 309 | 1392 ± 173 | 2.9 | 2.3 | |
|
185c ( 2'-acetoxikokain ) |
OAc | 70 ± 1 | 219 ± 20 | 72 ± 9 | 3.1 | 1.0 | |
|
185d ( 2'-hydroxikokain ) |
ÅH | 25 ± 4 | 143 ± 21 | 48 ± 2 | 5.7 | 1.9 |
- ɑ IC50 - värde för undanträngning av [ 3H ]kokain
| 185a | 185b | 185c | 185d |
|---|---|---|---|
 |
 |
 |

|
Den hydroxylerade 2′-OH-analogen uppvisade en tiofaldig ökning i styrka jämfört med kokain.
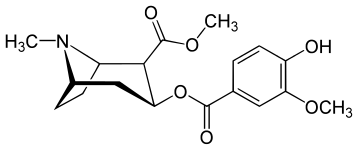
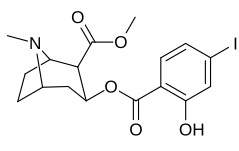
Förgreningsrör och terminering bensoyloxi fenyl-substitutioner
| Vanillylmetylekgonin | 186b |
|---|---|
 |
|
Multisubstitutioner (substitutioner av substitutioner; t.ex. meta - & para - ) eller mångfaldiga ("mångafaldiga") substituerade analoger är analoger där mer än en modifiering från modermolekylen äger rum (som har många mellanliggande beståndsdelar). Dessa skapas med ofta överraskande struktur-aktivitetsrelationsresultat extrapolerade därifrån. Det är till och med ett vanligt fall där två separata substitutioner var och en kan ge en svagare, lägre affinitet respektive till och med helt icke-effektiv förening; men på grund av upptäckter som ofta, när de används tillsammans, sådana två ömsesidigt sämre förändringar som adderas i tandem till en analog har potentialen att göra det resulterande derivatet uppvisa mycket större effektivitet, affinitet, selektivitet och/eller styrka än till och med moderföreningen; som annars äventyrades av någon av dessa två växlingar när de gjordes ensamma.
| Strukturera |
S. Singhs alfanumeriska tilldelning (namn) |
orto -2′= R | meta -3′= R | para -4′= R | DAT [ 3 H]VINN 35428 |
5-HTT [ ^ H]Paroxetin |
NETTO [ ^ H]Nisoxetin |
Selektivitet 5-HTT/DAT |
Selektivitet NET/DAT |
|---|---|---|---|---|---|---|---|---|---|
 |
186 | HO | H | jag | 215 ± 19 | 195 ± 10 | 1021 ± 75 | 0,9 | 4.7 |
 |
( Vanillylmetylekgonin ) | H | OCH 3 | ÅH | - | - | - | - | - |
Bensoyl- och karbometoxigrenmodifikationer
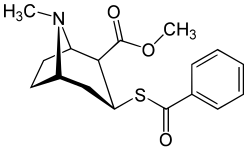
Ett svavel i stället för syret vid bensoylesterns enkelbindning resulterar i en lägre elektronegativitet än för kokain.

REC är en kokainanalog som innehåller en "omvänd" C2-karbometoxidel. I djurstudier saknade REC kokainliknande stimulerande effekter.
C1-tropanringväte—substitutioner
- ɑ , P < 0,05 jämfört med (—)-kokain (envägs ANOVA följt av Dunnetts multipla jämförelsetest)
- b , P < 0,01 jämfört med (—)-kokain (envägs ANOVA följt av Dunnetts multipla jämförelsetest)
- c Lidokain visade sig ha ett värde på 39,6 ± 2,4, det svagaste av alla testade.
- d Samma referens ger 25,9 ± 2,4 μM för (+)-kokain och 13,6 ± 1,3 μM för norkokain. Jämförbart ger det 12,7 ± 1,5 μM för den sigmaerga affiniteten för (+)-amfetamin. En annan referens ger 1,7-6,7 μM för (—)-kokain. Alla värden K i .
-
Med samma datauppsättning som ovanstående tabell visade sig följande föreningar jämföras med:
- CFT @ DAT = 39,2 ± 7,1 (n = 5)
- fluoxetin @ SERT = 27,3 ± 9,2 (n = 3)
- desipramin @ NET = 2,74 ± 0,59 (n = 3)
Kokainanaloger som ersätter C1-tropanringpositionen och kräver sulfinimin ( N -sulfinyl-imin) kemi (innan innovationen var ohållbar) som binder till skillnad från den typiska konfigurationen vid DAT (öppen till ut) som kokain (med dess terminala D79- Y156 avstånd på 6,03 Å), eller i den atypiska (slutna till ut) konformationen av benstropinerna (3,29 Å). Även om de är närmare öppet till ut: (—)-1-metyl-kokain = 4,40 Å & (—)-1-fenyl-kokain = 4,89 Å, och uppvisar preferentiell interaktion med utåtvänd DAT-konformation, verkar de ha bristen av beteendestimulering som den stängda till ut typen. Trots att de har icke-stimulerande beteendeprofiler verkar de fortfarande ha antidepressiva beteendeprofiler.
C1-fenylanalogen är tio gånger starkare än kokain som en dopaminåterupptagspumpligand och tjugofyra gånger starkare som ett lokalbedövningsmedel (spänningsberoende Na+-kanalblockerare), medan C1-metylanalogen är 2,3 gånger mindre potent som ett lokalbedövningsmedel.
jfr. hydroxitropakokain för en naturlig alkaloid (som saknar dock karbmetoxi i 2-positionen) som är en C1-substituent med en hydroxigrupp .
2 p -substitutioner
| Strukturera |
S. Singhs alfanumeriska tilldelning (namn) |
R | DAT [ 3 H]VINN 35428 |
5-HTT [ ^ H]Paroxetin |
NETTO [ ^ H]Nisoxetin |
Selektivitet 5-HTT/DAT |
Selektivitet NET/DAT |
|---|---|---|---|---|---|---|---|

|
|||||||
| (Kokain) | Mig | 89 ± 4,8 | 1045 ± 89 | 3298 ± 293 | 11.7 | 37,0 | |
|
196a ( kokaetylen ) |
Et | 195 ± 45 | 5801 ± 493 | 10 000 ± 751 | 29,7 | 51,3 | |
| 196b | n -Pr | 196 ± 46 | 4517 ± 430 | 6124 ± 262 | 23.3 | 31.2 | |
| 196c | i -Pr | 219 ± 48 | 25224 ± 1498 | 30384 ± 1685 | 115 | 139 | |
| 196d | Ph | 112 ± 31 | 33666 ± 3330 | 31024 ± 1909 | 300 | 277 | |
| 196e | Bn | 257 ± 14 | 302 ± 23 | 20794 ± 950 | 1.2 | 80,9 | |
| 196f | p-fenetyl | 181 ± 10 | 615 ± 52 | 19944 ± 1026 | 3.4 | 110 | |
| 196g | y-fenylpropyl | 147 ± 19 | 374 ± 15 | 4893 ± 344 | 2.5 | 33.3 | |
| 196h | cinnamyl | 371 ± 15 | 368 ± 6,3 | 68931 ± 3476 | 1.0 | 186 | |
| 196i | p - N02 -p-fenetyl | 601 ± 28 | - | - | - | - | |
| 196j | p -Cl-p-fenetyl | 271 ± 12 | - | - | - | - | |
| 196k | p - NH2 -P-fenetyl | 72 ± 7 | - | - | - | - | |
| 196l | p - NCS -p-fenetyl | 196 ± 14 | - | - | - | - | |
| 196m | p - azido -p-fenetyl | 227 ± 19 | - | - | - | - | |
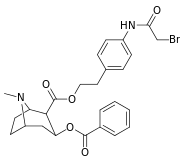
| 196n | ( p -NHCOCH2Br ) p-fenetyl | 61 ± 6 | - | - | - | - | |
| 196o | ( p - NHCO(CH2 ) 2CO2Et ) p -fenetyl | 86 ± 4 | - | - | - | - | |
 |
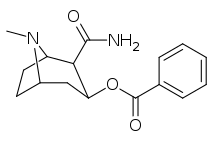
197a | NH 2 | 753 ± 41,3 | 13725 ± 1256 | 3981 ± 229 | 18.2 | 5.3 |
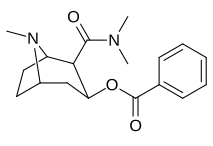
| 197b | -NMe 2 | 127 ± 6,36 | 143713 ± 8854 | 7329 ± 158 | 1131 | 57,7 | |
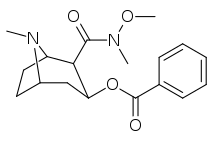
| 197c | -N(OMe)Jag | 60 ± 6,4 | 28162 ± 2565 | 3935 ± 266 | 469 | 65,6 | |
| 197d | -NHMe | 2424 ± 118 | 44798 ± 2105 | 4213 ± 206 | 18.5 | 1.7 | |
|
197e ( Bensoylecgonine ) |
-ÅH | 195 000 | - | - | - | - | |
 |
197f | HOCH 2 - | 561 ± 149 | - | - | - | - |
|
197 g ( tropakokain ) |
H | 5180 ± 1160 | - | - | - | - |
| 196a ( kokaetylen ) | 196b | 196c | 196d | 196e |
|---|---|---|---|---|
 |
 |
 |
 |
|
| 196f | 196g | 196h | 196i | 196j |
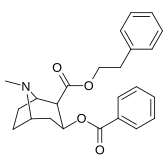 |
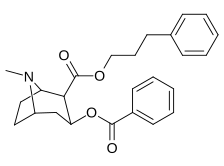 |
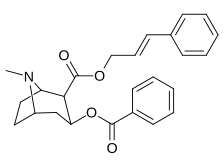 |
 |

|
| 196k | 196l | 196m | 196n | 196o |
 |
 |
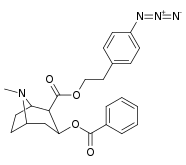 |
 |

|
| 197a | 197b | 197c | 197d | 197e |
 |
 |
 |
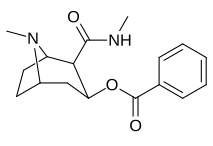 |
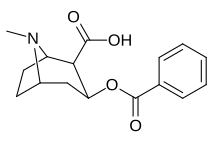
|
| 197f | 197g | |||
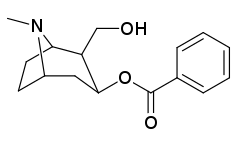 |

|
Föreningarna 196e-h har större SERT-affinitet än kokain, men har svagare NET/DAT-affiniteter (med undantag för 196g vid NET). Föreningarna 196k , 196n , 196o och 197c har alla större DAT-affinitet än kokain. Förening 197b (dimetylamid) uppvisade en 1 131-faldigt ökad selektivitet i affinitet jämfört med serotonintransportören, med endast en liten minskning av styrkan för dopamin- och noradrenalintransportörerna. Medan 197c ( Weinreb amid , N-metoxi-N-metylamid) hade en ökning på 469 gånger vid SERT , med större affinitet för DAT än kokain och en lika stor NET- affinitet. 197b var 137× och 196c 27× mindre potent när det gäller att binda till serotonintransportören, men båda hade ett NET/DAT-förhållande som gjorde att de var bättre dopaminerg än kokain. Övervägandet att stora, skrymmande C2-substituenter skulle förändra den rumsliga konformationen av tropanringsystemet genom att förvränga piperidindelen av systemet och sålunda hindra bindning förefaller vara ogrundad.
Benzoylecgonine ( 197e ) är den inaktiva primära metaboliten av kokain som genereras genom hydrolys av C2-metylestern. In vitro- bindningsstudier indikerar att bensoylekgonin är ~2 200 gånger mindre potent än kokain vid dopamintransportören, möjligen på grund av zwitterjonbildning som förhindrar stark DAT-bindning. I motsats till in vitro- studier är bristen på aktivitet som observerats i in vivo- studier sannolikt resultatet av minskad blod-hjärnbarriärpenetration än bildandet av en zwitterjon .
Bioisostere 2-position karbmetoxi-ester funktionella ersättningar
| Strukturera |
S. Singhs alfanumeriska tilldelning (namn) |
R | [ 3H ] Mazindol | [ 3H ]DA | Selektivitet Upptagning/Bindning |
|---|---|---|---|---|---|
| (Kokain) | (H) | 580 ± 70 | 570 ± 180 | 1.0 | |
|
|||||
| 198a | H | 520 ± 40 | 260 ± 70 | 0,5 | |
| 198b | CO 2 Et (5'-karboetoxi-) | 120 ± 10 | 290 ± 40 | 2.4 | |
| 198c | BOC | 2230 ± 220 | 1820 ± 810 | 0,8 | |
| 198d | Ph | 2000 ± 640 | 2920 ± 1620 | 1.5 | |
| 198e | CH=CHCO 2 Me | 3600 ± 400 | 3590 ± 1180 | 1.0 | |

|
|||||
| 199a | p( eller R ) CO2Et | 710 ± 150 | 1060 ± 340 | 1.5 | |
| 199b | a(eller S ) CO2 Et | 5830 ± 630 | 8460 ± 620 | 1.4 | |
 |
200 | 880 ± 350 | 400 ± 140 | 0,4 |
| 198a | 198b | 198c | 198d |
|---|---|---|---|
 |
 |
 |

|
| 198e | 199a | 199b | 200 |
 |
 |
 |

|
Vinyloga 2 β -position karbmetoxi-ester funktionella ersättningar
| 201a | 201b | 201c | 201d | 201e |
|---|---|---|---|---|
 |
 |
 |
 |

|
Föreningarna 201b och 201c var signifikant mer potenta än kokain medan föreningarna 201a , 201d och 201e var betydligt mindre potenta. Detta fynd indikerar att närvaron av en vätebindningsacceptor ( dvs. karbometoxi) vid 2 β -positionen inte är absolut nödvändig för att skapa kokainanaloger med hög affinitet.
| [ 2H5 - fenyl ]-kokain | HPBE | [ 2H3 - N -metyl ]-kokain |
C2-etyl-OSO 2 CF 2 kokain |
2-[(2-metoxi-2-oxoetoxi)metyl] kokain |
|---|---|---|---|---|
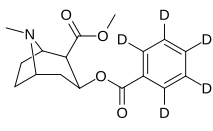 |
![Hydroxypropylbenzoylecgonine (HPBE), which imparts the topical analgesic effect in the preparation Esterom.[16]](http://upload.wikimedia.org/wikipedia/commons/thumb/a/af/Hydroxypropyl_benzoylecgonine.svg/171px-Hydroxypropyl_benzoylecgonine.svg.png) |
 |
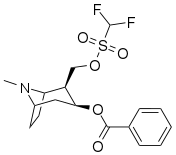 |
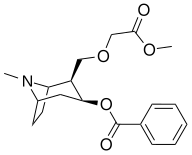
|
N -modifieringar
| Förening |
S. Singhs alfanumeriska tilldelning (namn) |
N 8- R |
[ 3 H]Mazindol- bindning |
[ 3H ]DA- upptag |
Selektivitet Upptagning/Bindning |
|---|---|---|---|---|---|
 |
217 (kokainmetiodid) |
- | 10700 ± 1530 ɑ | - | - |
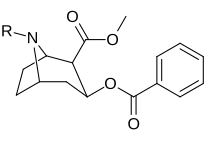 |
(Kokain) | CH 3 |
280 ± 60 102 ɑ |
320 ± 10 | 1.1 |
|
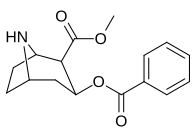
218 ( norkokain ) |
H | 303 ± 59 ɑ | - | - | |
| 219a | Bn | 668 ± 67 ɑ | - | - | |
| 219b | Ac | 3370 ± 1080 ɑ | - | - | |
| 219c | CH2CH2OH _ _ _ _ | 700 ± 100 | 1600 ± 200 | 2.3 | |
| 219d | CH 2 CO 2 CH 3 | 480 ± 40 | 1600 ± 100 | 3.3 | |
| 219e | CH 2 CO 2 H | 380 ± 20 | 2100 ± 400 | 5.5 | |
| 220a | SO 2 CH 3 ( Ms ) | 1290 ± 80 | 1970 ± 70 | 1.5 | |
| 220b | SO 2 CF 3 ( Tf ) | 330 ± 30 | 760 ± 20 | 2.3 | |
| 220c | SO 2 NCO | 120 ± 10 | 160 ± 10 | 1.3 | |
| 220d | SO 2 Ph | 20 800 ± 3 500 | 61 000 | 2.9 | |
| 220e | SO 2 C 6 H 4 -4-NO 2 ( nosyl ) | 5720 ± 1140 | 18800 ± 90 | 3.3 | |
| 220f | SO2C6H4-4 - OCH3 _ _ _ _ _ | 6820 ± 580 | 16400 ± 1400 | 2.4 | |
| 221a | NEJ | 99500 ± 12300 | 231700 ± 39500 | 2.3 | |
| 221b | NO 2 | 7500 ± 900 | 21200 ± 600 | 2.8 | |
| 221c | NHCOCH 3 | >1000000 | >1000000 | - | |
| 221d | NH 2 | - | - | - |
- ɑ IC 50 (nM) för förskjutning av [ 3 H]WIN 35428
| Norkokain (218) | 219a | 219b | 219c |
|---|---|---|---|
 |
 |
 |

|
| 219d | 219e | 220a | 220b |
 |
 |
 |

|
| 220c | 220d | 220e | 220f |
 |
 |
 |

|
| 221a | 221b | 221c | 221d |
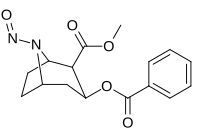 |
 |
 |
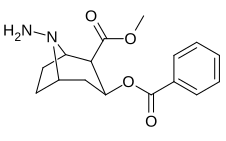
|
| N 6 Regioisomer | N 7 Regioisomer | orto -Fenyl N7 Regioisomer |
8-Oxa kokain (jfr Meltzer med PTs ) |
|---|---|---|---|
 |
 |
 |

|
Tricykliska kokainanaloger
8 till 2 tjudrade analoger
Se N -fram- och bakbryggade fenyltropaner .
| Förening |
S. Singhs alfanumeriska uppgift |
[ 3H ]Mazindol | [ 3H ]DA | Selektivitet Upptagning/Bindning |
|---|---|---|---|---|
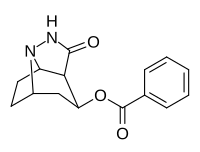 |
222 | 44900 ± 6200 | 115 000 ± 15 700 | 2.6 |
Bakbryggade kokainanaloger anses mer likna obundna kokainanaloger och fenyltropanderivat (där det ensamma kväveparet inte är fixerat eller begränsat ) och efterliknar deras affinitet bättre. Detta beror på att när den åttonde koltropanpositionen är fritt roterbar och obunden, upptar den företrädesvis den axiella positionen som definierar dess minsta energi och mest obehindrade tillstånd. I främre bryggade analoger gör de ensamma kväveparens stela fixitet att de ligger i en ekvatorial placering för piperidinringens del av tropankärnan, pekar på brohuvudet med två kol och tre metylenenheter; ger de intygade frontbryggade kokainanalogerna preferens för SERT framför DAT.
8 till 3 bundna analoger
- " N/T " = "ej testad"
Tropan ringkontraktion (azabornane) analoger
6/7 tropanposition metoxikokain & metoxipseudokokainanaloger
3 β -position 2′—(6′) & 2 β -substitutionskombinationsanaloger
- ɑ För undanträngning av [ 3H ]paroxetin (5-HTT & NET)
- b För undanträngning av [ 3H ]nisoxetin (5-HTT & NET)
| 211a | 211b | 211c | 211d | 211e |
|---|---|---|---|---|
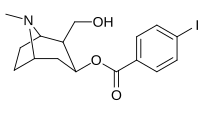 |
 |
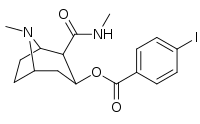 |
 |
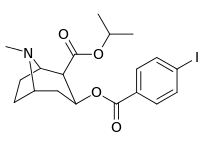
|
| 211f | 211g | 211h | 211i | 211j |
 |
 |
 |
 |
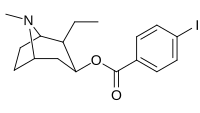
|
3 p- karbamoylanaloger
| 223a | 223b | 223c |
|---|---|---|
 |
 |

|
| 223d | 223e | 223f |
 |
 |

|
| 223g | 223h | 223i |
 |
 |

|
Fenyl 3-positionsbindningssubstitutioner
Se: Lista över fenyltropaner (Många fenyltropaner härrör från kokainmetaboliter, såsom metylekgonidin , som prekursorer . Medan helsyntetiska metoder har utarbetats från utgångsmaterialet av vinylkarbenoider och pyrroler.)
Skillnaden i längden på bensoyloxin och fenylbindningen i kontrast mellan kokain och fenyltropaner gör att avståndet mellan tyngdpunkten för den aromatiska bensenen och bryggkvävet hos tropanen i de senare PTs blir kortare. Detta avstånd är på en skala av 5,6 Å för fenyltropaner och 7,7 Å för kokain eller analoger med bensoyloxin intakt. Detta kan förklara PTs ökade beteendestimuleringsprofil jämfört med kokain. Skillnader i bindningsstyrka har också förklarats med hänsyn till solvatiseringseffekter; kokain innehållande 2 β , 3 β -estergrupper beräknas som mer solvatiserade än föreningarna av WIN-typ (dvs. troparil). Högre pKɑs för tropankvävet (8,65 för kokain, 9,55 för troparil & 11,95 för vinylanalog 43a ), minskad vattenlösning och minskad konformationsflexibilitet tillfört ökad bindningsaffinitet.
Trots observationen av ökad stimulering saknar fenyltropaner den lokalanestetiska natriumkanalblockerande effekten som bensoyloxin ger kokain. Förutom topisk påverkan ger detta kokain en affinitet för bindning till platser på de dopamin- och serotoninnatriumberoende transportområdena som är distinkta och specifika för MAT i motsats till de allmänna natriumkanalerna; skapa en separat mekanism för relationell affinitet till transportörerna utöver dess hämning av återupptaget för dessa transportörer; detta är unikt för det lokalanestetiska värdet i kokain och analoger med en liknande ersättning för bensoyloxi som lämnar förmågan att blockera natriumkanalen intakt. Att göra sådana föreningar som olika funktionellt i förhållande till MAT i kontrast till fenyltropananaloger som har lokalbedövningsbryggan borttagen. (Kräver att några av natriumjonerna pumpas från axonet via Na+/K+-ATPas ). Dessutom har det till och med postulerats att en avgörande roll för elektronenergin som tillförs via spänningssensibilisering (och därmed aktionspotentialblockering med en molekyl som kan skära sin specifika kanal, i fallet med kokain en natriumkanal , som potentiellt tjänar till att -kvantifiera dess laddning) på ett receptorbindningsställe kan försvaga det förmedlande inflytandet av den hämmande regleringen som autoreceptorer spelar genom att de saktar ner frisättningen av neurotransmittorer när ett utflöde skapas genom en instans av agonism av en förening; tillåta nämnda utflöde att fortsätta utan att kroppens försök att upprätthålla homeostas inträder på ett lika lätt känsligt sätt för dess konformationsförändring.
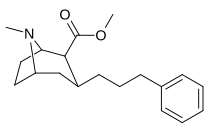
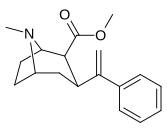
3P - Alkylfenyltropan & 3P - Alkenylanaloger
| 224a | 224b | 224c | 224d | 224e |
|---|---|---|---|---|
 |
 |
 |
 |

|
Föreningen 224e , 3p - styrenanalogen, hade den högsta styrkan i sin grupp. Medan 224b & 224c visade mest selektivitet, med 224b som hade en tio gånger större styrka för dopamintransportören än kokain.
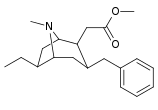
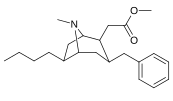
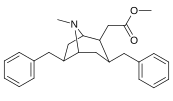
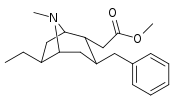
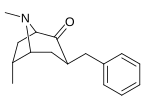
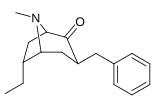
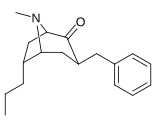
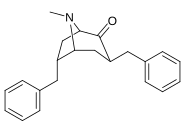
6-Alkyl-3-bensyltropananaloger
| Förening |
S. Singhs alfanumeriska tilldelning (namn/ WIN -nummer) |
R |
Ki ( nM) [ 3H ]WIN 35428 bindning |
IC50 (nM) [ 3H ]DA- upptag |
Selektivitet upptagning/bindning |
|---|---|---|---|---|---|
| Kokain |
32 ± 5 338 ± 221 |
405 ± 91 405 ± 91 |
12,6 1,2 |
||
| VINN 35065-2 |
33 ± 17 314 ± 222 |
373 ± 10 | 11.3 | ||

|
|||||
| (−)-229a | H | 33 ± 5 | 161 ± 100 | 4.9 | |
| 229a | H | 91 ± 10 | 94 ± 26 | 1.0 | |
| 229b | Mig | 211 ± 23 | - | - | |
| 229c | Et | 307 ± 28 | - | - | |
| 229d | n -Pr | 4180 ± 418 | - | - | |
| 229e | n -Bu | 8580 ± 249 | - | - | |
| 229f | Bn | 3080 ± 277 | - | - | |

|
|||||
| (+)-230a | H | 60 ± 6 | 208 ± 63 | 3.5 | |
| 230a | H | 108 ± 14 | 457 ± 104 | 4.2 | |
| 230b | Mig | 561 ± 64 | - | - | |
| 230c | Et | 1150 ± 135 | - | - | |
| 230d | n -Pr | 7240 ± 376 | - | - | |
| 230e | n -Bu | 19700 ± 350 | - | - | |
| 230f | Bn | 7590 ± 53 | - | - | |

|
|||||
| 231b | Mig | 57 ± 5 | 107 ± 36 | 1.9 | |
| 231c | Et | 3110 ± 187 | - | - | |
| 231d | n -Pr | 5850 ± 702 | - | - | |
| 231f | Bn | 1560 ± 63 | - | - | |

|
|||||
| 232b | Mig | 294 ± 29 | 532 ± 136 | 1.8 | |
| 232c | Et | 6210 ± 435 | - | - | |
| 232d | n -Pr | 57300 ± 3440 | - | - | |
| 232f | Bn | 3080 ± 277 | - | - | |
| 241 | Bn | 4830 ± 434 | - | - |
OBS! Bensylidenderivaten fungerar som syntetiska mellanprodukter för 6-Alkyl-3-bensyltropaner och har inte analyserats med avseende på biologisk aktivitet. Föreningarna 237a och 238a är samma förening eftersom båda är föräldern för båda serierna med ett väte mättat på deras respektive substitutionsställe.
Direkt 2,3-pyrimidino smält
ovan: Strobamine, en DARI-funktionell kokainanalog med strukturell sken. Jämför varianten av fusionsvarianten med funktionell grupp av fenyltropanlängd av tropan C2 och C3 . nedan: Kalkostrobamin
jfr. strobamin (till höger) för en mer effektiv förening enligt nedan.
- " NA " = "ingen affinitet", t.ex. icke kvantifierbar.
Direkt di-hetero-bensen (pyrimidino) 2,3-fusionerade och därmed stelnade kokainanaloger.
Piperidin-kokain-homologer
jfr. fenyltropanpiperidin-homologer för föreningar med en mer optimerad konformation som ger högre affiniteter vid bindning till MAT.
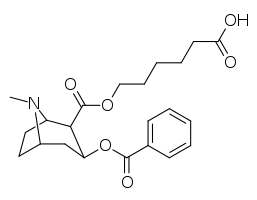
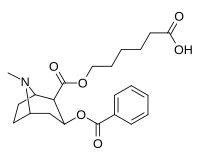
Kokainhaptenanaloger _ _
- ɑ 6-(2R,3S)-3-(bensoyloxi)-8-metyl-8-azabicyklo [3.2.1] oktan-2-karbonyloxi-hexansyra
- b 6-(2R,3S)-3-(bensoyloxi)-8-metyl-8-azabicyklo[3.2.1]oktan-2-karboxamido-hexansyra
Kokainhaptener som skapar katalytiska antikroppar kräver övergångstillstånd som påverkas in vivo . Monoklonala antikroppar genererade mot BSA -kopplad 402e accelererade kokainhydrolyshastigheten med ~23 000 gånger och eliminerade de förstärkande effekterna av kokainadministration hos råttor.
| K1-KLH/BSA | K2-KLH/BSA |
|---|---|
 |

|
Strukturella/funktionella mellananaloger
Piperidinanaloger
- JZ-IV-10 (en " Modafinil- hybrid" med nokain. jfr Lista över modafinil-analoger )
En något nyligen förekommande händelse bland trevande modern folklore som har passerat kretsloppet av rykten mestadels begränsade till universitet och populärkulturtrivia har varit att kokain är ett element, eller molekylökning av vikt eller laddning etc., bort från den molekylära strukturen hos socker. Även om ett sådant påstående är falskt som en allmän förevändning, finns det en dextrosbaserad superstruktur som har en vagt liknande överlagring med kokain som är "bensoyl- beta - D -glukosid."
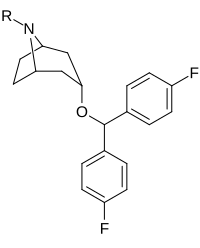
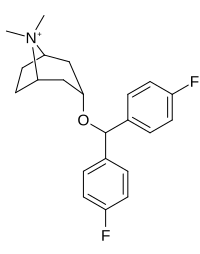
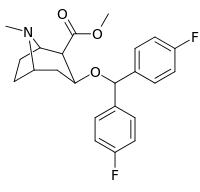
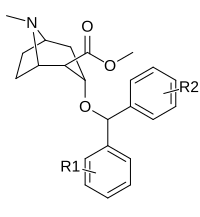
Benstropin (3a-difenylmetoxitropan) Analoger
| Förening |
S. Singhs alfanumeriska tilldelning (namn) |
R | R′ |
IC 50 (nM) DAT (bindning av [ 3 H]WIN 35428) |
IC50 (nM) 5-HTT (Bindning av [ 3H ]Citalopram ) |
Selektivitet 5-HTT/DAT |
|---|---|---|---|---|---|---|
| (benstropin) | 312 ± 1,1 | 24100 ± 14800 | 77,2 | |||
| (WIN 35428) | 12,9 ± 1,1 | 160 ± 20 | 12.4 | |||
| R -256 | 2040 ± 283 | 1460 ± 255 | 0,7 | |||
|
||||||
| S -257a | H | H | 33,5 ± 4,5 | 10100 ± 1740 | 301 | |
| S -257b | H | F | 13,2 ± 1,9 | 4930 ± 1200 | 373 | |
|
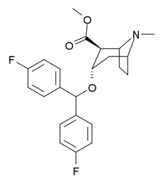
S -257c (difluoropin) |
F | F | 10,9 ± 1,2 | 3530 ± 1480 | 324 | |
| S -257d | H | Cl | 15,8 ± 0,95 | 5960 ± 467 | 377 | |
| S -257e | Cl | Cl | 91,4 ± 0,85 | 3360 ± 1480 | 36,8 | |
| S -257f | H | Br | 24,0 ± 4,6 | 5770 ± 493 | 240 | |
| S -257g | Br | Br | 72,0 ± 3,65 | 2430 ± 339 | 33,7 | |
| S -257h | H | jag | 55,9 ± 10,3 | 9280 ± 1640 | 166 | |
| S -257i | Br | jag | 389 ± 29,4 | 4930 ± 82 | 12.7 | |
| S -257j | jag | jag | 909 ± 79 | 8550 ± 442 | 9.4 | |
| S -257k | H | Mig | 49,5 ± 6,0 | 13200 | 266 | |
| S -257l | Mig | Mig | 240 ± 18,4 | 9800 ± 2680 | 40,8 |
ɑ Inhibering vid 10 μM
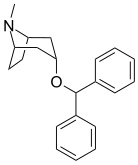
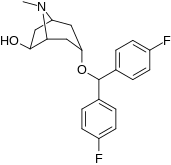
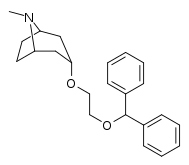
| Benzatropin | Etybensatropin | Difluoropin (O-620) | PG01053 | 276 | 277 |
|---|---|---|---|---|---|
 |
 |
 |
 |
 |

|
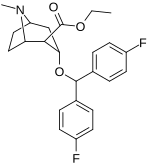
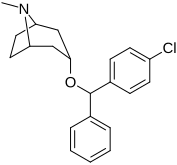
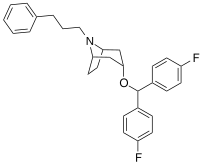
| MFZ 4-86 | MFZ 2-71 | 3-CPMT | JHW 007-d9 | GA 103 | AHN 1-055 |
 |
 |
 |
 |
 |

|
Bindningen av benstropinanaloger till DAT skiljer sig väsentligt från den för kokain och fenyltropanerna. Benstropiner anses vara "atypiska" DAT-ligander eftersom de stabiliserar DAT i en inåtvänd (stängd-till-ut) konformation, medan kokain och fenyltropanerna stabiliserar DAT i en utåtvänd (öppen-till-ut) konformation . Denna skillnad i DAT-bindning kan vara ansvarig för bristen på kokainliknande beteendeeffekter som observerats i djur- och humanstudier av benstropinanalogerna och andra "atypiska" DAT-hämmare. Studier av struktur-aktivitetsförhållandena för benstropin har visat att DAT-affinitet och selektivitet gentemot andra monoamintransportörer förstärks av 4',4'-difluorering. Modifiering av tropan-n-substituenten visade sig mildra de antikolinerga effekterna av benstropinanaloger genom att minska M1 affinitet.
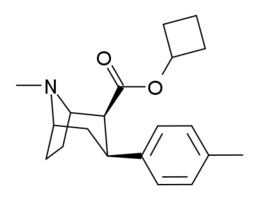
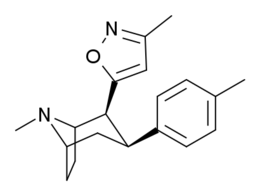
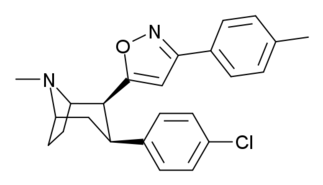
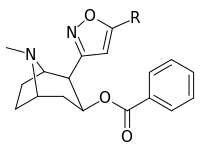
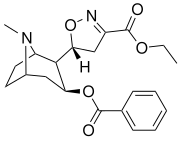
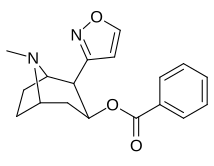
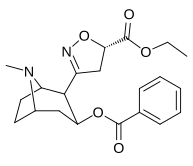
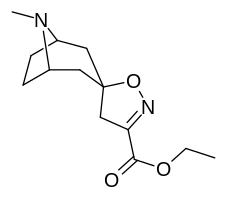
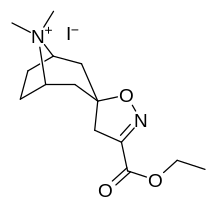
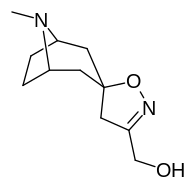
Tropanyl Isoxazoline Analoger
| 4a | 4c | 5a | 5c |
|---|---|---|---|
 |
 |
 |

|
| 6a | 6b | 6c | 7a |
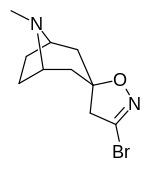 |
 |
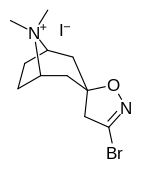 |
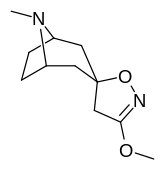
|
| 7b | 7c | 8a | 8b |
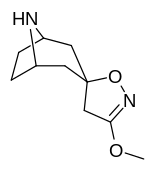 |
 |
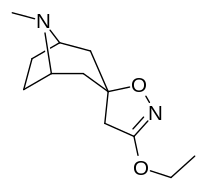 |

|
| 8c | 9a | 9b | 9c |
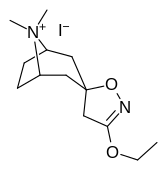 |
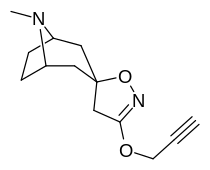 |
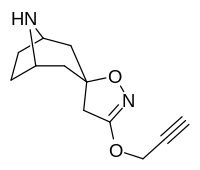 |
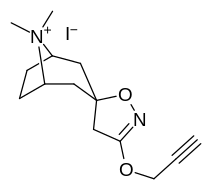
|
| 10a | 10b | 10c | 11a |
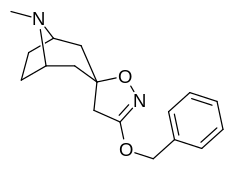 |
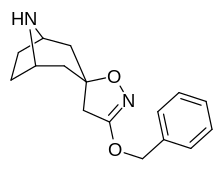 |
 |
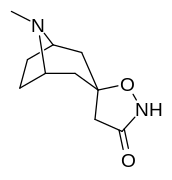
|
| 11b | 12a | 12b | |
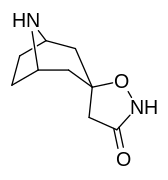 |
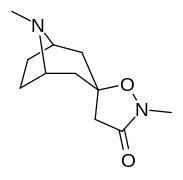 |
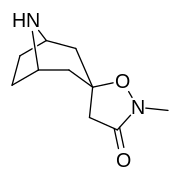
|
Förening 7a ( 3'-metoxi-8-metyl-spiro(8-azabicyklo(3.2.1)oktan-3,5'(4'H)-isoxazol) ökar allosteriskt SERT-bindning av andra återupptagsligander. Förening 7a tolkas som en potentierande allosterisk effekt (genom att avslöja tilltäppt konfigurerad serotoninupptagsområdesligandplats på transportörens yta som möjliggör bindning av exogen ligand, när SERT annars anpassas på ett övergångssätt där en SERT-ligand inte kan binda, uppstår denna effekt med föreningen i fråga ) vid koncentrationer av 10μM-30μM (där den verkar genom att interkonvertera det konformationella tillståndet hos oexponerade SERT till sådana som exponerar SSRI-bindningsstället via en förskjutning till jämvikten i MAT) samtidigt som den utövar en hämmande ortosterisk effekt när koncentrationerna når >30μM och över.
7a är den enda kända föreningen som allosteriskt modulerar SERT på ett sådant sätt under in vitro- förhållanden ( tianeptin har visat sig göra liknande, men har bara visat effektivitet i levande vävnadsprover in vivo ). Med tanke på dess icke-konkurrerande hämning av 5-HT-transportörer som minskar Vmax med liten förändring i Km för serotonin, vilket förmodat stabiliserar den cytoplasmavända konformationen av SERT: i sådant avseende anses det ha motsatt effektprofil av läkemedlet mot beroende . ibogain
(med undantag för den funktion genom vilken dess anti-beroendeframkallande egenskaper tros förmedlas, dvs. blockering av α 3 β 4 nikotinkanal. jfr . 18-Metoxicornaridin för sådan nikotinerg aktivitet utan likaledes SERT-affinitet). Förening 11a har liknande effekter, men verkar på DAT. På liknande sätt kan sådana perifera DAT-överväganden (när, som ofta anses konformationella snarare än på annat sätt förklaras som elektrostatiska) utgöra skillnaden i affinitet, genom allosertisk ockulation, mellan cyklopentyl- rutenium fenyltropan i dess skillnad från trikarbonyl-krom
Alicykliska aminanaloger
| EXP-561 | Butyltolylkinuklidin |
|---|---|
 |

|
Dihydroimidazoler
Se: Lista över Mazindol-analoger
Mazindol anses vanligtvis vara en icke-tillvänjande (hos människor och vissa andra däggdjur, men är vana för t.ex. Beagles ) tetracyklisk dopaminåterupptagshämmare (av något falsk klassificering i den förra).
Det är en löst funktionell analog som används i kokainforskning; till stor del beror på att N -etylmaleimid kan hämma ungefär 95 % av den specifika bindningen av [ 3H ]Mazindol till resterna av MAT-bindningsställena, men nämnda effekt av 10 mM N -etylmaleimid förhindrades i dess helt med bara 10 μM kokain. Medan varken 300 μM dopamin eller D -amfetamin gav tillräckligt skydd för att kontrastera effekten av kokain.
Lokalbedövningsmedel (vanligen inte CNS-stimulerande medel)
I djurstudier har vissa lokalanestetika uppvisat resterande dopaminåterupptagshämmande egenskaper, även om de normalt inte är lättillgängliga. Dessa förväntas vara mer kardiotoxiska än fenyltropaner. Till exempel har dimetokain beteendestimulerande effekter (och därför inte listat här nedan) om en dos av det tas som är 10 gånger mängden kokain. Dimetokain är ekvipotent med kokain när det gäller dess likvärdighet med anestesi. Intralipid "räddning" har visat sig vända på de kardiotoxiska effekterna av natriumkanalblockerare och antagligen även dessa effekter från kokain som administreras intravenöst också.
| namn | Andra vanliga namn |
|---|---|
| Amylokain | Stovaine |
| Articaine | Astracaine, Carticaine, Septanest, Septocaine, Ultracaine, Zorcaine |
| Bensokain | Anbesol, Lanacane, Orajel |
| Bupivakain | Marcaine, Sensorcaine, Vivacaine |
| Butacaine | Butyn |
| Kloroprokain | Nesacaine |
| Cinchocaine/Dibucaine | Cincain, Cinchocaine, Nupercainal, Nupercaine, Sovcaine |
| Cyklometikain | Surfacaine, Topocaine |
| Etidokain | Duranest |
| Eucaine | a-eukain, p-eukain |
| Fomocaine | |
| Fotocaine | |
| Hexylkain | Cyclaine, Osmocaine |
| Levobupivakain | Chirocaine |
| Lidokain/lignokain | Xylocaine, Betacain e |
| Mepivakain | Karbokain, polokain |
| Meprylcaine/Oracaine | Epirokain |
| Metabutoxikain | Primacaine |
| Phenacaine/Holocaine | Holocaine |
| Piperokain | Metycaine |
| Pramocaine/Pramoxine | Pramoxin |
| Prilokain | Citanest |
| Propoxikain/Ravokain | Pravocaine, Ranocaine, Blockaine |
| Prokain/Novokain | Borokain (prokainborat), etokain |
| Proparacaine/Alcaine | Alcaine |
| Kinisokain | Dimethisoquin |
| Risocain | Propaesin, Propazyl, Propylcain |
| Ropivakain | Naropin |
| Tetrakain/ametokain | Pontocaine, Dicaine |
| Trimekain | Mesdicain, Mesocain, Mesokain |
Se även
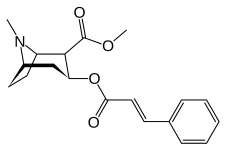
- Kokaalkaloider , de som är relaterade till kokainbiosyntesen inkluderar: bensoylekgonin, ekgonidin, ekgonin, hydroxitropakokain, metylekgonincinnamat, tropakokain och truxillin
- Kokainmetaboliter (Human) , som inkluderar: bensoylekgonin (BE), ekgoninmetylester (EME), ekgonin, norkokain, p -hydroxikokain, m -hydroxikokain, p - hydroxibensoylekgonin ( p OHBE) och m- hydroxibensoylekgonin
- Dopaminergika
- Federal Analog Act
- Farmakofor
- Farmakopé
- Farmakokinetik
- Farmakodynamik
Vanliga analoger till prototypiska D - RA :