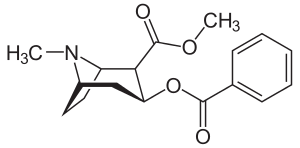
Biosyntes av kokain
Biosyntesen av kokain har länge uppmärksammats av biokemister och organiska kemister. Detta intresse motiveras delvis av de starka fysiologiska effekterna av kokain, men ett ytterligare incitament var den ovanliga bicykliska strukturen hos molekylen. Biosyntesen kan ses ske i två faser, en fas som leder till N-metylpyrroliniumringen, som bevaras i slutprodukten. Den andra fasen innehåller en C4-enhet med bildning av den bicykliska tropankärnan .
Biosyntes av N -metyl-pyrroliniumkatjon
Biosyntesen börjar med L- glutamin , som härrör från L- ornitin i växter. Rollerna som L-ornitin och L- arginin bekräftades av Edward Leete. Ornitin genomgår sedan en PLP -beroende dekarboxylering för att bilda putrescin . Hos djur ureacykeln dock putrescin från ornitin. L-ornitin omvandlas till L-arginin, som sedan dekarboxyleras via PLP för att bilda agmatin . Hydrolys av iminen erhåller N -karbamoylputrescin följt av hydrolys av urean för att bilda putrescin. De separata vägarna för att omvandla ornitin till putrescine i växter och djur har konvergerat. En SAM -beroende N -metylering av putrescin ger N -metylputrescin, som sedan genomgår oxidativ deaminering genom inverkan av diaminoxidas för att ge aminoaldehyden, som spontant cykliserar till N -metyl-Δ1- pyrroliniumkatjon.

Utöver sin roll i kokain är N -metyl-pyrroliniumkatjonen en föregångare till nikotin , hygrin , cuscohygrine och andra naturliga produkter.
Omvandling av N -metyl-pyrroliniumkatjon till tropan
De ytterligare kolatomer som krävs för syntesen av kokain härrör från acetyl-CoA, genom tillsats av två acetyl-CoA-enheter till N-metyl- Ai - pyrroliniumkatjonen . Den första tillsatsen är en Mannich -liknande reaktion med enolatanjonen från acetyl-CoA som fungerar som en nukleofil mot pyrroliniumkatjonen. Den andra tillsatsen sker genom en Claisen-kondensering. Detta ger en racemisk blandning av den 2-substituerade pyrrolidinen, med kvarhållande av tioestern från Claisen-kondensationen. Vid bildning av tropinon från racemisk etyl [2,3-13C2]4(Nmetyl-2-pyrrolidinyl)-3-oxobutanoat finns ingen preferens för någon av stereoisomererna. I biosyntesen av kokain kan emellertid endast (S)-enantiomeren cyklisera för att bilda kokainets tropanringsystem. Stereoselektiviteten hos denna reaktion undersöktes ytterligare genom studier av prokiral metylenvätediskriminering. Detta beror på det extra kirala centret vid C-2. Denna process sker genom en oxidation, som regenererar pyrroliniumkatjonen och bildandet av en enolatanjon, och en intramolekylär Mannich-reaktion. Tropanringsystemet genomgår hydrolys , SAM-beroende metylering och reduktion via NADPH för bildning av metylekgonin. Bensoyldelen av kokaindiestern syntetiseras från fenylalanin via kanelsyra . Bensoyl-CoA kombinerar sedan de två enheterna för att bilda kokain.

Kemisk syntes
Syntesen och strukturförklaringen av kokain rapporterades av Richard Willstätter 1898. Willstätters syntes härledde kokain från tropinon . Robert Robinson och Edward Leete gjorde också betydande insatser.