1,1,1-trikloretan
|
|
|||
| Namn | |||
|---|---|---|---|
|
Föredraget IUPAC-namn
1,1,1-trikloretan |
|||
| Andra namn 1,1,1-TCA, Metylkloroform, Kloroten, Lösningsmedel 111, R-140a, Genklene
|
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.688 | ||
| EG-nummer |
|
||
| 82076 | |||
| KEGG | |||
|
PubChem CID
|
|||
| RTECS-nummer |
|
||
| UNII | |||
| FN-nummer | 2831 | ||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C2H3Cl3 eller CH3CCl3 _ _ _ _ _ _ _ | |||
| Molar massa | 133,40 g/mol | ||
| Utseende | Färglös vätska | ||
| Odör | mild, kloroformliknande | ||
| Densitet | 1,32 g/cm 3 | ||
| Smältpunkt | −33 °C (−27 °F; 240 K) | ||
| Kokpunkt | 74 °C (165 °F; 347 K) | ||
|
0,4% (20°C) 0,480 g/liter vid 20°C |
|||
| Ångtryck | 100 mmHg (20°C) | ||
| Faror | |||
| Arbetssäkerhet och hälsa (OHS/OSH): | |||
|
Huvudsakliga faror
|
Ozonskiktets påverkan. Irriterar de övre luftvägarna. Orsakar svår irritation och svullnad i ögonen. | ||
| GHS- märkning : | |||

|
|||
| Varning | |||
| H332 , H420 | |||
| P261 , P271 , P304+P312 , P304+P340 , P312 , P502 | |||
| NFPA 704 (branddiamant) | |||
| Explosiva gränser | 7,5 %–12,5 % | ||
| Dödlig dos eller koncentration (LD, LC): | |||
|
LD 50 ( mediandos )
|
9600 mg/kg (oral, råtta) 6000 mg/kg (oral, mus) 5660 mg/kg (oral, kanin) |
||
|
LC 50 ( mediankoncentration )
|
3911 ppm (mus, 2 timmar) 18000 ppm (råtta, 4 timmar) |
||
| NIOSH (USA:s hälsoexponeringsgränser): | |||
|
PEL (tillåtet)
|
TWA 350 ppm (1900 mg/m 3 ) | ||
|
REL (rekommenderas)
|
C 350 ppm (1900 mg/m 3 ) [15 minuter] | ||
|
IDLH (Omedelbar fara)
|
700 ppm | ||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Den organiska föreningen 1,1,1-trikloretan , även känd som metylkloroform , är en kloroalkan med den kemiska formeln CH3CCl3 . Det är en isomer av 1,1,2-trikloretan . Denna färglösa, sötdoftande vätska tillverkades en gång industriellt i stora mängder för användning som lösningsmedel . Det regleras av Montrealprotokollet som ett ozonnedbrytande ämne och dess användning fasas snabbt ut.
Produktion
1,1,1-trikloretan rapporterades första gången av Henri Victor Regnault 1840. Industriellt produceras det vanligtvis i en tvåstegsprocess av vinylklorid . I det första steget reagerar vinylklorid med väteklorid vid 20-50 °C för att producera 1,1-dikloretan :
- CH2 = CHCl + HCl → CH3CHCl2
Denna reaktion katalyseras av en mängd olika Lewis-syror , främst aluminiumklorid , järn(III)klorid eller zinkklorid . 1,1-dikloretanen omvandlas sedan till 1,1,1-trikloretan genom reaktion med klor under ultraviolett bestrålning:
- CH3CHCl2 + Cl2 → CH3CCl3 + HCl _ _ _ _
Denna reaktion fortskrider med 80-90% utbyte, och vätekloridbiprodukten kan recirkuleras till det första steget i processen. Den huvudsakliga biprodukten är den besläktade föreningen 1,1,2-trikloretan , från vilken 1,1,1-trikloretanen kan separeras genom destillation .
En något mindre mängd 1,1,1-trikloretan produceras från reaktionen av 1,1-dikloreten och väteklorid i närvaro av en järn(III)kloridkatalysator :
- CH2 = CCl2 + HCl → CH3CCl3 _
1,1,1-trikloretan säljs med stabilisatorer eftersom det är instabilt med avseende på dehydroklorering och angriper vissa metaller. Stabilisatorer utgör upp till 8 % av formuleringen, inklusive syrafångare (epoxider, aminer) och komplexämnen .
Används
1,1,1-trikloretan anses allmänt vara ett opolärt lösningsmedel. På grund av kloratomernas goda polariserbarhet är det ett överlägset lösningsmedel för organiska föreningar som inte löser sig bra i kolväten som hexan . Det är ett utmärkt lösningsmedel för många organiska material och även ett av de minst giftiga av de klorerade kolvätena . Före Montrealprotokollet användes det i stor utsträckning för rengöring av metalldelar och kretskort , som fotoresistlösningsmedel inom elektronikindustrin , som aerosoldrivmedel , som skärvätsketillsats och som lösningsmedel för bläck, färger, lim och andra beläggningar. 1,1,1-trikloretan används också som ett insekticid gasningsmedel .
Det var också standardrengöringsmedel för fotografisk film (film/slide/negativ, etc.). Andra allmänt tillgängliga lösningsmedel skadar emulsion och bas ( aceton skadar triacetatbasen allvarligt på de flesta filmer) och är därför inte lämpliga för denna applikation. Standardersättningen, Forane 141, är mycket mindre effektiv och tenderar att lämna en rest. 1,1,1-trikloretan användes som thinner i korrigeringsvätskeprodukter som flytande papper . Många av dess applikationer använde tidigare koltetraklorid (vilket förbjöds i amerikanska konsumentprodukter 1970). I sin tur ersätts nu själva 1,1,1-trikloretanen av andra lösningsmedel i laboratoriet.
Säkerhet
Även om det inte är lika giftigt som många liknande föreningar, verkar inhalerad eller intagen 1,1,1-trikloretan som ett dämpande medel i centrala nervsystemet och kan orsaka effekter som liknar de av etanolförgiftning , inklusive yrsel , förvirring och, i tillräckligt höga koncentrationer, medvetslöshet och död. Dödliga förgiftningar och sjukdomar kopplade till avsiktlig inandning av trikloretan har rapporterats. Avlägsnandet av kemikalien från korrigeringsvätskan började på grund av att proposition 65 förklarade den som farlig och giftig.
Långvarig hudkontakt med vätskan kan leda till att fett avlägsnas från huden, vilket kan leda till hudirritation.
Atmosfärisk koncentration
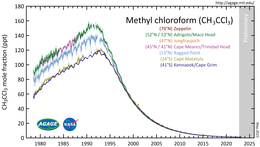
Montrealprotokollet riktade in sig på 1,1,1-trikloretan som en av de föreningar som är ansvariga för ozonnedbrytning och förbjöd dess användning med början 1996. Sedan dess har tillverkningen och användningen fasats ut i större delen av världen. Dess atmosfäriska närvaro har minskat snabbt på grund av dess relativt korta atmosfäriska livslängd på cirka 5 år.
Vidare läsning
- Doherty, RE (2000). "En historia om produktion och användning av koltetraklorid, tetrakloretylen, trikloretylen och 1,1,1-trikloretan i USA: Del 2 - Trikloretylen och 1,1,1-trikloretan". Miljökriminalteknik . 1 (2): 83–93. doi : 10.1006/enfo.2000.0011 . S2CID 97370778 .