Metylfenobarbital
 | |
| Kliniska data | |
|---|---|
| Handelsnamn | Mebaral, generika |
| AHFS / Drugs.com | Internationella läkemedelsnamn |
| MedlinePlus | a605022 |
Administreringsvägar _ |
Genom munnen ( tabletter ) |
| ATC-kod | |
| Rättslig status | |
| Rättslig status |
|
| Farmakokinetiska data | |
| Proteinbindning | 70–76 % |
| Ämnesomsättning | Lever |
| Eliminationshalveringstid _ | 34 timmar |
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard | 100.003.714 |
| Kemiska och fysikaliska data | |
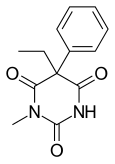
| Formel | C13H14N2O3 _ _ _ _ _ _ _ |
| Molar massa | 246,266 g·mol -1 |
| 3D-modell ( JSmol ) | |
| |
| |
Metylfenobarbital ( INN ), även känd som mefobarbital ( USAN , JAN ) och mefobarbiton ( BAN ), marknadsförs under varumärken som Mebaral , Mefyltaletten , Phemiton och Prominal , är ett läkemedel som är ett barbituratderivat och används främst som ett antikonvulsivt medel . , men också som lugnande och ångestdämpande medel . Det är den N -metylerade analogen av fenobarbital och har liknande indikationer, terapeutiskt värde och tolerabilitet.
Godkännandehistorik
- 1935 – Mebaral introducerades av Winthrop Pharmaceuticals.
- 2001 – Metylfenobarbital upphörde i Storbritannien.
- 2003 – Mebaral förvärvades av Ovation Pharmaceuticals (ett specialläkemedelsföretag som förvärvade undermarknadsförda läkemedelsprodukter).
- 2009 – Ovation förvärvades av Lundbeck , som nu marknadsför Mebaral.
- 2012 – Lundbeck meddelade att de övergav produkten i USA från och med den 6 januari 2012. Den angivna anledningen var för att "företaget grundligt utvärderade alla vägar för att hålla Mebaral tillgänglig för patienter, men slutligen drog slutsatsen att oavsett vilka steg de [dvs. Lundbeck] tog, skulle patienter tvingas övergå till en ny terapi."
Företaget uppgav vidare i ett brev på sin hemsida att enligt FDA:s initiativ för icke godkända läkemedel är FDA inte längre villiga att tillåta att läkemedlet blir farfader. En ny läkemedelsansökan skulle ha behövt lämnas in för att få marknadsföringsgodkännande, vilket skulle ha tagit uppskattningsvis fem år, under vilken tid patienter skulle behöva ändra sina terapier i alla fall. De sista tillgängliga tabletterna hade ett utgångsdatum den 31 mars 2012, och läkemedlet kommer inte längre att vara tillgängligt i USA när förråden är slut.
Överdos
Symtom på överdos av mephobarbital inkluderar förvirring, minskning av eller förlust av reflexer, somnolens , feber , irritabilitet, hypotermi, dåligt omdöme, andnöd eller långsam/besvärlig andning, långsam hjärtrytm, sluddrigt tal, svindlande, sömnsvårigheter, ovanliga rörelser. ögonen, svaghet.