Densitet
| Densitet | |
|---|---|
 Ett provrör som innehåller fyra icke-blandbara färgade vätskor med olika densiteter
| |
Vanliga symboler |
ρ , D |
| SI-enhet | kg/m 3 |
| Omfattande ? | Nej |
| Intensiv ? | Ja |
| Konserverad ? | Nej |
Härledningar från andra kvantiteter |
|
| Dimensionera | |
Densitet ( volymetrisk massdensitet eller specifik massa ) är ämnets massa per volymenhet . Den symbol som oftast används för densitet är ρ (den grekiska gemenbokstaven rho ), även om den latinska bokstaven D också kan användas . Matematiskt definieras densitet som massa dividerat med volym:
där ρ är densiteten, m är massan och V är volymen. I vissa fall (till exempel i USA:s olje- och gasindustri) definieras densiteten löst som dess vikt per volymenhet , även om detta är vetenskapligt felaktigt – denna kvantitet kallas mer specifikt specifik vikt .
För ett rent ämne har densiteten samma numeriska värde som dess masskoncentration . Olika material har vanligtvis olika densitet, och densiteten kan vara relevant för flytkraft , renhet och förpackning . Osmium och iridium är de tätaste kända grundämnena vid standardförhållanden för temperatur och tryck .
För att förenkla jämförelser av densitet över olika system av enheter, ersätts den ibland med den dimensionslösa kvantiteten " relativ densitet " eller " specifik vikt ", dvs förhållandet mellan materialets densitet och ett standardmaterial, vanligtvis vatten. En relativ densitet mindre än en i förhållande till vatten betyder alltså att ämnet flyter i vatten.
Ett materials densitet varierar med temperatur och tryck. Denna variation är vanligtvis liten för fasta ämnen och vätskor men mycket större för gaser. Att öka trycket på ett föremål minskar föremålets volym och ökar därmed dess densitet. Att höja temperaturen på ett ämne (med några få undantag) minskar dess densitet genom att öka dess volym. I de flesta material resulterar uppvärmning av botten av en vätska i konvektion av värmen från botten till toppen, på grund av minskningen av densiteten hos den uppvärmda vätskan, vilket gör att den stiger i förhållande till tätare ouppvärmt material.
Den ömsesidiga densiteten hos ett ämne kallas ibland dess specifika volym , en term som ibland används inom termodynamiken . Densitet är en intensiv egenskap genom att en ökning av mängden av ett ämne inte ökar dess densitet; snarare ökar den sin massa.
Andra konceptuellt jämförbara kvantiteter eller förhållanden inkluderar specifik densitet , relativ täthet (specifik vikt) och specifik vikt .
Historia
I en välkänd men förmodligen apokryfisk berättelse fick Arkimedes i uppdrag att avgöra om kung Hieros guldsmed förskingrade guld under tillverkningen av en gyllene krans tillägnad gudarna och ersatte den med en annan, billigare legering . Arkimedes visste att den oregelbundet formade kransen kunde krossas till en kub vars volym lätt kunde beräknas och jämföras med massan; men konungen biföll icke detta. Förbryllad sägs Arkimedes ha tagit ett nedsänkt bad och observerat från vattnets uppgång när han gick in att han kunde beräkna volymen av guldkransen genom vattnets förskjutning . Efter denna upptäckt hoppade han ur sitt bad och sprang naken genom gatorna och ropade: "Eureka! Eureka!" (Εύρηκα! grekiska "Jag har hittat det"). Som ett resultat kom termen " eureka " in i vanligt språkbruk och används idag för att indikera ett ögonblick av upplysning.
Berättelsen dök först upp i skriftlig form i Vitruvius ' arkitekturböcker , två århundraden efter att den förmodligen ägde rum. Vissa forskare har tvivlat på riktigheten i denna berättelse och sagt bland annat att metoden skulle ha krävt exakta mätningar som skulle ha varit svåra att göra vid den tiden.
Mätning av densitet
Det finns ett antal tekniker såväl som standarder för mätning av materialdensitet. Sådana tekniker inkluderar användningen av en hydrometer (en flytkraftsmetod för vätskor), hydrostatisk balans (en flytkraftsmetod för vätskor och fasta ämnen), nedsänkt kroppsmetod (en flytkraftsmetod för vätskor), pyknometer (vätskor och fasta ämnen), luftjämförelsepyknometer ( fasta ämnen), oscillerande densitometer (vätskor), samt hälla och knacka (fasta ämnen). Varje enskild metod eller teknik mäter dock olika typer av densitet (t.ex. skrymdensitet, skelettdensitet etc.), och därför är det nödvändigt att ha en förståelse för vilken typ av densitet som mäts samt vilken typ av material det är fråga om.
Enhet
Från ekvationen för densitet ( ρ = m / V ) har massdensiteten vilken enhet som helst som är massa dividerad med volymen . Eftersom det finns många enheter av massa och volym som täcker många olika magnituder finns det ett stort antal enheter för massdensitet i användning. SI - enheten för kilogram per kubikmeter (kg/m 3 ) och cgs -enheten för gram per kubikcentimeter (g/cm 3 ) är förmodligen de vanligaste enheterna för densitet. En g/cm 3 är lika med 1000 kg/m 3 . En kubikcentimeter (förkortning cc) är lika med en milliliter. Inom industrin är andra större eller mindre enheter av massa och/eller volym ofta mer praktiska och vanliga enheter i USA kan användas. Se nedan för en lista över några av de vanligaste enheterna för densitet.
Homogena material
Densiteten vid alla punkter av ett homogent föremål är lika med dess totala massa dividerat med dess totala volym. Massan mäts normalt med en våg eller våg ; volymen kan mätas direkt (från föremålets geometri) eller genom förskjutning av en vätska. För att bestämma densiteten hos en vätska eller en gas kan en hydrometer , en dasymeter eller en Coriolis-flödesmätare användas, respektive. På liknande sätt hydrostatisk vägning förskjutning av vatten på grund av ett nedsänkt föremål för att bestämma föremålets densitet.
Heterogena material
Om kroppen inte är homogen, så varierar dess densitet mellan olika delar av föremålet. I så fall bestäms densiteten runt en given plats genom att beräkna densiteten för en liten volym runt den platsen. I gränsen för en infinitesimal volym blir densiteten för ett inhomogent föremål i en punkt: där är en elementär volym vid position . Kroppens massa kan då uttryckas som
Icke-kompakta material
I praktiken innehåller bulkmaterial som socker, sand eller snö tomrum. Många material finns i naturen som flingor, pellets eller granulat.
Tomrum är regioner som innehåller något annat än det betraktade materialet. Vanligtvis är tomrummet luft, men det kan också vara vakuum, flytande, fast eller en annan gas eller gasblandning.
Bulkvolymen av ett material – inklusive tomrumsfraktionen – erhålls ofta genom en enkel mätning (t.ex. med en kalibrerad måttbägare) eller geometriskt från kända dimensioner.
Massa dividerat med bulkvolym bestämmer bulkdensiteten . Detta är inte samma sak som volymetrisk massdensitet.
För att bestämma volymetrisk massdensitet måste man först diskontera volymen av tomrumsfraktionen. Ibland kan detta bestämmas genom geometriska resonemang. För tätpackning av lika sfärer kan den icke-håliga andelen vara högst cirka 74%. Det kan också bestämmas empiriskt. Vissa bulkmaterial, såsom sand, har emellertid en variabel tomrumsandel som beror på hur materialet omrörs eller hälls. Det kan vara löst eller kompakt, med mer eller mindre luftutrymme beroende på hantering.
I praktiken är tomrumsfraktionen inte nödvändigtvis luft, eller ens gasformig. När det gäller sand kan det vara vatten, vilket kan vara fördelaktigt för mätning då tomrumsandelen för sand mättad i vatten – när väl eventuella luftbubblor väl har drivits ut – är potentiellt mer konsekvent än torr sand mätt med ett lufthålrum.
Vid icke-kompakta material måste man också vara noga med att bestämma materialprovets massa. Om materialet är under tryck (vanligtvis omgivande lufttryck på jordens yta) kan bestämning av massa från en uppmätt provvikt behöva ta hänsyn till flytkraftseffekter på grund av densiteten av den tomma beståndsdelen, beroende på hur mätningen utfördes. När det gäller torr sand är sand så mycket tätare än luft att flyteffekten vanligtvis försummas (mindre än en del av tusen).
Massförändring vid förskjutning av ett hålrumsmaterial med ett annat med bibehållande av konstant volym kan användas för att uppskatta hålrumsfraktionen, om skillnaden i densitet för de två hålrumsmaterialen är tillförlitligt känd.
Förändringar av densitet
I allmänhet kan densiteten ändras genom att ändra antingen trycket eller temperaturen . Att öka trycket ökar alltid materialets densitet. Ökning av temperaturen minskar i allmänhet densiteten, men det finns anmärkningsvärda undantag från denna generalisering. vattnets densitet mellan dess smältpunkt vid 0 °C och 4 °C; liknande beteende observeras i kisel vid låga temperaturer.
Effekten av tryck och temperatur på tätheten av vätskor och fasta ämnen är liten. Kompressibiliteten för en typisk vätska eller fast substans är 10 −6 bar −1 (1 bar = 0,1 MPa ) och en typisk termisk expansivitet är 10 −5 K −1 . Detta innebär grovt sett att man behöver cirka tiotusen gånger atmosfärstrycket för att minska volymen av ett ämne med en procent. (Även om trycket som behövs kan vara cirka tusen gånger mindre för sandjord och vissa leror.) En volymökning på en procent kräver vanligtvis en temperaturökning i storleksordningen tusentals grader Celsius .
Däremot påverkas gasernas densitet starkt av trycket. Densiteten för en idealgas är
där M är den molära massan , P är trycket, R är den universella gaskonstanten och T är den absoluta temperaturen . Detta innebär att densiteten för en idealgas kan fördubblas genom att fördubbla trycket, eller genom att halvera den absoluta temperaturen.
I fallet med volumisk termisk expansion vid konstant tryck och små temperaturintervall är temperaturberoendet av densiteten
där är densiteten vid en referenstemperatur, är materialets termiska expansionskoefficient vid temperaturer nära .
Täthet av lösningar
lösnings densitet är summan av masskoncentrationer av komponenterna i den lösningen.
Masskoncentrationen (massa) av varje given komponent ρ i i en lösning summeras till lösningens densitet,
Uttryckt som en funktion av densiteten av rena komponenter i blandningen och deras volymdeltagande tillåter det bestämning av överskottsmolära volymer :
förutsatt att det inte finns någon interaktion mellan komponenterna.
Genom att känna till förhållandet mellan överskottsvolymer och aktivitetskoefficienter för komponenterna kan man bestämma aktivitetskoefficienterna:
Tätheter
Olika material
- Utvalda kemiska grundämnen listas här. För densiteterna för alla kemiska grundämnen, se Lista över kemiska grundämnen
| Material | ρ (kg/m 3 ) | Anteckningar |
|---|---|---|
| Väte | 0,0898 | |
| Helium | 0,179 | |
| Aerografit | 0,2 | |
| Metalliskt mikrogitter | 0,9 | |
| Aerogel | 1.0 | |
| Luft | 1.2 | Vid havsnivån |
| Volframhexafluorid | 12.4 | En av de tyngsta kända gaserna vid standardförhållanden |
| Flytande väte | 70 | Vid ca. -255 °C |
| Frigolit | 75 | Cirka. |
| Kork | 240 | Cirka. |
| Tall | 373 | |
| Litium | 535 | Minst tät metall |
| Trä | 700 | Kryddat, typiskt |
| Ek | 710 | |
| Kalium | 860 | |
| Is | 916,7 | Vid temperatur < 0 °C |
| Matlagningsolja | 910–930 | |
| Natrium | 970 | |
| Vatten (färskt) | 1 000 | Vid 4 °C, temperaturen för dess maximala densitet |
| Vatten (salt) | 1 030 | 3 % |
| Flytande syre | 1,141 | Vid ca. -219 °C |
| Nylon | 1 150 | |
| Plast | 1 175 | Cirka.; för polypropen och PETE / PVC |
| Glycerol | 1 261 | |
| Tetrakloreten | 1 622 | |
| Sand | 1 600 | Mellan 1 600 och 2000 |
| Magnesium | 1,740 | |
| Beryllium | 1 850 | |
| Kisel | 2 330 | |
| Betong | 2 400 | |
| Glas | 2 500 | |
| Kvartsit | 2 600 | |
| Granit | 2 700 | |
| Gnejs | 2 700 | |
| Aluminium | 2 700 | |
| Kalksten | 2 750 | Kompakt |
| Basalt | 3 000 | |
| Dijodmetan | 3,325 | Vätska vid rumstemperatur |
| Diamant | 3 500 | |
| Titan | 4,540 | |
| Selen | 4 800 | |
| Vanadin | 6 100 | |
| Antimon | 6 690 | |
| Zink | 7 000 | |
| Krom | 7 200 | |
| Tenn | 7,310 | |
| Mangan | 7,325 | Cirka. |
| Järn | 7 870 | |
| Milt stål | 7 850 | |
| Niob | 8,570 | |
| Mässing | 8 600 | |
| Kadmium | 8 650 | |
| Kobolt | 8 900 | |
| Nickel | 8 900 | |
| Koppar | 8 940 | |
| Vismut | 9 750 | |
| Molybden | 10 220 | |
| Silver | 10 500 | |
| Leda | 11 340 | |
| Torium | 11 700 | |
| Rodium | 12 410 | |
| Merkurius | 13,546 | |
| Tantal | 16 600 | |
| Uran | 18 800 | |
| Volfram | 19 300 | |
| Guld | 19 320 | |
| Plutonium | 19 840 | |
| Renium | 21 020 | |
| Platina | 21 450 | |
| Iridium | 22 420 | |
| Osmium | 22,570 | Jordens tätaste naturliga element |
| Anmärkningar: | ||
Andra
| Entitet | ρ (kg/m 3 ) | Anteckningar |
|---|---|---|
| Interstellärt medium | 1,7 × 10 −26 | Baserat på 10 −5 väteatomer per kubikcentimeter |
| Lokalt interstellära moln | 5 × 10 −22 | Baserat på 0,3 väteatomer per kubikcentimeter |
| Interstellärt medium | 1,7 × 10 −16 | Baserat på 10 5 väteatomer per kubikcentimeter |
| Jorden _ | 5,515 | Medeldensitet. |
| Jordens inre kärna | 13 000 | Ungefär enligt listan i Earth . |
| Solens kärna | 33 000–160 000 | Cirka. |
| Vit dvärgstjärna | 2,1 × 10 9 | Cirka. |
| Atomkärnor | 2,3 × 10 17 | Beror inte starkt på kärnans storlek |
| Neutronstjärna | 1 × 10 18 |
Vatten
| Temp. (°C) | Densitet (kg/m 3 ) |
|---|---|
| −30 | 983.854 |
| −20 | 993,547 |
| −10 | 998.117 |
| 0 | 999,8395 |
| 4 | 999,9720 |
| 10 | 999,7026 |
| 15 | 999,1026 |
| 20 | 998,2071 |
| 22 | 997,7735 |
| 25 | 997,0479 |
| 30 | 995,6502 |
| 40 | 992,2 |
| 60 | 983,2 |
| 80 | 971,8 |
| 100 | 958,4 |
| Anmärkningar: | |
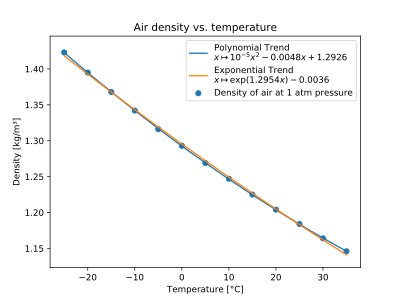
Luft
| T (°C) | ρ (kg/m 3 ) |
|---|---|
| −25 | 1,423 |
| −20 | 1,395 |
| −15 | 1,368 |
| −10 | 1,342 |
| −5 | 1,316 |
| 0 | 1,293 |
| 5 | 1,269 |
| 10 | 1,247 |
| 15 | 1,225 |
| 20 | 1,204 |
| 25 | 1,184 |
| 30 | 1,164 |
| 35 | 1,146 |
Molära volymer av flytande och fast fas av element
Gemensamma enheter
SI - enheten för densitet är:
- kilogram per kubikmeter (kg/m 3 )
Liter och ton är inte en del av SI, men är acceptabla för användning med den, vilket leder till följande enheter:
- kilogram per liter (kg/L)
- gram per milliliter (g/ml)
- ton per kubikmeter (t/m 3 )
Densiteter som använder följande metriska enheter har alla exakt samma numeriska värde, en tusendel av värdet i (kg/m 3 ). Flytande vatten har en densitet på cirka 1 kg/dm 3 , vilket gör någon av dessa SI-enheter numeriskt bekväm att använda eftersom de flesta fasta ämnen och vätskor har densiteter mellan 0,1 och 20 kg/dm 3 .
- kilogram per kubikdecimeter (kg/dm 3 )
- gram per kubikcentimeter (g/cm 3 )
- 1 g/cm 3 = 1000 kg/m 3
- megagram (metriskt ton) per kubikmeter (Mg/m 3 )
I USA sedvanliga enheter kan täthet anges i:
- Avoirdupois ounce per kubiktum (1 g/cm 3 ≈ 0,578036672 oz/cu in)
- Avoirdupois ounce per fluid ounce (1 g/cm 3 ≈ 1,04317556 oz/US fl oz = 1,04317556 lb/US fl pint)
- Avoirdupois pund per kubiktum (1 g/cm 3 ≈ 0,036127292 lb/cu in)
- pund per kubikfot (1 g/cm 3 ≈ 62,427961 lb/cu ft)
- pund per kubikyard (1 g/cm 3 ≈ 1685,5549 lb/cu yd)
- pund per amerikansk flytande gallon (1 g/cm 3 ≈ 8,34540445 lb/US gal)
- pund per amerikansk skäppa (1 g/cm 3 ≈ 77,6888513 lb/bu)
- snigel per kubikfot
Imperialistiska enheter som skiljer sig från ovanstående (eftersom den kejserliga gallonen och skäppan skiljer sig från de amerikanska enheterna) används i praktiken sällan, även om de finns i äldre dokument. Den kejserliga gallonen baserades på konceptet att ett kejserligt fluiduns vatten skulle ha en massa av ett Avoirdupois ounce, och faktiskt 1 g/cm 3 ≈ 1,00224129 ounces per Imperial fluid ounce = 10,0224129 pounds per Imperial gallon. Densiteten av ädla metaller kan tänkas vara baserad på Troy uns och pund, en möjlig orsak till förvirring.
Genom att känna till volymen av enhetscellen av ett kristallint material och dess formelvikt (i dalton ), kan densiteten beräknas. En dalton per kubik ångström är lika med en densitet på 1,660 539 066 60 g/cm 3 .
Se även
- Densitet av elementen (datasida)
- Lista över grundämnen efter densitet
- Luftdensitet
- Ytdensitet
- Bulkdensitet
- Bärighet
- Laddningsdensitet
- Densitetsförutsägelse med Girolami-metoden
- Dord
- Energi densitet
- Lättare än luft
- Linjär densitet
- Taltäthet
- Ortobar densitet
- Pappersdensitet
- Specifik vikt
- Spice (oceanografi)
- Standard temperatur och tryck
externa länkar
- . Encyclopædia Britannica . Vol. 8 (11:e upplagan). 1911.
- . . 1914.
- Video: Densitetsexperiment med olja och alkohol
- Video: Densitetsexperiment med whisky och vatten
- Glasdensitetsberäkning – Beräkning av densiteten hos glas vid rumstemperatur och för glassmältning vid 1000 – 1400°C
- Lista över grundämnen i det periodiska systemet – sorterade efter densitet
- Beräkning av mättade vätskedensiteter för vissa komponenter
- Fältdensitetstest
- Vatten – Densitet och specifik vikt
- Temperaturberoende av vattnets densitet – Omvandlingar av densitetsenheter
- Ett läckert densitetsexperiment
- Vattentäthetsberäknare Arkiverad 13 juli 2011 på Wayback Machine Vattendensitet för en given salthalt och temperatur.
- Vätskedensitetsräknare Välj en vätska från listan och beräkna densiteten som en funktion av temperaturen.
- Kalkylator för gasdensitet Beräkna densiteten för en gas som en funktion av temperatur och tryck.
- Densiteter av olika material.
- Bestämning av densitet av fast material , instruktioner för att utföra klassrumsexperiment.
- Lam EJ, Alvarez MN, Galvez ME, Alvarez EB (2008). "En modell för beräkning av densiteten av vattenhaltiga flerkomponentelektrolytlösningar" . Journal of the Chilean Chemical Society . 53 (1): 1393–8. doi : 10.4067/S0717-97072008000100015 .
- Radović IR, Kijevčanin ML, Tasić AŽ, Djordjević BD, Šerbanović SP (2010). "Härledda termodynamiska egenskaper hos blandningar av alkohol + cyklohexylamin". Journal of the Serbian Chemical Society . 75 (2): 283–293. CiteSeerX 10.1.1.424.3486 . doi : 10.2298/JSC1002283R .