Etanol
|
|
|||
|
|
|||

|
|||
| Namn | |||
|---|---|---|---|
| Uttal | / ˈ ɛ θ ə n ɒ l / | ||
|
Föredraget IUPAC-namn
Etanol |
|||
| Andra namn absolut alkohol alkohol Köln sprit dricka alkohol etylalkohol EtOH etylalkohol etylhydrat etylhydroxid etylol korn alkohol hydroxietan metylkarbinol |
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| 3DMet | |||
| 1718733 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.526 | ||
| 787 | |||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
| FN-nummer | FN 1170 | ||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C2H6O _ _ _ _ | |||
| Molar massa | 46,069 g·mol -1 | ||
| Utseende | Färglös vätska | ||
| Odör | vinliknande, stickande | ||
| Densitet | 0,78945 g/cm 3 (vid 20 °C) | ||
| Smältpunkt | −114,14 ± 0,03 °C (−173,45 ± 0,05 °F; 159,01 ± 0,03 K) | ||
| Kokpunkt | 78,23 ± 0,09 °C (172,81 ± 0,16 °F; 351,38 ± 0,09 K) | ||
| Blandbar | |||
| log P | −0,18 | ||
| Ångtryck | 5,95 kPa (vid 20 °C) | ||
| Surhet (p K a ) | 15,9 (H2O ) , 29,8 (DMSO) | ||
| −33,60·10 −6 cm 3 /mol | |||
|
Brytningsindex ( n D )
|
1,3611 | ||
| Viskositet | 1,2 mPa·s (vid 20 °C), 1,074 mPa·s (vid 25 °C) | ||
| 1,69 D | |||
| Faror | |||
| GHS- märkning : | |||
 
|
|||
| Fara | |||
| H225 , H319 | |||
| P210 , P233 , P240 , P241 , P242 , P305+P351+P338 | |||
| NFPA 704 (branddiamant) | |||
| Flampunkt | 14 °C (Absolut) | ||
| Dödlig dos eller koncentration (LD, LC): | |||
|
LD 50 ( mediandos )
|
7340 mg/kg (oral, råtta) 7300 mg/kg (mus) |
||
| NIOSH (USA:s hälsoexponeringsgränser): | |||
|
PEL (tillåtet)
|
TWA 1000 ppm (1900 mg/m 3 ) | ||
|
REL (rekommenderas)
|
TWA 1000 ppm (1900 mg/m 3 ) | ||
|
IDLH (Omedelbar fara)
|
ND | ||
| Säkerhetsdatablad (SDS) | |||
| Besläktade föreningar | |||
|
Besläktade föreningar
|
Etan Metanol |
||
| Kompletterande datasida | |||
| Etanol (datasida) | |||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Etanol (förkortning EtOH ; även kallad etylalkohol , spannmålsalkohol , dricksprit eller helt enkelt alkohol ) är en organisk förening . Det är en alkohol med den kemiska formeln C 2 H 6 O . Dess formel kan också skrivas som CH 3 −CH 2 −OH eller C 2 H 5 OH (en etylgrupp kopplad till en hydroxylgrupp ). Etanol är en flyktig , brandfarlig , färglös vätska med en karakteristisk vinliknande lukt och skarp smak. Det är en psykoaktiv rekreationsdrog och den aktiva ingrediensen i alkoholhaltiga drycker .
Etanol produceras naturligt genom jäsningsprocessen av sockerarter av jäst eller via petrokemiska processer såsom etylenhydratisering . Historiskt har det använts som ett allmänt bedövningsmedel och har moderna medicinska tillämpningar som ett antiseptiskt medel , desinfektionsmedel , lösningsmedel för vissa mediciner och motgift mot metanolförgiftning och etylenglykolförgiftning . Det används som ett kemiskt lösningsmedel och i syntesen av organiska föreningar och som bränslekälla . Etanol kan också dehydreras för att göra eten, ett viktigt kemiskt råmaterial. Från och med 2006 var världsproduktionen av etanol 51 gigaliter (1,3 × 10 10 amerikanska gallon), mestadels från Brasilien och USA
Etymologi
Etanol är det systematiska namnet definierat av International Union of Pure and Applied Chemistry för en förening som består av en alkylgrupp med två kolatomer ( prefix "eth-"), som har en enkelbindning mellan dem (infix "-an-") och en bunden −OH funktionell grupp (suffixet "-ol").
Prefixet "eth-" och beteckningen "etyl" i "etylalkohol" kommer ursprungligen från namnet "etyl" som 1834 tilldelades gruppen C
2 H
5 − av Justus Liebig . Han myntade ordet från det tyska namnet Aether av föreningen C
2 H
5 −O− C
2 H
5 (vanligen kallad "ether" på engelska , mer specifikt kallad " diethyl ether "). Enligt Oxford English Dictionary är Ethyl en sammandragning av det antika grekiska αἰθήρ ( aithḗr , " överluft") och det grekiska ordet ὕλη ( hýlē , "substans").
Namnet etanol myntades som ett resultat av en resolution om namngivning av alkoholer och fenoler som antogs vid den internationella konferensen om kemisk nomenklatur som hölls i april 1892 i Genève, Schweiz.
Termen alkohol hänvisar nu till en bredare klass av ämnen i keminomenklaturen, men i vanligt språkbruk är det fortfarande namnet på etanol. Det är ett medeltida lån från arabiska al-kuḥl , en pulveriserad malm av antimon som använts sedan antiken som kosmetika, och behållit den betydelsen på mellanlatin . Användningen av "alkohol" för etanol (i sin helhet, "alkohol av vin") är modern och registrerades först 1753. Före slutet av 1700-talet hänvisade termen "alkohol" i allmänhet till alla sublimerade ämnen.
Används
Medicinsk
Bedövningsmedel
Etanol är det äldsta kända lugnande medlet , som användes som ett oralt allmänbedövningsmedel under operation i det antika Mesopotamien och under medeltiden . Mild berusning börjar vid en alkoholkoncentration i blodet på 0,03-0,05 % och inducerar anestesikoma vid 0,4 %. Denna användning innebar dock den höga risken för dödlig alkoholförgiftning och lungaspiration vid kräksjuka, vilket ledde till användning av alternativ i antiken, såsom opium och cannabis , och senare dietyleter från och med 1840-talet.
Antiseptisk
Etanol används i medicinska våtservetter och oftast i antibakteriella handdesinfektionsgeler som ett antiseptiskt medel för dess bakteriedödande och svampdödande effekter. Etanol dödar mikroorganismer genom att lösa upp deras membranlipiddubbelskikt och denaturera deras proteiner , och är effektivt mot de flesta bakterier , svampar och virus . Det är dock ineffektivt mot bakteriesporer , men det kan lindras genom att använda väteperoxid . En lösning med 70 % etanol är effektivare än ren etanol eftersom etanol är beroende av vattenmolekyler för optimal antimikrobiell aktivitet. Absolut etanol kan inaktivera mikrober utan att förstöra dem eftersom alkoholen inte helt kan tränga igenom mikrobens membran. Etanol kan också användas som ett desinfektionsmedel och antiseptisk eftersom det orsakar celluttorkning genom att störa den osmotiska balansen över cellmembranet, så att vatten lämnar cellen vilket leder till celldöd.
Motgift
Etanol kan administreras som ett motgift mot etylenglykolförgiftning och metanolförgiftning . Etanol tjänar denna process genom att fungera som en konkurrerande hämmare mot metanol och etylenglykol för alkoholdehydrogenas . Även om det har fler biverkningar, är etanol billigare och mer lättillgängligt än fomepizol , som också används som ett motgift mot metanol- och etylenglykolförgiftning.
Läkemedelslösningsmedel
Etanol, ofta i höga koncentrationer, används för att lösa upp många vattenolösliga mediciner och relaterade föreningar. Flytande preparat av smärtstillande mediciner , host- och förkylningsmediciner och munvatten, till exempel, kan innehålla upp till 25 % etanol och kan behöva undvikas hos personer med biverkningar på etanol såsom alkoholinducerade andningsreaktioner . Etanol finns huvudsakligen som ett antimikrobiellt konserveringsmedel i över 700 flytande läkemedelsberedningar, inklusive paracetamol , järntillskott , ranitidin , furosemid , mannitol , fenobarbital , trimetoprim/sulfametoxazol och receptfria hostmediciner .
Farmakologi
Hos däggdjur metaboliseras etanol främst i levern och magen av alkoholdehydrogenas (ADH) enzymer. Dessa enzymer katalyserar oxidationen av etanol till acetaldehyd (etanal):
- CH3CH2OH + NAD + → CH3CHO + NADH + H + _
När den förekommer i betydande koncentrationer, underlättas denna metabolism av etanol dessutom av cytokrom P450- enzymet CYP2E1 hos människor, medan spårmängder också metaboliseras av katalas .
Den resulterande mellanprodukten, acetaldehyd, är ett känt cancerframkallande ämne och utgör betydligt större toxicitet hos människor än etanol i sig. Många av de symtom som vanligtvis förknippas med alkoholförgiftning - liksom många av de hälsorisker som vanligtvis är förknippade med långvarig konsumtion av etanol - kan tillskrivas acetaldehydtoxicitet hos människor.
Den efterföljande oxidationen av acetaldehyd till acetat utförs av aldehyddehydrogenas (ALDH) enzymer. En mutation i ALDH2-genen som kodar för en inaktiv eller dysfunktionell form av detta enzym påverkar ungefär 50 % av befolkningen i östra Asien, vilket bidrar till den karakteristiska alkoholspolningsreaktionen som kan orsaka tillfällig rodnad av huden såväl som ett antal relaterade och ofta obehagliga, symtom på acetaldehydtoxicitet. Denna mutation åtföljs vanligtvis av en annan mutation i alkoholdehydrogenasenzymet ADH1B i ungefär 80 % av östasiater, vilket förbättrar den katalytiska effektiviteten för att omvandla etanol till acetaldehyd .
Rekreation
Som ett medel som dämpar centrala nervsystemet är etanol en av de vanligaste psykoaktiva drogerna .
Trots alkoholens psykoaktiva och cancerframkallande egenskaper är den lättillgänglig och laglig till försäljning i de flesta länder. Det finns dock lagar som reglerar försäljning, export/import, beskattning, tillverkning, konsumtion och innehav av alkoholhaltiga drycker. Den vanligaste förordningen är förbud för minderåriga.
Bränsle

Motorbränsle
| Bränsletyp | MJ/L | MJ/kg |
Forskning oktantal _ |
|---|---|---|---|
| Torrt trä (20 % fukt) | ~19.5 | ||
| Metanol | 17.9 | 19.9 | 108,7 |
| Etanol | 21.2 | 26.8 | 108,6 |
|
E85 (85 % etanol, 15 % bensin) |
25.2 | 33.2 | 105 |
| Flytande naturgas | 25.3 | ~55 | |
|
Autogas ( LPG ) (60 % propan + 40 % butan ) |
26.8 | 50 | |
|
Flygbensin (högoktanig bensin, inte flygbränsle) |
33,5 | 46,8 | 100/130 (mager/rik) |
|
Gasohol (90 % bensin + 10 % etanol) |
33,7 | 47,1 | 93/94 |
| Vanlig bensin/bensin | 34,8 | 44,4 | min. 91 |
| Premium bensin/bensin | max. 104 | ||
| Diesel | 38,6 | 45,4 | 25 |
| Träkol , extruderad | 50 | 23 |
Den största enskilda användningen av etanol är som motorbränsle och bränsletillsats . Särskilt Brasilien är starkt beroende av användningen av etanol som motorbränsle, delvis på grund av dess roll som en av världens ledande tillverkare av etanol. Bensin som säljs i Brasilien innehåller minst 25 % vattenfri etanol. Vattenhaltig etanol (cirka 95 % etanol och 5 % vatten) kan användas som bränsle i mer än 90 % av nya bensindrivna bilar som säljs i landet.
USA och många andra länder använder i första hand E10 (10 % etanol, ibland känd som gasohol) och E85 (85 % etanol) etanol/bensinblandningar. Med tiden tror man att en väsentlig del av marknaden på ≈150 miljarder US-gallon (570 000 000 m 3 ) per år för bensin kommer att börja ersättas med bränsleetanol.

Australisk lag begränsar användningen av ren etanol från sockerrörsavfall till 10 % i bilar. Äldre bilar (och veteranbilar utformade för att använda ett långsammare brinnande bränsle) bör ha motorventilerna uppgraderas eller bytas ut.
Enligt en branschorganisation , minskar etanol som bränsle skadliga avgasutsläpp av kolmonoxid, partiklar, kväveoxider och andra ozonbildande föroreningar. Argonne National Laboratory analyserade utsläppen av växthusgaser från många olika motor- och bränslekombinationer och fann att biodiesel /petrodieselblandning ( B20 ) visade en minskning med 8 %, konventionell E85 etanolblandning en minskning med 17 % och cellulosaetanol 64 %, jämfört med ren bensin. Etanol har ett mycket högre forskningsoktantal (RON) än bensin, vilket betyder att det är mindre benäget att antändas, vilket möjliggör bättre antändning, vilket betyder mer vridmoment och effektivitet förutom de lägre koldioxidutsläppen.
Etanolförbränning i en förbränningsmotor ger många av produkterna från ofullständig förbränning som produceras av bensin och betydligt större mängder formaldehyd och besläktade arter såsom acetaldehyd. Detta leder till en betydligt större fotokemisk reaktivitet och mer marknära ozon . Dessa data har sammanställts i The Clean Fuels Reports jämförelse av bränsleutsläpp och visar att etanolavgaser genererar 2,14 gånger så mycket ozon som bensinavgaser. När detta läggs till i det anpassade Localized Pollution Index (LPI) i The Clean Fuels Report, får den lokala föroreningen av etanol (föroreningar som bidrar till smog) betyget 1,7, där bensin är 1,0 och högre siffror betyder större föroreningar. California Air Resources Board formaliserade denna fråga 2008 genom att erkänna kontrollstandarder för formaldehyder som en kontrollgrupp för utsläpp, ungefär som de konventionella NOx och reaktiva organiska gaserna (ROG).
Mer än 20 % av de brasilianska bilarna kan använda 100 % etanol som bränsle, vilket inkluderar motorer med enbart etanol och flexbränslemotorer . Flexbränslemotorer i Brasilien kan fungera med all etanol, all bensin eller en blandning av båda. I USA kan flexbränslefordon köras på 0 % till 85 % etanol (15 % bensin) eftersom högre etanolblandningar ännu inte är tillåtna eller effektiva. Brasilien stödjer denna flotta av etanolförbrännande bilar med stor nationell infrastruktur som producerar etanol från inhemskt odlat sockerrör.
Etanols höga blandbarhet med vatten gör den olämplig för transport genom moderna rörledningar som flytande kolväten. Mekaniker har sett ökade fall av skador på små motorer (särskilt förgasaren) och tillskriver skadorna till den ökade vattenretentionen av etanol i bränsle.
Raketbränsle
Etanol användes vanligen som bränsle i tidiga tvådrivna raketfordon (vätskedrivna), i samband med ett oxidationsmedel som flytande syre. Den tyska ballistiska raketen A-4 från andra världskriget (bättre känd under sitt propagandanamn V-2 ), som anses ha börjat rymdåldern, använde etanol som huvudbeståndsdelen i B-Stoff . Under en sådan nomenklatur blandades etanolen med 25 % vatten för att reducera förbränningskammarens temperatur. V -2:s designteam hjälpte till att utveckla amerikanska raketer efter andra världskriget, inklusive den etanoldrivna Redstone-raketen som sköt upp den första amerikanska satelliten. Alkoholer föll i allmän användning när mer energitäta raketbränslen utvecklades, även om etanol för närvarande används i lätta raketdrivna racingflygplan .
Bränsleceller
Kommersiella bränsleceller arbetar på reformerad naturgas, väte eller metanol. Etanol är ett attraktivt alternativ på grund av dess breda tillgänglighet, låga kostnad, höga renhet och låga toxicitet. Det finns ett brett utbud av bränslecellskoncept som har gått in i försök, inklusive direkt-etanolbränsleceller , autotermiska reformeringssystem och termiskt integrerade system. Huvuddelen av arbetet bedrivs på forskningsnivå även om det finns ett antal organisationer i början av kommersialiseringen av etanolbränsleceller.
Hushållsuppvärmning och matlagning
Etanol eldstäder kan användas för uppvärmning av hem eller för dekoration. Etanol kan också användas som spisbränsle för matlagning.
Råmaterial
Etanol är en viktig industriell ingrediens. Det har utbredd användning som en prekursor för andra organiska föreningar som etylhalider , etylestrar , dietyleter, ättiksyra och etylaminer .
Lösningsmedel
Etanol anses vara ett universellt lösningsmedel , eftersom dess molekylära struktur möjliggör upplösning av både polära , hydrofila och opolära , hydrofoba föreningar. Eftersom etanol också har en låg kokpunkt är den lätt att ta bort från en lösning som har använts för att lösa upp andra föreningar, vilket gör den till ett populärt extraktionsmedel för botaniska oljor. Metoder för extraktion av cannabisolja använder ofta etanol som ett extraktionslösningsmedel, och även som ett efterbearbetningslösningsmedel för att avlägsna oljor, vaxer och klorofyll från lösningen i en process som kallas vinterisering .
Etanol finns i färger , tinkturer , markörer och personliga vårdprodukter som munvatten, parfymer och deodoranter. Polysackarider fälls ut från vattenlösning i närvaro av alkohol, och etanolfällning används av denna anledning vid rening av DNA och RNA .
Lågtemperatur vätska
På grund av dess låga fryspunkt på -114 °C (−173 °F) och låga toxicitet, används etanol ibland i laboratorier (med torris eller andra kylmedel) som ett kylbad för att hålla kärlen vid temperaturer under vattnets fryspunkt . Av samma anledning används den också som den aktiva vätskan i alkoholtermometrar .
Kemi
Kemisk formel
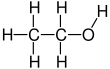
Etanol är en 2-kol alkohol. Dess molekylformel är CH 3 CH 2 OH. En alternativ beteckning är CH 3 −CH 2 −OH, vilket indikerar att kolet i en metylgrupp (CH 3 −) är förbundet med kolet i en metylengrupp (−CH 2 –), som är förbundet med syret i en hydroxylgrupp (-OH). Det är en konstitutionell isomer av dimetyleter . Etanol förkortas ibland som EtOH , med den vanliga organisk kemi beteckningen att representera etylgruppen (C 2 H 5 -) med Et .
Fysikaliska egenskaper
Etanol är en flyktig, färglös vätska som har en lätt lukt. Den brinner med en rökfri blå låga som inte alltid syns i normalt ljus. Etanolens fysikaliska egenskaper härrör främst från närvaron av dess hydroxylgrupp och kortheten i dess kolkedja. Etanols hydroxylgrupp kan delta i vätebindning, vilket gör den mer viskös och mindre flyktig än mindre polära organiska föreningar med liknande molekylvikt, såsom propan .
Etanols adiabatiska flamtemperatur för förbränning i luft är 2082 °C eller 3779 °F.
Etanol är något mer brytningsaktivt än vatten, med ett brytningsindex på 1,36242 (vid λ=589,3 nm och 18,35 °C eller 65,03 °F). Trippelpunkten för etanol är 150 K vid ett tryck på 4,3 × −4 Pa 10 .
Lösningsmedelsegenskaper
Etanol är ett mångsidigt lösningsmedel, blandbart med vatten och med många organiska lösningsmedel, inklusive ättiksyra , aceton , bensen , koltetraklorid , kloroform , dietyleter, etylenglykol , glycerol , nitrometan , pyridin och toluen . Dess huvudsakliga användning som lösningsmedel är att göra tinktur av jod, hostsaft, etc. Det är också blandbart med lätta alifatiska kolväten, såsom pentan och hexan , och med alifatiska klorider såsom trikloretan och tetrakloretylen .
Etanols blandbarhet med vatten står i kontrast till oblandbarheten hos alkoholer med längre kedja (fem eller fler kolatomer), vars blandbarhet med vatten minskar kraftigt när antalet kol ökar. Blandbarheten av etanol med alkaner är begränsad till alkaner upp till undekan : blandningar med dodekan och högre alkaner visar ett blandbarhetsgap under en viss temperatur (ca 13 °C för dodekan). Blandbarhetsgapet tenderar att bli bredare med högre alkaner, och temperaturen för fullständig blandbarhet ökar.
Etanol-vattenblandningar har mindre volym än summan av deras individuella komponenter vid de givna fraktionerna. Att blanda lika volymer etanol och vatten resulterar i endast 1,92 volymer blandning. Att blanda etanol och vatten är exotermt , med upp till 777 J/mol som frigörs vid 298 K.
Blandningar av etanol och vatten bildar en azeotrop vid cirka 89 molprocent etanol och 11 molprocent vatten eller en blandning av 95,6 viktprocent etanol (eller cirka 97 volymprocent alkohol ) vid normalt tryck, som kokar vid 351 K (78) °C). Denna azeotropa sammansättning är starkt temperatur- och tryckberoende och försvinner vid temperaturer under 303 K.
Vätebindning gör att ren etanol är hygroskopisk till den grad att den lätt absorberar vatten från luften. Hydroxylgruppens polära natur gör att etanol löser upp många joniska föreningar, särskilt natrium- och kaliumhydroxider , magnesiumklorid , kalciumklorid , ammoniumklorid , ammoniumbromid och natriumbromid . Natrium- och kaliumklorider är svagt lösliga i etanol. Eftersom etanolmolekylen också har en opolär ände, kommer den också att lösa opolära ämnen, inklusive de flesta eteriska oljor och många smakämnen, färgämnen och läkemedel.
Tillsatsen av till och med några få procent etanol till vattnet minskar ytspänningen på vattnet kraftigt. Denna egenskap förklarar delvis fenomenet " vintårar ". När vin snurras i ett glas, avdunstar etanol snabbt från den tunna vinfilmen på glasets vägg. När vinets etanolhalt minskar ökar dess ytspänning och den tunna filmen "pärlar sig" och rinner ner i glaset i kanaler snarare än som en slät plåt.
Brandfarlighet
En etanol-vattenlösning kommer att fatta eld om den värms över en temperatur som kallas dess flampunkt och en antändningskälla appliceras på den. För 20 viktprocent alkohol (cirka 25 volymprocent) sker detta vid cirka 25 °C (77 °F). Flampunkten för ren etanol är 13 °C (55 °F), men kan påverkas mycket lite av atmosfärisk sammansättning som tryck och fuktighet. Etanolblandningar kan antändas under medelrumstemperatur. Etanol anses vara en brandfarlig vätska (klass 3 farligt material) i koncentrationer över 2,35 viktprocent (3,0 volymprocent; 6 bevis ).
|
Etanol massfraktion , % |
Temperatur | |
|---|---|---|
| °C | °F | |
| 1 | 84,5 | 184,1 |
| 2 | 64 | 147 |
| 2,35 | 60 | 140 |
| 3 | 51,5 | 124,7 |
| 5 | 43 | 109 |
| 6 | 39,5 | 103.1 |
| 10 | 31 | 88 |
| 20 | 25 | 77 |
| 30 | 24 | 75 |
| 40 | 21.9 | 71.4 [ citat behövs ] |
| 50 | 20 | 68 |
| 60 | 17.9 | 64.2 [ citat behövs ] |
| 70 | 16 | 61 |
| 80 | 15.8 | 60,4 |
| 90 | 14 | 57 |
| 100 | 12.5 | 54,5 |
Rätter som använder brinnande alkohol för kulinariska effekter kallas flambé .
Naturlig förekomst
Etanol är en biprodukt av den metaboliska processen av jäst. Som sådan kommer etanol att finnas i alla jästmiljöer. Etanol kan vanligtvis hittas i övermogen frukt. Etanol som produceras av symbiotisk jäst kan hittas i bertampalmblommor . Även om vissa djurarter, som t.ex. pentailed treeshrew , uppvisar etanolsökande beteenden, visar de flesta inget intresse eller undvikande av matkällor som innehåller etanol. Etanol produceras också under groningen av många växter som ett resultat av naturlig anaerobios . Etanol har upptäckts i yttre rymden och bildar en isig beläggning runt dammkorn i interstellära moln . Minsta kvantiteter (i genomsnitt 196 ppb ) av endogen etanol och acetaldehyd hittades i utandningsluften hos friska frivilliga. Auto-brewery syndrome , även känt som gut fermentation syndrome, är ett sällsynt medicinskt tillstånd där berusande mängder etanol produceras genom endogen jäsning i matsmältningssystemet .
Produktion
Etanol framställs både som petrokemikalie , genom hydratisering av eten och, via biologiska processer, genom att jäsa sockerarter med jäst . Vilken process som är mer ekonomisk beror på rådande priser på petroleum och spannmålsfoder.
Källor
Världsproduktionen av etanol 2006 var 51 gigaliter (1,3 × 10 10 US gal), med 69 % av världstillförseln från Brasilien och USA:s brasiliansk etanol tillverkas av sockerrör , som har relativt hög avkastning (830 % mer bränsle än fossila bränslen som används för att producera det) jämfört med vissa andra energigrödor . Sockerrör har inte bara en högre koncentration av sackaros än majs (med cirka 30%), utan är också mycket lättare att extrahera. Bagasset som genereras av processen kasseras inte, utan bränns av kraftverk för att producera elektricitet . Förbränning av bagass står för cirka 9 % av den el som produceras i Brasilien.
På 1970-talet tillverkades den mesta industriella etanolen i USA som en petrokemikalie, men på 1980-talet införde USA subventioner för majsbaserad etanol . Enligt Renewable Fuels Association, den 30 oktober 2007, har 131 bioraffinaderier för etanol i USA kapacitet att producera 7 × 10 9 US gal (26 000 000 m 3 ) etanol per år. Ytterligare 72 pågående byggprojekt (i USA) kan lägga till 6,4 miljarder US gallons (24 000 000 m 3 ) ny kapacitet under de kommande 18 månaderna.
I Indien tillverkas etanol av sockerrör. Söt sorghum är en annan potentiell källa till etanol och är lämplig för odling i torra förhållanden. International Crops Research Institute for the Semi-Arid Tropics undersöker möjligheten att odla sorghum som en källa till bränsle, mat och djurfoder i torra delar av Asien och Afrika . Söt sorghum har en tredjedel av vattenbehovet för sockerrör under samma tidsperiod. Det kräver också cirka 22% mindre vatten än majs. Världens första etanoldestilleri för söt sorghum började kommersiell produktion 2007 i Andhra Pradesh , Indien .
Hydrering
Etanol kan framställas från petrokemiska råvaror, främst genom syrakatalyserad hydratisering av eten . Det kallas ofta syntetisk etanol.
Katalysatorn är oftast fosforsyra , adsorberad på ett poröst underlag som kiselgel eller kiselgur . Denna katalysator användes först för storskalig etanolproduktion av Shell Oil Company 1947. Reaktionen utförs i närvaro av högtrycksånga vid 300 °C (572 °F) där förhållandet mellan eten och ånga är 5:3. bibehålls. Denna process användes i industriell skala av Union Carbide Corporation och andra. Det praktiseras inte längre i USA eftersom jäsningsetanol framställd av majs är mer ekonomiskt.
I en äldre process, som först praktiserades i industriell skala 1930 av Union Carbide men nu nästan helt föråldrad, hydratiserades eten indirekt genom att reagera det med koncentrerad svavelsyra för att producera etylsulfat , som hydrolyserades för att ge etanol och regenerera svavelsyran:
Från koldioxid
Etanol har framställts i laboratoriet genom att omvandla koldioxid via biologiska och elektrokemiska reaktioner.
_ _ → CH3CH20H
_ _
_ biprodukter + _
Jäsning
Etanol i alkoholhaltiga drycker och bränsle produceras genom jäsning. Vissa arter av jäst (t.ex. Saccharomyces cerevisiae ) metaboliserar socker och producerar etanol och koldioxid. De kemiska ekvationerna nedan sammanfattar omvandlingen:
6 H
12 O
6 → 2 CH
3 CH
2 O H + 2 CO 2
Jäsning är processen att odla jäst under gynnsamma termiska förhållanden för att producera alkohol. Denna process utförs vid cirka 35–40 °C (95–104 °F). Toxiciteten hos etanol mot jäst begränsar den etanolkoncentration som kan erhållas genom bryggning; högre koncentrationer erhålls därför genom berikning eller destillation . De mest etanoltoleranta jäststammarna kan överleva upp till cirka 18 volymprocent etanol.
För att producera etanol från stärkelsehaltiga material som spannmål måste stärkelsen först omvandlas till sockerarter . I att brygga öl har detta traditionellt åstadkommits genom att låta spannmålet gro, eller malt , som producerar enzymet amylas . När det mältade sädeskornet mosas omvandlar amylaset den återstående stärkelsen till sockerarter.
Cellulosa
Socker för etanoljäsning kan erhållas från cellulosa . Användning av denna teknik kan förvandla ett antal cellulosahaltiga jordbruksbiprodukter, såsom majskolvar , halm och sågspån , till förnybara energiresurser. Andra jordbruksrester som sockerrörsbagass och energigrödor som switchgrass kan också vara jäsbara sockerkällor.
Testning

Bryggerier och biobränsleanläggningar använder två metoder för att mäta etanolkoncentrationen. Infraröda etanolsensorer mäter vibrationsfrekvensen för löst etanol med hjälp av C−H-bandet vid 2900 cm− 1 . Denna metod använder en relativt billig solid state-sensor som jämför C−H-bandet med ett referensband för att beräkna etanolhalten. Beräkningen använder sig av Beer-Lambert-lagen . Alternativt, genom att mäta densiteten hos utgångsmaterialet och produktens densitet, med hjälp av en hydrometer , indikerar förändringen i specifik vikt under jäsningen alkoholhalten. Denna billiga och indirekta metod har en lång historia inom ölbryggningsbranschen.
Rening
Destillering
Etenhydrering eller bryggning ger en blandning av etanol och vatten. För de flesta industri- och bränsleanvändningar måste etanolen renas. Fraktionerad destillation vid atmosfärstryck kan koncentrera etanol till 95,6 viktprocent (89,5 mol%). Denna blandning är en azeotrop med en kokpunkt på 78,1 °C (172,6 °F), och kan inte renas ytterligare genom destillation. Tillsats av ett medbringande medel, såsom bensen , cyklohexan eller heptan , tillåter att en ny ternär azeotrop innefattande etanolen, vattnet och det medbringande medlet bildas. Denna lägre kokande ternära azeotrop avlägsnas företrädesvis, vilket leder till vattenfri etanol.
Molekylsilar och torkmedel
Bortsett från destillation kan etanol torkas genom tillsats av ett torkmedel , såsom molekylsiktar , cellulosa eller majsmjöl . Torkmedlen kan torkas och återanvändas. Molekylsilar kan användas för att selektivt absorbera vattnet från 95,6 % etanollösningen. Molekylsilar med porstorlek 3 Ångström , en typ av zeolit , binder effektivt vattenmolekyler samtidigt som de utesluter etanolmolekyler. Uppvärmning av de våta silarna driver ut vattnet, vilket möjliggör regenerering av deras torkmedelsförmåga.
Membran och omvänd osmos
Membran kan också användas för att separera etanol och vatten. Membranbaserade separationer är inte föremål för begränsningarna för vatten-etanolazeotropen eftersom separationerna inte är baserade på ång-vätskejämvikter. Membran används ofta i den så kallade hybridmembrandestillationsprocessen. Denna process använder en förkoncentrationsdestillationskolonn som det första separeringssteget. Den ytterligare separationen åstadkommes sedan med ett membran som drivs antingen i ånggenomträngnings- eller pervaporationssätt. Ånggenomträngning använder en ångmembranmatning och pervaporation använder en flytande membranmatning.
Andra tekniker
En mängd andra tekniker har diskuterats, inklusive följande:
- Saltning med användning av kaliumkarbonat för att utnyttja dess olöslighet kommer att orsaka en fasseparation med etanol och vatten. Detta ger alkoholen en mycket liten kaliumkarbonatförorening som kan avlägsnas genom destillation. Denna metod är mycket användbar vid rening av etanol genom destillation, eftersom etanol bildar en azeotrop med vatten.
- Direkt elektrokemisk reduktion av koldioxid till etanol under omgivande förhållanden med användning av kopparnanopartiklar på en kolnanospikfilm som katalysator;
- Extraktion av etanol från spannmålsmäsk med superkritisk koldioxid ;
- Pervaporation ;
- Fraktionerad frysning används också för att koncentrera fermenterade alkoholhaltiga lösningar, såsom traditionellt tillverkad Applejack (dryck) ;
- Trycksvängadsorption .
Kvaliteter av etanol
Denaturerad sprit
beskattas hårt som psykoaktiva droger, men etanol har många användningsområden som inte involverar dess konsumtion. För att lätta på skattebördan för dessa användningar avstår de flesta jurisdiktioner från skatten när ett medel har lagts till etanolen för att göra den olämplig att dricka. Dessa inkluderar bittermedel som denatoniumbensoat och toxiner som metanol, nafta och pyridin . Produkter av detta slag kallas denaturerad alkohol.
Absolut alkohol
Absolut eller vattenfri alkohol avser etanol med låg vattenhalt. Det finns olika kvaliteter med maximala vattenhalter från 1 % till några miljondelar (ppm). Om azeotropisk destillation används för att avlägsna vatten, kommer den att innehålla spårmängder av materialsepareringsmedlet (t.ex. bensen). Absolut alkohol är inte avsedd för mänsklig konsumtion. Absolut etanol används som lösningsmedel för laboratorie- och industritillämpningar, där vatten kommer att reagera med andra kemikalier, och som bränslealkohol. Spektroskopisk etanol är en absolut etanol med låg absorbans i ultraviolett och synligt ljus, lämplig för användning som lösningsmedel i ultraviolett-synlig spektroskopi .
Ren etanol klassas som 200 proof i USA, vilket motsvarar 175 grader proof i det brittiska systemet.
Rättade sprit
Retifierad sprit, en azeotrop sammansättning av 96% etanol innehållande 4% vatten, används istället för vattenfri etanol för olika ändamål. Sprit av vin är cirka 94% etanol (188 bevis). Föroreningarna skiljer sig från dem i 95 % (190 bevis) laboratorietanol.
Reaktioner
Etanol klassificeras som en primär alkohol, vilket innebär att kolet som dess hydroxylgrupp fäster på har minst två väteatomer fästa till det också. Många etanolreaktioner inträffar vid dess hydroxylgrupp.
Esterbildning
I närvaro av sura katalysatorer reagerar etanol med karboxylsyror för att producera etylestrar och vatten:
- RCOOH + HOCH 2 CH 3 → RCOOCH 2 CH 3 + H 2 O
Denna reaktion, som utförs i stor skala industriellt, kräver att vattnet avlägsnas från reaktionsblandningen när den bildas. Estrar reagerar i närvaro av en syra eller bas för att ge tillbaka alkoholen och ett salt. Denna reaktion är känd som förtvålning eftersom den används vid framställning av tvål. Etanol kan även bilda estrar med oorganiska syror. Dietylsulfat och trietylfosfat framställs genom behandling av etanol med svaveltrioxid respektive fosforpentoxid . Dietylsulfat är ett användbart etyleringsmedel i organisk syntes . Etylnitrit , framställt från reaktionen av etanol med natriumnitrit och svavelsyra, användes tidigare som ett diuretikum .
Uttorkning
I närvaro av sura katalysatorer kan alkoholer omvandlas till alkener såsom etanol till eten. Vanligtvis används fasta syror såsom aluminiumoxid .
- CH 3 CH 2 OH → H 2 C=CH 2 + H 2 O
Eftersom vatten tas bort från samma molekyl kallas reaktionen intramolekylär dehydrering . Intramolekylär dehydrering av en alkohol kräver en hög temperatur och närvaro av en sur katalysator såsom svavelsyra .
Eten som framställts av etanol som härrör från socker (främst i Brasilien) konkurrerar med eten som framställs av petrokemiska råvaror som nafta och etan.
Vid en lägre temperatur än den för intramolekylär dehydrering, kan intermolekylär alkoholdehydrering inträffa och producera en symmetrisk eter. Detta är en kondensationsreaktion . I följande exempel framställs dietyleter av etanol:
- 2 CH 3 CH 2 OH → CH 3 CH 2 OCH 2 CH 3 + H 2 O
Förbränning
Fullständig förbränning av etanol bildar koldioxid och vatten:
- C2H5OH (1) + 3 O2 ( g) → 2 CO2 ( g ) + 3 H2O ( 1 ) ; −ΔH c = 1371 kJ/mol = 29,8 kJ/g = 327 kcal/mol = 7,1 kcal/g
- C 2 H 5 OH (l) + 3 O 2 (g) → 2 CO 2 (g) + 3 H 2 O (g); −ΔH c = 1236 kJ/mol = 26,8 kJ/g = 295,4 kcal/mol = 6,41 kcal/g
Specifik värme = 2,44 kJ/(kg·K)
Syra-bas kemi
Etanol är en neutral molekyl och pH-värdet för en lösning av etanol i vatten är nästan 7,00. Etanol kan kvantitativt omvandlas till sin konjugatbas , etoxidjonen (CH 3 CH 2 O − ), genom reaktion med en alkalimetall såsom natrium :
- 2 CH 3 CH 2 OH + 2 Na → 2 CH 3 CH 2 ONa + H 2
eller en mycket stark bas som natriumhydrid :
- CH 3 CH 2 OH + NaH → CH 3 CH 2 ONa + H 2
Surheterna för vatten och etanol är nästan desamma, vilket indikeras av deras pKa på 15,7 respektive 16. Således existerar natriumetoxid och natriumhydroxid i en jämvikt som är nära balanserad:
- CH 3 CH 2 OH + NaOH ⇌ CH 3 CH 2 ONa + H 2 O
Halogenering
Etanol används inte industriellt som en prekursor till etylhalogenider, men reaktionerna är illustrativa. Etanol reagerar med vätehalogenider för att producera etylhalider såsom etylklorid och etylbromid via en SN 2 -reaktion :
- CH 3 CH 2 OH + HCl → CH 3 CH 2 Cl + H 2 O
HCl kräver en katalysator som zinkklorid . HBr kräver återloppskokning med en svavelsyrakatalysator . Etylhalogenider kan i princip även framställas genom att etanol behandlas med mer specialiserade halogeneringsmedel , såsom tionylklorid eller fosfortribromid .
- CH 3 CH 2 OH + SOCl 2 → CH 3 CH 2 Cl + SO 2 + HCl
Vid behandling med halogener i närvaro av bas ger etanol motsvarande haloform (CHX3 , där X = Cl, Br, I) . Denna omvandling kallas haloformreaktionen . En mellanprodukt i reaktionen med klor är aldehyden som kallas kloral , som bildar kloralhydrat vid reaktion med vatten:
- 4 Cl 2 + CH 3 CH 2 OH → CCl 3 CHO + 5 HCl
- CCl 3 CHO + H 2 O → CCl 3 C(OH) 2 H
Oxidation
Etanol kan oxideras till acetaldehyd och ytterligare oxideras till ättiksyra , beroende på reagens och förhållanden. Denna oxidation har ingen betydelse industriellt, men i människokroppen katalyseras dessa oxidationsreaktioner av enzymet leveralkoholdehydrogenas . Oxidationsprodukten av etanol, ättiksyra, är ett näringsämne för människor och är en föregångare till acetyl CoA , där acetylgruppen kan användas som energi eller användas för biosyntes.
Ämnesomsättning
Etanol liknar makronäringsämnen som proteiner, fetter och kolhydrater genom att det ger kalorier. När den konsumeras och metaboliseras bidrar den med 7 kilokalorier per gram via etanolmetabolism .
Säkerhet
Ren etanol kommer att irritera huden och ögonen. Illamående, kräkningar och berusning är symptom på förtäring. Långvarig användning genom förtäring kan resultera i allvarliga leverskador. Atmosfäriska koncentrationer över en promille ligger över EU:s gränsvärden för yrkesexponering .
Historia
Jäsningen av socker till etanol är en av de tidigaste bioteknikerna som används av människor. Etanol har historiskt identifierats olika som sprit av vin eller brinnande sprit, och som aqua vitae eller aqua vita. De berusande effekterna av dess konsumtion har varit kända sedan urminnes tider. Etanol har använts av människor sedan förhistorien som den berusande ingrediensen i alkoholhaltiga drycker . Torkade rester på 9 000 år gammal keramik som hittats i Kina tyder på att neolitiska människor konsumerade alkoholhaltiga drycker.
Vinets brandfarliga karaktär var redan känd för forntida naturfilosofer som Aristoteles (384–322 f.Kr.), Theophrastus ( ca. 371–287 f.Kr.) och Plinius den äldre (23/24–79 f.Kr.). Detta ledde dock inte omedelbart till isoleringen av etanol, även trots utvecklingen av mer avancerade destillationstekniker i det romerska Egypten på andra och tredje århundradet . Ett viktigt erkännande, som först hittades i en av de skrifter som tillskrivs Jābir ibn Ḥayyān (800-talet e.Kr.), var att genom att tillsätta salt till kokande vin, vilket ökar vinets relativa flyktighet , kan de resulterande ångornas brandfarlighet förbättras. Destillationen av vin är intygad i arabiska verk som tillskrivs al-Kindī ( ca 801–873 e.Kr.) och till al-Fārābī ( ca 872–950 ), och i den 28:e boken av al-Zahrāwī 's (latin: Abulcasis) , 936–1013) Kitāb al-Taṣrīf (senare översatt till latin som Liber servatoris ). På 1100-talet började recept för framställning av aqua ardens ("brinnande vatten", dvs. etanol) genom att destillera vin med salt att dyka upp i ett antal latinska verk, och i slutet av 1200-talet hade det blivit en utbredd känt ämne bland västeuropeiska kemister.
Taddeo Alderottis (1223–1296 ) verk beskriver en metod för att koncentrera etanol som involverar upprepad fraktionerad destillation genom en vattenkyld destillation, genom vilken en etanolrenhet på 90 % kunde erhållas. Etanolens medicinska egenskaper studerades av Arnald av Villanova (1240–1311 e.Kr.) och Johannes av Rupescissa ( ca 1310–1366 ), av vilka den senare ansåg det som ett livbevarande ämne som kan förebygga alla sjukdomar (aqua vitae) eller "livets vatten", även kallad av Johannes kvintessensen av vin).
I Kina tyder arkeologiska bevis på att den verkliga destilleringen av alkohol började under dynastierna Jin (1115–1234) eller Southern Song (1127–1279). En destillation har hittats på en arkeologisk plats i Qinglong, Hebei , med anor från 1100-talet. I Indien introducerades den sanna destillationen av alkohol från Mellanöstern och användes i stor utsträckning i Delhisultanatet på 1300-talet.
1796 erhöll den tysk-ryske kemisten Johann Tobias Lowitz ren etanol genom att blanda delvis renad etanol (alkohol-vatten-azeotropen) med ett överskott av vattenfri alkali och sedan destillera blandningen över låg värme. Den franske kemisten Antoine Lavoisier beskrev etanol som en förening av kol, väte och syre, och 1807 bestämde Nicolas-Théodore de Saussure etanolens kemiska formel. Femtio år senare Archibald Scott Couper strukturformeln för etanol. Det var en av de första strukturformlerna som bestämdes.
Etanol bereddes först syntetiskt 1825 av Michael Faraday . Han fann att svavelsyra kunde absorbera stora volymer kolgas . Han gav den resulterande lösningen till Henry Hennell , en brittisk kemist, som 1826 fann att den innehöll "sulfovinsyra" ( etylvätesulfat) . År 1828 upptäckte Hennell och den franske kemisten Georges-Simon Serullas oberoende av varandra att sulfovinsyra kunde sönderdelas till etanol. Således hade Faraday 1825 omedvetet upptäckt att etanol kunde framställas av eten (en komponent av kolgas) genom syrakatalyserad hydrering, en process som liknar nuvarande industriell etanolsyntes.
Etanol användes som lampbränsle i USA så tidigt som 1840, men en skatt som togs ut på industriell alkohol under inbördeskriget gjorde denna användning oekonomisk. Skatten upphävdes 1906. Användningen som bilbränsle går tillbaka till 1908, med Ford Model T som kan köras på bensin (bensin) eller etanol. Det ger bränsle till vissa spritlampor .
Etanol avsedd för industriellt bruk tillverkas ofta av eten. Etanol har utbredd användning som lösningsmedel av ämnen avsedda för mänsklig kontakt eller konsumtion, inklusive dofter, smakämnen, färgämnen och mediciner. Inom kemin är det både ett lösningsmedel och ett råmaterial för syntes av andra produkter. Det har en lång historia som bränsle för värme och ljus, och på senare tid som bränsle för förbränningsmotorer.
Se även
Vidare läsning
- Boyce JM, Pittet D (2003). "Handhygien i hälsovårdsmiljöer" . Atlanta, GA: Centers for Disease Control . .
- Onuki S, Koziel JA, van Leeuwen J, Jenks WS, Grewell D, Cai L (juni 2008). Etanolproduktion, rening och analystekniker: en översyn . ASABE års internationella möte 2008. Providence, RI . Hämtad 16 februari 2013 .
- "Förklaring av amerikanska denaturerade alkoholbeteckningar" . Sci-leksaker .
- Lange, Norbert Adolph (1967). John Aurie Dean (red.). Lange's Handbook of Chemistry (10:e upplagan). McGraw-Hill.
externa länkar
- Alkohol (etanol) vid The Periodic Table of Videos (University of Nottingham)
- International Labour Organization etanol säkerhetsinformation
- Nationell föroreningsinventering – Etanol faktablad
- CDC – NIOSH Pocket Guide to Chemical Hazards – Etylalkohol
- National Institute of Standards and Technology kemiska data om etanol
- Chicago Board of Trade nyheter och marknadsdata om etanolterminer
- Beräkning av ångtryck , vätskedensitet , dynamisk vätskeviskositet , ytspänning av etanol
- Etanol historia En titt in i historien om etanol
- ChemSub Online: Etylalkohol
- Industriell etanolproduktionsprocessflödesdiagram med eten och svavelsyra