Steroid

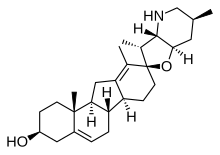
En steroid är en biologiskt aktiv organisk förening med fyra ringar arrangerade i en specifik molekylär konfiguration . Steroider har två huvudsakliga biologiska funktioner: som viktiga komponenter i cellmembran som ändrar membranfluiditet ; och som signalmolekyler . Hundratals steroider finns i växter , djur och svampar . Alla steroider tillverkas i celler från sterolerna lanosterol ( opisthokonts ) eller cycloartenol (växter). Lanosterol och cykloartenol härrör från cykliseringen av triterpenskvalen .
Steroidkärnstrukturen är vanligtvis sammansatt av sjutton kolatomer , bundna i fyra " sammanslagna " ringar: tre sexledade cyklohexanringar (ringarna A, B och C i den första illustrationen ) och en femledad cyklopentanring (D-ringen) . Steroider varierar beroende på de funktionella grupper som är fästa vid denna fyrringiga kärna och av ringarnas oxidationstillstånd . Steroler är former av steroider med en hydroxigrupp i position tre och ett skelett som härrör från kolestan . Steroider kan också modifieras mer radikalt, till exempel genom förändringar av ringstrukturen, till exempel genom att skära av en av ringarna. Cutting Ring B producerar sekosteroider varav en är vitamin D 3 .
Exempel är anabola steroider , lipidkolesterolet , könshormonerna östradiol och testosteron och det antiinflammatoriska läkemedlet dexametason .
Nomenklatur


Gonane , även känd som steran eller cyklopentanoperhydrophenanthrene, den enklaste steroiden och kärnan av alla steroider och steroler, består av sjutton kolatomer i kol-kolbindningar som bildar fyra sammansmälta ringar i en tredimensionell form . De tre cyklohexanringarna (A, B och C i den första illustrationen) bildar skelettet av ett perhydroderivat av fenantren . D-ringen har en cyklopentanstruktur . När de två metylgrupperna och åtta kolsidokedjorna (vid C-17, som visas för kolesterol) är närvarande, sägs steroiden ha en kolestanstruktur. De två vanliga 5α- och 5β-stereoisomera formerna av steroider existerar på grund av skillnader i sidan av det i stort sett plana ringsystemet där väteatomen (H) vid kol-5 är fäst, vilket resulterar i en förändring i steroid A-ringkonformation. Isomerisering vid C-21-sidokedjan producerar en parallell serie av föreningar, kallade isosteroider.
Exempel på steroidstrukturer är:
Testosteron , det huvudsakliga manliga könshormonet och en anabol steroid
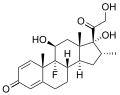
Cholinsyra , en gallsyra , visar att karboxylsyran och ytterligare hydroxylgrupper ofta är närvarande
Dexametason , ett syntetiskt kortikosteroidläkemedel
Lanosterol , den biosyntetiska prekursorn till animaliska steroider. Antalet kol (30) indikerar dess triterpenoidklassificering .
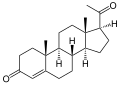
Progesteron , ett steroidhormon involverat i den kvinnliga menstruationscykeln, graviditet och embryogenes
Medrogestone , ett syntetiskt läkemedel med effekter som liknar progesteron
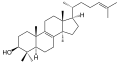
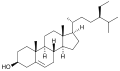
β-Sitosterol , en växt eller fytosterol , med en helt grenad kolvätesidokedja vid C-17 och en hydroxylgrupp vid C-3
Förutom ringklyvningar (klyvningar), expansioner och sammandragningar (klyvning och återförslutning till en större eller mindre ringar) – alla variationer i kol-kolbindningsramverket – kan steroider också variera:
- i bindningsordningarna inom ringarna,
- i antalet metylgrupper bundna till ringen (och, när de finns, på den framträdande sidokedjan vid C17),
- i de funktionella grupperna fästa vid ringarna och sidokedjan, och
- i konfigurationen av grupper fästa vid ringarna och kedjan.
Till exempel har steroler såsom kolesterol och lanosterol en hydroxylgrupp fäst vid position C-3, medan testosteron och progesteron har en karbonyl (oxo-substituent) vid C-3; av dessa lanosterol två metylgrupper vid C-4 och kolesterol (med en C-5 till C-6 dubbelbindning) skiljer sig från testosteron och progesteron (som har en C-4 till C-5 dubbelbindning).

Kolesterol , en prototypisk djursterol. Denna strukturella lipid och nyckelsteroid biosyntetisk prekursor.
|

5α- kolestan , en vanlig steroidkärna
|
Arternas utbredning och funktion
I eukaryoter finns steroider i svampar, djur och växter.
Svampsteroider
Svampsteroider inkluderar ergosterolerna , som är involverade i att upprätthålla integriteten hos svampens cellmembran. Olika svampdödande läkemedel , såsom amfotericin B och azol-svampmedel , använder denna information för att döda patogena svampar. Svampar kan förändra sitt ergosterolinnehåll (t.ex. genom förlust av funktionsmutationer i enzymerna ERG3 eller ERG6 , vilket inducerar utarmning av ergosterol, eller mutationer som minskar ergosterolhalten) för att utveckla resistens mot läkemedel som riktar sig mot ergosterol.
Ergosterol är analogt med kolesterolet som finns i cellmembranen hos djur (inklusive människor), eller de fytosteroler som finns i växternas cellmembran. Alla svampar innehåller stora mängder ergosterol, i intervallet tiotals till hundratals milligram per 100 gram torrvikt. Syre är nödvändigt för syntesen av ergosterol i svampar.
Ergosterol är ansvarigt för D-vitaminhalten som finns i svamp; ergosterol omvandlas kemiskt till provitamin D2 genom exponering för ultraviolett ljus . Provitamin D2 bildar spontant vitamin D2. Men inte alla svampar använder ergosterol i sina cellmembran; till exempel gör inte den patogena svamparten Pneumocystis jirovecii , vilket har viktiga kliniska implikationer (med tanke på verkningsmekanismen hos många antimykotika). Med hjälp av svampen Saccharomyces cerevisiae som exempel, inkluderar andra viktiga steroider ergosta-5,7,22,24(28)-tetraen-3β-ol, zymosterol och lanosterol . S. cerevisiae använder 5,6-dihydroergosterol i stället för ergosterol i dess cellmembran.
Djursteroider
Animaliska steroider inkluderar föreningar av ryggradsdjur och insektsursprung , de sistnämnda inkluderar ecdysteroider såsom ecdysterone (kontrollerar molting i vissa arter). Exempel på ryggradsdjur inkluderar steroidhormoner och kolesterol; den senare är en strukturell komponent i cellmembran som hjälper till att bestämma cellmembranens fluiditet och är en huvudsaklig beståndsdel av plack (inblandad i åderförkalkning ). Steroidhormoner inkluderar:
- Könshormoner som påverkar könsskillnaderna och stödjer reproduktionen . Dessa inkluderar androgener , östrogener och gestagener .
- Kortikosteroider , inklusive de flesta syntetiska steroidläkemedel, med naturliga produktklasser glukokortikoider ( som reglerar många aspekter av metabolism och immunfunktion ) och mineralokortikoider (som hjälper till att upprätthålla blodvolymen och kontrollera renal utsöndring av elektrolyter )
- Anabola steroider , naturliga och syntetiska, som interagerar med androgenreceptorer för att öka muskel- och bensyntesen. I populär användning hänvisar termen "steroider" ofta till anabola steroider.
Plantera steroider
Växtsteroider inkluderar steroidalkaloider som finns i Solanaceae och Melanthiaceae (speciellt släktet Veratrum ), hjärtglykosider , fytosterolerna och brassinosteroiderna (som inkluderar flera växthormoner).
Prokaryoter
I prokaryoter finns biosyntetiska vägar för det tetracykliska steroidramverket (t.ex. i mykobakterier ) – där dess ursprung från eukaryoter antas – och det vanligare pentacykliska triterpinoidhopanoidramverket .
Typer
Efter funktion
De viktigaste klasserna av steroidhormoner , med framstående medlemmar och exempel på relaterade funktioner, är: [ citat behövs ]
-
Kortikosteroider :
-
Glukokortikoider :
- Kortisol , en glukokortikoid vars funktioner inkluderar immunsuppression
-
Mineralokortikoider :
- Aldosteron , en mineralokortikoid som hjälper till att reglera blodtrycket genom vatten- och elektrolytbalansen
-
Glukokortikoider :
-
Sexsteroider :
-
Gesteron :
- Progesteron , som reglerar cykliska förändringar i livmoderns endometrium och upprätthåller en graviditet
-
Androgener :
- Testosteron , som bidrar till utveckling och underhåll av manliga sekundära könsegenskaper
-
Östrogener :
- Östradiol , som bidrar till utveckling och underhåll av kvinnliga sekundära könsegenskaper
-
Gesteron :
Ytterligare klasser av steroider inkluderar:
- Neurosteroider som DHEA och allopregnanolon
- Gallsyror som taurocholsyra
- Aminosteroid neuromuskulärt blockerande medel (huvudsakligen syntetiska) såsom pankuroniumbromid
- Steroidala antiandrogener (huvudsakligen syntetiska) såsom cyproteronacetat
- Steroidogeneshämmare (främst exogena) såsom alfatradiol
- Membransteroler som kolesterol , ergosterol och olika fytosteroler
- Toxiner som steroidsaponiner och kardenolider / hjärtglykosider
Samt följande klass av sekosteroider (steroider med öppen ring):
- D -vitaminformer som ergocalciferol , cholecalciferol och calcitriol
Efter struktur
Intakt ringsystem
Steroider kan klassificeras utifrån deras kemiska sammansättning. Ett exempel på hur MeSH utför denna klassificering finns i Wikipedia MeSH-katalogen. Exempel på denna klassificering inkluderar:
| Klass | Exempel | Antal kolatomer |
|---|---|---|
| Cholestanes | Kolesterol | 27 |
| Cholanes | Cholic syra | 24 |
| Pregnanes | Progesteron | 21 |
| Androstanes | Testosteron | 19 |
| Estranes | Östradiol | 18 |
Inom biologi är det vanligt att nämna ovanstående steroidklasser efter antalet närvarande kolatomer när man hänvisar till hormoner: C 18 -steroider för estraner (mestadels östrogener), C 19 -steroider för androstaner (främst androgener) och C 21 -steroider för gravida (mest kortikosteroider). Klassificeringen " 17-ketosteroid " är också viktig inom medicin.
Gonanen (steroidkärnan) är modermolekylen med 17 kol tetracykliska kolväten utan alkylsidokedjor .
Klyvda, sammandragna och utvidgade ringar
Sekosteroider (latin seco , "att skära") är en underklass av steroidföreningar som är ett resultat, biosyntetiskt eller konceptuellt, från klyvning (klyvning) av föräldersteroidringar (vanligtvis en av de fyra). Större sekosteroidsubklasser definieras av de steroidkolatomer där denna klyvning har ägt rum. Till exempel är den prototypiska sekosteroiden kolekalciferol , vitamin D 3 (visad), i underklassen 9,10-sekosteroider och härrör från klyvningen av kolatomerna C-9 och C-10 i steroid B-ringen; 5,6-sekosteroider och 13,14-steroider liknar varandra.
Norsteroider ( nor- , L. norma ; "normala" i kemin, vilket indikerar kolavlägsnande) och homosteroider (homo-, grekiska homos ; "samma", vilket indikerar koltillsats) är strukturella underklasser av steroider bildade från biosyntetiska steg. Den förra involverar enzymatiska ringexpansion-sammandragningsreaktioner , och den senare åstadkoms ( biomimetiskt ) eller (mer ofta) genom ringslutningar av acykliska prekursorer med fler (eller färre) ringatomer än modersteroidramverket.
Kombinationer av dessa ringförändringar är kända i naturen. Till exempel får tackor som betar på majslilja cyklopamin (visas) och veratramin , två av en underfamilj av steroider där C- och D-ringarna är sammandragna respektive expanderade via en biosyntetisk migration av den ursprungliga C-13-atomen . Förtäring av dessa C-nor-D-homosteroider resulterar i fosterskador hos lamm: cyklopi från cyklopamin och bendeformitet från veratramin. Ytterligare en C-nor-D-homosteroid (nakiterpiosin) utsöndras av Okinawanska cyanobakteriosvampar . t.ex. Terpios hoshinota , vilket leder till koralldödlighet från svartkorallsjukdom. Nakiterpiosin-typ steroider är aktiva mot signalvägen som involverar utjämnade proteiner och igelkottsproteiner , en väg som är hyperaktiv i ett antal cancerformer. [ citat behövs ]
Biologisk betydelse
Steroider och deras metaboliter fungerar ofta som signalmolekyler (de mest anmärkningsvärda exemplen är steroidhormoner), och steroider och fosfolipider är komponenter i cellmembran . Steroider som kolesterol minskar membranfluiditeten . Liksom lipider är steroider högkoncentrerade energidepåer. De är dock vanligtvis inte energikällor; hos däggdjur metaboliseras och utsöndras de normalt.
Steroider spelar avgörande roll i ett antal sjukdomar, inklusive maligniteter som prostatacancer , där steroidproduktion inuti och utanför tumören främjar cancercellers aggressivitet.
Biosyntes och metabolism
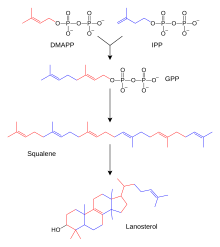
De hundratals steroider som finns i djur, svampar och växter är gjorda av lanosterol (i djur och svampar; se exempel ovan) eller cykloartenol (i andra eukaryoter). Både lanosterol och cykloartenol härrör från cyklisering av triterpenoiden skvalen . Lanosterol och cykloartenol kallas ibland protosteroler eftersom de fungerar som utgångsföreningar för alla andra steroider.
Steroidbiosyntes är en anabol väg som producerar steroider från enkla prekursorer. En unik biosyntetisk väg följs hos djur (jämfört med många andra organismer ), vilket gör vägen till ett vanligt mål för antibiotika och andra anti-infektionsläkemedel. Steroidmetabolism hos människor är också målet för kolesterolsänkande läkemedel, såsom statiner . Hos människor och andra djur följer biosyntesen av steroider mevalonatvägen, som använder acetyl-CoA som byggstenar för dimetylallyldifosfat (DMAPP) och isopentenyldifosfat (IPP). [ bättre källa behövs ]
I efterföljande steg konjugerar DMAPP och IPP för att bilda farnesyldifosfat (FPP), som ytterligare konjugerar med varandra för att bilda den linjära triterpenoiden skvalen. Skvalenbiosyntes katalyseras av skvalensyntas , som tillhör familjen squalen/fytoensyntas . Efterföljande epoxidering och cyklisering av skvalen genererar lanosterol, vilket är startpunkten för ytterligare modifieringar till andra steroider (steroidogenes). I andra eukaryoter är cykliseringsprodukten av epoxiderad skvalen (oxidosqualen) cykloartenol.
Mevalonatväg
Mevalonatvägen (även kallad HMG-CoA-reduktasvägen) börjar med acetyl-CoA och slutar med dimetylallyldifosfat (DMAPP) och isopentenyldifosfat (IPP).
DMAPP och IPP donerar isoprenenheter , som sätts ihop och modifieras för att bilda terpener och isoprenoider (en stor klass av lipider, som inkluderar karotenoiderna och bildar den största klassen av växtnaturprodukter . Här sammanfogas isoprenenheterna för att göra squalen och vikta till en uppsättning ringar för att göra lanosterol Lanosterol kan sedan omvandlas till andra steroider, såsom kolesterol och ergosterol .
Två klasser av läkemedel riktar sig mot mevalonatvägen : statiner (som rosuvastatin ), som används för att minska förhöjda kolesterolnivåer , och bisfosfonater (som zoledronat ), som används för att behandla ett antal bendegenerativa sjukdomar.
Steroidogenes
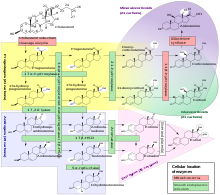
Steroidogenes är den biologiska process genom vilken steroider genereras från kolesterol och omvandlas till andra steroider. Vägarna för steroidogenes skiljer sig åt mellan arter . Huvudklasserna av steroidhormoner, som noterats ovan (med deras framträdande medlemmar och funktioner), är gestagenerna, kortikosteroiderna ( kortikoider ), androgener och östrogener . [ citat behövs ] Mänsklig steroidogenes av dessa klasser förekommer på ett antal platser:
- Gestagen är prekursorerna till alla andra mänskliga steroider, och alla mänskliga vävnader som producerar steroider måste först omvandla kolesterol till pregnenolon . Denna omvandling är det hastighetsbegränsande steget av steroidsyntes, som sker inuti mitokondrien i respektive vävnad. [ bättre källa behövs ]
- Kortisol, kortikosteron, aldosteron och testosteron produceras i binjurebarken . [ citat behövs ]
- Östradiol, östron och progesteron tillverkas främst i äggstockarna , östriol i moderkakan under graviditeten och testosteron främst i testiklarna (en del testosteron produceras också i binjurebarken). [ citat behövs ]
- Östradiol omvandlas från testosteron direkt (hos män), eller via den primära vägen DHEA - androstenedion - östron och sekundärt via testosteron (hos kvinnor). [ citat behövs ]
- Stromala celler har visat sig producera steroider som svar på signalering producerad av androgen-svältade prostatacancerceller . [ icke-primär källa behövs ] [ bättre källa behövs ]
- Vissa neuroner och glia i det centrala nervsystemet (CNS) uttrycker de enzymer som krävs för lokal syntes av pregnenolon, progesteron, DHEA och DHEAS, de novo eller från perifera källor. [ citat behövs ]
| Sex | Könshormon |
Reproduktiv fas |
Blodproduktionshastighet _ |
Gonadal sekretionshastighet |
Metabolisk clearancehastighet |
Referensintervall (serumnivåer) | |
|---|---|---|---|---|---|---|---|
| SI -enheter | Icke- SI -enheter | ||||||
| Män | Androstenedion |
–
|
2,8 mg/dag | 1,6 mg/dag | 2200 l/dag | 2,8–7,3 nmol/L | 80–210 ng/dL |
| Testosteron |
–
|
6,5 mg/dag | 6,2 mg/dag | 950 l/dag | 6,9–34,7 nmol/L | 200–1000 ng/dL | |
| Estron |
–
|
150 μg/dag | 110 μg/dag | 2050 l/dag | 37–250 pmol/L | 10–70 pg/ml | |
| Östradiol |
–
|
60 μg/dag | 50 μg/dag | 1600 l/dag | <37–210 pmol/L | 10–57 pg/ml | |
| Estronsulfat |
–
|
80 μg/dag | Obetydlig | 167 l/dag | 600–2500 pmol/L | 200–900 pg/ml | |
| Kvinnor | Androstenedion |
–
|
3,2 mg/dag | 2,8 mg/dag | 2000 l/dag | 3,1–12,2 nmol/L | 89–350 ng/dL |
| Testosteron |
–
|
190 μg/dag | 60 μg/dag | 500 l/dag | 0,7–2,8 nmol/L | 20–81 ng/dL | |
| Estron | Follikulär fas | 110 μg/dag | 80 μg/dag | 2200 l/dag | 110–400 pmol/L | 30–110 pg/ml | |
| Lutealfas | 260 μg/dag | 150 μg/dag | 2200 l/dag | 310–660 pmol/L | 80–180 pg/ml | ||
| Postmenopaus | 40 μg/dag | Obetydlig | 1610 l/dag | 22–230 pmol/L | 6–60 pg/ml | ||
| Östradiol | Follikulär fas | 90 μg/dag | 80 μg/dag | 1200 l/dag | <37–360 pmol/L | 10–98 pg/ml | |
| Lutealfas | 250 μg/dag | 240 μg/dag | 1200 l/dag | 699–1250 pmol/L | 190–341 pg/ml | ||
| Postmenopaus | 6 μg/dag | Obetydlig | 910 l/dag | <37–140 pmol/L | 10–38 pg/ml | ||
| Estronsulfat | Follikulär fas | 100 μg/dag | Obetydlig | 146 l/dag | 700–3600 pmol/L | 250–1300 pg/ml | |
| Lutealfas | 180 μg/dag | Obetydlig | 146 l/dag | 1100–7300 pmol/L | 400–2600 pg/ml | ||
| Progesteron | Follikulär fas | 2 mg/dag | 1,7 mg/dag | 2100 l/dag | 0,3–3 nmol/L | 0,1–0,9 ng/ml | |
| Lutealfas | 25 mg/dag | 24 mg/dag | 2100 l/dag | 19–45 nmol/L | 6–14 ng/ml | ||
|
Anteckningar och källor
Anmärkningar: " Koncentrationen av en steroid i cirkulationen bestäms av den hastighet med vilken den utsöndras från körtlar, hastigheten för metabolism av prekursorer eller prehormoner till steroiden och den hastighet med vilken den extraheras av vävnader och metaboliseras. utsöndringshastigheten för en steroid hänvisar till den totala utsöndringen av föreningen från en körtel per tidsenhet. Utsöndringshastigheten har bedömts genom att ta prover på det venösa utflödet från en körtel över tid och subtrahera koncentrationen av arteriellt och perifert venöst hormon. Den metaboliska clearancehastigheten av en steroid definieras som volymen blod som har rensats helt från hormonet per tidsenhet Produktionshastigheten för ett steroidhormon avser inträngning i blodet av föreningen från alla möjliga källor, inklusive utsöndring från körtlar och omvandling av prohormoner till steroiden av intresse. Vid steady state kommer mängden hormon som kommer in i blodet från alla källor att vara lika med hastigheten med vilken det elimineras (metabolisk clearance rate) multiplicerat med blodkoncentrationen (produktionshastighet = metabolisk clearance rate × koncentration). Om det finns lite bidrag av prohormonmetabolism till den cirkulerande poolen av steroider, kommer produktionshastigheten att vara ungefärlig utsöndringshastigheten." Källor: Se mall.
|
|||||||
Alternativa vägar
I växter och bakterier använder icke-mevalonatvägen (MEP-vägen) pyruvat och glyceraldehyd-3-fosfat som substrat för att producera IPP och DMAPP.
Under sjukdomar kan vägar som annars inte är signifikanta hos friska människor utnyttjas. Till exempel, i en form av medfödd binjurehyperplasi leder en brist i den enzymatiska 21-hydroxylasvägen till ett överskott av 17a-hydroxiprogesteron (17-OHP) – detta patologiska överskott av 17-OHP kan i sin tur omvandlas till dihydrotestosteron (DHT, en potent androgen) genom bland annat 17,20 Lyase (en medlem av cytokrom P450 -enzymfamiljen), 5α-reduktas och 3α-hydroxisteroiddehydrogenas .
Katabolism och utsöndring
Steroider oxideras primärt av cytokrom P450-oxidasenzymer , såsom CYP3A4 . Dessa reaktioner introducerar syre i steroidringen, vilket gör att kolesterolet kan brytas upp av andra enzymer till gallsyror. Dessa syror kan sedan elimineras genom utsöndring från levern i gallan . Uttrycket av oxidasgenen kan uppregleras av steroidsensorn PXR när det finns en hög blodkoncentration av steroider. Steroidhormoner, som saknar sidokedjan av kolesterol och gallsyror, hydroxyleras vanligtvis vid olika ringpositioner eller oxideras vid 17-positionen , konjugeras med sulfat eller glukuronsyra och utsöndras i urinen.
Isolering, strukturbestämning och analysmetoder
Steroidisolering , beroende på sammanhang, är den isolering av kemiskt material som krävs för klargörande av kemisk struktur , derivatisering eller nedbrytningskemi, biologiska tester och andra forskningsbehov (vanligtvis milligram till gram, men ofta mer eller isolering av "analytiska kvantiteter" av ämne av intresse (där fokus ligger på att identifiera och kvantifiera ämnet (till exempel i biologisk vävnad eller vätska). Mängden som isoleras beror på analysmetoden, men är vanligtvis mindre än ett mikrogram. [ sida behövs ]
Metoderna för isolering för att uppnå de två produktskalorna är distinkta, men inkluderar extraktion , utfällning, adsorption , kromatografi och kristallisering . I båda fallen renas den isolerade substansen till kemisk homogenitet; kombinerade separations- och analysmetoder, såsom LC-MS , väljs för att vara "ortogonala" - och uppnår deras separationer baserat på distinkta sätt för interaktion mellan substans och isoleringsmatris - för att detektera en enda art i det rena provet.
Strukturbestämning hänvisar till metoderna för att bestämma den kemiska strukturen hos en isolerad ren steroid, med hjälp av en utvecklande mängd kemiska och fysikaliska metoder som har inkluderat NMR och småmolekylär kristallografi . Analysmetoder överlappar båda ovanstående områden, och betonar analytiska metoder för att avgöra om en steroid finns i en blandning och bestämma dess kvantitet.
Kemisk syntes
Mikrobiell katabolism av fytosterolsidokedjor ger C-19-steroider, C-22-steroider och 17 -ketosteroider (dvs. prekursorer till binjurebarkhormoner och preventivmedel ). Tillägg och modifiering av funktionella grupper är nyckeln när man producerar det stora utbudet av mediciner som finns tillgängliga inom denna kemiska klassificering. Dessa modifieringar utförs med användning av konventionell organisk syntes och/eller biotransformationstekniker .
Föregångare
Semisyntes
Halvsyntesen av steroider börjar ofta från prekursorer som kolesterol , fytosteroler eller sapogeniner . Syntex , ett företag som är involverat i den mexikanska barbasco-handeln , använde Dioscorea mexicana för att producera sapogeninet diosgenin under de första dagarna av läkemedelsindustrin för syntetiska steroider .
Total syntes
Vissa steroidhormoner erhålls ekonomiskt endast genom total syntes från petrokemikalier (t.ex. 13- alkylsteroider ). Till exempel börjar det farmaceutiska Norgestrel från metoxi - 1-tetralon , en petrokemikalie som härrör från fenol .
Forskningspriser
Ett antal Nobelpriser har delats ut för steroidforskning, inklusive:
- 1927 ( Kemi ) Heinrich Otto Wieland - Konstitution av gallsyror och steroler och deras koppling till vitaminer
- 1928 (Kemi) Adolf Otto Reinhold Windaus — Konstitution av steroler och deras koppling till vitaminer
- 1939 (Kemi) Adolf Butenandt och Leopold Ružička — Isolering och strukturella studier av steroida könshormoner och relaterade studier på högre terpener
- 1950 ( fysiologi eller medicin ) Edward Calvin Kendall , Tadeus Reichstein och Philip Hench — Struktur och biologiska effekter av binjurehormoner
- 1965 (Kemi) Robert Burns Woodward - Delvis för syntesen av kolesterol, kortison och lanosterol
- 1969 (Kemi) Derek Barton och Odd Hassel — Utveckling av begreppet konformation i kemi, med betoning på steroidkärnan
- 1975 (Kemi) Vladimir Prelog — Delvis för att utveckla metoder för att bestämma det stereokemiska förloppet av kolesterolbiosyntes från mevalonsyra via skvalen
Se även
Bibliografi
- Russel CA (2005). "Organisk kemi: Naturprodukter, steroider". I Russell CA, Roberts GK (red.). Kemisk historia: Recensioner av den senaste litteraturen . Cambridge: RSC Publ. ISBN 978-0-85404-464-1 .
- "Russell Marker Skapande av den mexikanska steroidhormonindustrin - Landmärke -" . American Chemical Society. 1999.
- Lednicer D (2011). Steroidkemi i ett ögonkast . Hoboken: Wiley. doi : 10.1002/9780470973639 . ISBN 978-0-470-66085-0 . En kortfattad historia av studien av steroider.
- Yoder RA, Johnston JN (dec 2005). "En fallstudie i biomimetisk totalsyntes: polyolefinkarbocykliseringar till terpener och steroider" . Kemiska recensioner . 105 (12): 4730–56. doi : 10.1021/cr040623l . PMC 2575671 . PMID 16351060 . En genomgång av historien om steroidsyntes, särskilt biomimetisk .
- Han TS, Walker BR, Arlt W, Ross RJ (feb 2014). "Behandling och hälsoresultat hos vuxna med medfödd binjurehyperplasi". Naturrecensioner. Endokrinologi . 10 (2): 115–24. doi : 10.1038/nrendo.2013.239 . PMID 24342885 . S2CID 6090764 . Adrenal steroidogenesväg.
- Greep RO, red. (22 oktober 2013). "Kortoinsyror" . Senaste framsteg i hormonforskning: Proceedings of the 1979 Laurentian Hormone Conference . Elsevier Vetenskap . s. 345–391. ISBN 978-1-4832-1956-1 .
- Bowen RA (20 oktober 2001). "Steroidogenes" . Patofysiologi av det endokrina systemet . Colorado State University. Arkiverad från originalet den 28 februari 2009.