1-tetralon

|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
3,4-dihydro-2H- naftalen -1-on |
|
| Andra namn a-tetralon; 1-tetralon
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.007.692 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C10H10O _ _ _ _ | |
| Molar massa | 146,189 g·mol -1 |
| Utseende | färglös vätska |
| Densitet | * 1,099 g·cm −3 (25 °C ) |
| Smältpunkt | 2–7 °C |
| Kokpunkt | * 255–257 °C
|
| olöslig | |
| Löslighet | löslig i organiska lösningsmedel |
| Ångtryck | 2,7 Pa (20 °C) |
|
Brytningsindex ( n D )
|
1,5672 |
| Faror | |
| GHS- märkning : | |

|
|
| Varning | |
| H302 | |
| P264 , P270 , P301+P317 , P330 , P501 | |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
1-tetralon är ett bicykliskt aromatiskt kolväte och en keton. När det gäller dess struktur kan den också betraktas som benso-fuserad cyklohexanon. Det är en färglös olja med en svag lukt. Det används som utgångsmaterial för agrikulturella och farmaceutiska medel . Kolskelettet av 1-tetralon finns i naturliga produkter som Aristelegone A (4,7-dimetyl-6-metoxi-1-tetralon) från familjen Aristolochiaceae som används i traditionell kinesisk medicin .
Förberedelse
Genom oxidation av 1,2,3,4-tetrahydronaftalen
Som redan beskrivits 1933 av Heinrich Hock, tenderar 1,2,3,4-tetrahydronaftalen att autooxidera och bildar gradvis 1-hydroperoxiden med atmosfäriskt syre. Den tungmetalljonkatalyserade luftoxidationen av 1,2,3,4-tetrahydronaftalen med Cr 3+ eller Cu 2+ i vätskefasen leder via hydroperoxiden till en blandning av mellanprodukten 1-tetralol och slutprodukten 1-tetralon.
Kokpunkterna för huvudkomponenten 1-tetralon (255-257 °C) och mindrekomponenten 1-tetralol (255 °C) är praktiskt taget identiska, den senare avlägsnas därför genom en kemisk reaktion.
Av Friedel-Crafts reaktioner
Utgångsföreningen 4-fenylbutansyra (vars natriumsalt natriumfenylbutyrat används för att behandla hyperammonemi ) är tillgänglig från 3-bensoylpropansyra via katalytisk hydrering, med användning av en palladiumkontaktkatalysator. 3-bensoylpropansyra i sig kan erhållas genom en Haworth-reaktion (en variant av Friedel-Crafts-reaktionen ) från bensen och bärnstenssyraanhydrid.
Den intramolekylära cykliseringen av 4-fenylbutansyra till 1-tetralon katalyseras av polyfosforsyra och metansulfonsyra.
Det har beskrivits som ett undervisningsexperiment för kemilektioner. 4-Fenylbutansyra kan också kvantitativt omvandlas till 1-tetralon genom upphettning i närvaro av en stark Lewis-syrakatalysator såsom vismut(III)bis(trifluormetansulfonyl)amid [Bi(NTf 2 ) 3 ], som är relativt lättillgänglig.
Användningen av syrakloriden och tenn(IV)kloriden (SnCl 4 ) tillåter betydligt kortare reaktionstider än Friedel-Crafts acylering med 4-fenylbutansyra.
4-Fenylbutansyraklorider med elektrondonerande grupper kan cykliseras till 1-tetraloner under milda reaktionsförhållanden i utbyte över 90 % med användning av det starka vätebindande lösningsmedlet hexafluorisopropanol (HFIP).
Den AICl3 - katalyserade acyleringen av bensen med y-butyrolakton ger 1-tetralon.
Reaktioner
1-Tetralon kan reduceras via en Björkreduktion med litium i flytande ammoniak till 1,2,3,4-tetrahydronaftalen. Ketogruppen kan också reduceras till en sekundär alkohol som ger 1-tetralol, när en modifierad process tillämpas, med tillsats av vattenhaltig ammoniumkloridlösning efter avdunstning av ammoniaken.
Med kalcium i flytande ammoniak reduceras 1-tetralon till 1-tetralol vid -33 °C med 81 % utbyte.
Metylengruppen i α-position till ketogruppen är särskilt reaktiv och kan omvandlas med formaldehyd (i form av den trimera trioxanen ) till 2-metylen-1-tetralon i närvaro av trifluorättiksyrasaltet av N -metylanilin med ger upp till 91 %.
2-metylenketonen är stabil vid temperaturer under -5 °C, men polymeriserar helt vid rumstemperatur inom 12 timmar.
I Pfitzinger-reaktionen av 1-tetralon med isatin bildas en förening som kallas tetrofan (3,4-dihydro-1,2-bensakridin-5-karboxylsyra).
α-metylengruppens reaktivitet utnyttjas också i reaktionen av 1-tetralon med metanol vid 270-290 °C, som via dehydrering och bildning av det aromatiska naftalenringsystemet producerar 2-metyl-1-naftol i 66 % utbyte .
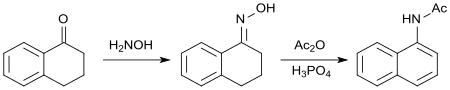
Oximen av 1-tetralon reagerar med ättiksyraanhydrid vilket leder till aromatisering av cykloalkanonringen . Den resulterande N-(1-naftyl)acetamiden har biologiska egenskaper liknande de för 2-(1-naftyl)ättiksyra som ett syntetiskt auxin .
Den tertiära alkoholen som bildas i Grignard-reaktionen av 1-tetralon med fenylmagnesiumbromid reagerar med ättiksyraanhydrid vid eliminering av vatten till 1-fenyl-3,4-dihydronaftalen, som dehydratiseras med elementärt svavel i ett totalt utbyte av cirka 45 % till 1 -fenylnaftalen.
Den rutenium(II)-katalyserade aryleringen av 1-tetralon med användning av fenylboronsyra-neopentylglykolester ger 8-fenyl-1-tetralon i upp till 86 % utbyte.
Med 5-aminotetrazol och en aromatisk aldehyd reagerar 1-tetralon i en flerkomponentreaktion under mikrovågsstrålning för att bilda ett fyrledat heterocykliskt ringsystem.
Ansökningar
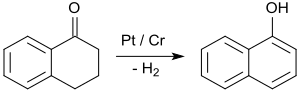
Den överlägset viktigaste tillämpningen av 1-tetralon är i syntesen av 1-naftol genom aromatisering , t.ex. vid kontakt med platinakatalysatorer vid 200 till 450 °C.
1-Naftol är utgångsmaterialet för insekticiderna karbaryl och betablockerarna propranolol .
Säkerhet
Toxikologiska studier utfördes dermalt med kaniner, med en LD50 på 2192 mg·kg -1 kroppsvikt.