Koldioxid

|
|||
|
|
|||
| Namn | |||
|---|---|---|---|
Andra namn
|
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| 3DMet | |||
| 1900390 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.271 | ||
| EG-nummer |
|
||
| E-nummer | E290 (konserveringsmedel) | ||
| 989 | |||
| KEGG | |||
| Maska | Kol+dioxid | ||
|
PubChem CID
|
|||
| RTECS-nummer |
|
||
| UNII | |||
| FN-nummer | 1013 (gas), 1845 (fast) | ||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C O 2 | |||
| Molar massa | 44,009 g·mol -1 | ||
| Utseende | Färglös gas | ||
| Odör |
|
||
| Densitet |
|
||
| Kritisk punkt ( T , P ) | 304,128(15) K ( 30,978(15) °C ), 7,3773(30) MPa ( 72,808(30) atm ) | ||
| 194,6855(30) K ( −78,4645(30) °C ) vid 1 atm ( 0,101 325 MPa ) | |||
| 1,45 g/L vid 25 °C (77 °F), 100 kPa (0,99 atm) | |||
| Ångtryck | 5,7292(30) MPa , 56,54(30) atm ( 20 °C ( 293,15 K )) | ||
| Surhet (p K a ) | 6.35, 10.33 | ||
| −20,5·10 −6 cm 3 /mol | |||
| Värmeledningsförmåga | 0,01662 W·m −1 ·K −1 (300 K (27 °C; 80 °F)) | ||
|
Brytningsindex ( n D )
|
1,00045 | ||
| Viskositet |
|
||
| 0 D | |||
| Strukturera | |||
| Trigonal | |||
| Linjär | |||
| Termokemi | |||
|
Värmekapacitet ( C )
|
37,135 J/K·mol | ||
|
Std molär entropi ( S ⦵ 298 ) |
214 J.mol -1 -K -1 | ||
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
-393,5 kJ·mol -1 | ||
| Farmakologi | |||
| V03AN02 ( WHO ) | |||
| Faror | |||
| NFPA 704 (branddiamant) | |||
| Dödlig dos eller koncentration (LD, LC): | |||
|
LC Lo ( lägst publicerad )
|
90 000 ppm (människa, 5 min) | ||
| NIOSH (USA:s hälsoexponeringsgränser): | |||
|
PEL (tillåtet)
|
TWA 5000 ppm (9000 mg/m 3 ) | ||
|
REL (rekommenderas)
|
TWA 5000 ppm (9000 mg/m 3 ), ST 30 000 ppm (54 000 mg/m 3 ) | ||
|
IDLH (Omedelbar fara)
|
40 000 ppm | ||
| Säkerhetsdatablad (SDS) | Sigma-Aldrich | ||
| Besläktade föreningar | |||
|
Andra anjoner
|
|
||
|
Andra katjoner
|
|||
|
Besläktade föreningar
|
|||
| Kompletterande datasida | |||
| Koldioxid (datasida) | |||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Koldioxid ( kemisk formel CO 2 ) är en kemisk förening som består av molekyler som var och en har en kolatom som är kovalent dubbelbunden till två syreatomer . Det finns i gastillstånd vid rumstemperatur. I luften är koldioxid transparent för synligt ljus men absorberar infraröd strålning och fungerar som en växthusgas . Det är en spårgas i jordens atmosfär med 421 delar per miljon (ppm), eller cirka 0,04 volymprocent (i maj 2022), efter att ha stigit från förindustriella nivåer på 280 ppm. Förbränning av fossila bränslen är den primära orsaken till dessa ökade CO 2 - koncentrationer och även den primära orsaken till klimatförändringarna . Koldioxid är lösligt i vatten och finns i grundvatten , sjöar , inlandsisar och havsvatten . När koldioxid löser sig i vatten bildas karbonat och främst bikarbonat ( HCO
− 3 ), vilket orsakar havets försurning när atmosfärens CO 2 -nivåer ökar.
Som källa till tillgängligt kol i kolets kretslopp är atmosfärisk CO 2 den primära kolkällan för liv på jorden. Dess koncentration i jordens förindustriella atmosfär sedan sent i prekambrium har reglerats av organismer och geologiska fenomen. Växter , alger och cyanobakterier använder energi från solljus för att syntetisera kolhydrater från koldioxid och vatten i en process som kallas fotosyntes , som producerar syre som en avfallsprodukt. I sin tur förbrukas syre och CO 2 frigörs som avfall av alla aeroba organismer när de metaboliserar organiska föreningar för att producera energi genom andning . CO 2 frigörs från organiskt material när de sönderfaller eller förbränns, till exempel vid skogsbränder. Eftersom växter kräver CO 2 för fotosyntesen, och människor och djur är beroende av växter för föda, är CO 2 nödvändigt för att livet på jorden ska överleva.
Koldioxid är 53% tätare än torr luft, men är långlivad och blandas ordentligt i atmosfären. Ungefär hälften av överskottsutsläppen av CO 2 till atmosfären absorberas av kolsänkor på land och i havet . Dessa sänkor kan bli mättade och är flyktiga, eftersom sönderfall och skogsbränder leder till att CO 2 släpps tillbaka till atmosfären. CO 2 binds så småningom (lagras under lång tid) i bergarter och organiska fyndigheter som kol , petroleum och naturgas . Sekvestrerad CO 2 släpps ut i atmosfären genom att bränna fossila bränslen eller naturligt av vulkaner , varma källor , gejsrar och när karbonatstenar löses upp i vatten eller reagerar med syror.
CO 2 är ett mångsidigt industrimaterial, som används till exempel som en inert gas i svets- och brandsläckare , som tryckgas i luftpistoler och oljeåtervinning, och som ett superkritiskt vätskelösningsmedel vid koffeinering av kaffe och superkritisk torkning . Det är en biprodukt av jäsning av sockerarter i bröd- , öl- och vinframställning , och tillsätts till kolsyrade drycker som seltzer och öl för att brusa. Den har en skarp och sur lukt och genererar smaken av sodavatten i munnen, men vid normalt förekommande koncentrationer är den luktfri.
Kemiska och fysikaliska egenskaper
Struktur, bindning och molekylära vibrationer
Symmetrin hos en koldioxidmolekyl är linjär och centrosymmetrisk vid sin jämviktsgeometri . Längden på kol-syrebindningen i koldioxid är 116,3 pm , märkbart kortare än längden på ungefär 140 pm för en typisk enkel C-O-bindning, och kortare än de flesta andra C-O multipelbundna funktionella grupper som karbonyler . Eftersom den är centrosymmetrisk har molekylen inget elektriskt dipolmoment .

Som en linjär triatomisk molekyl har CO 2 fyra vibrationslägen som visas i diagrammet. I det symmetriska och det antisymmetriska sträckningsläget rör sig atomerna längs molekylens axel. Det finns två böjningslägen, som är degenererade , vilket betyder att de har samma frekvens och samma energi, på grund av molekylens symmetri. När en molekyl vidrör en yta eller vidrör en annan molekyl, kan de två böjningslägena skilja sig åt i frekvens eftersom interaktionen är olika för de två lägena. Några av vibrationslägena observeras i det infraröda (IR) spektrumet : det antisymmetriska sträckningsläget vid vågnummer 2349 cm −1 (våglängd 4,25 μm) och det degenererade paret av böjningslägen vid 667 cm −1 (våglängd 15 μm). Det symmetriska sträckningsläget skapar inte en elektrisk dipol så det observeras inte i IR-spektroskopi, men det detekteras med Raman-spektroskopi vid 1388 cm -1 (våglängd 7,2 μm).
I gasfasen genomgår koldioxidmolekyler betydande vibrationsrörelser och håller inte en fast struktur. Men i ett Coulomb explosionsavbildningsexperiment kan en ögonblicklig bild av molekylstrukturen härledas. Ett sådant experiment har gjorts för koldioxid. Resultatet av detta experiment, och slutsatsen av teoretiska beräkningar baserade på en ab initio potentiell energiyta hos molekylen, är att ingen av molekylerna i gasfasen någonsin är exakt linjär. Detta kontraintuitiva resultat beror trivialt på det faktum att kärnrörelsevolymelementet försvinner för linjära geometrier. Detta är så för alla molekyler (utom diatomics!).
I vattenlösning
Koldioxid är löslig i vatten, där den reversibelt bildar H 2 CO 3 (kolsyra), som är en svag syra eftersom dess jonisering i vatten är ofullständig.
Hydratiseringsjämviktskonstanten för kolsyra är vid 25 °C :
Därför omvandlas inte huvuddelen av koldioxiden till kolsyra, utan förblir som CO 2 -molekyler, vilket inte påverkar pH.
De relativa koncentrationerna av CO 2 , H 2 CO 3 och de deprotonerade formerna HCO − 3 ( bikarbonat ) och CO 2− 3 ( karbonat ) beror på pH . Som visas i en Bjerrum-plot , i neutralt eller svagt alkaliskt vatten (pH > 6,5), dominerar bikarbonatformen (>50%) och blir den vanligaste (>95%) vid pH-värdet i havsvattnet. I mycket alkaliskt vatten (pH > 10,4) är den dominerande (>50%) formen karbonat. Haven, som är svagt alkaliska med typiskt pH = 8,2–8,5, innehåller cirka 120 mg bikarbonat per liter.
Eftersom kolsyra är diprotisk har två syradissociationskonstanter , den första för dissociationen till bikarbonatjonen (även kallad vätekarbonat) ( HCO − 3 ):
- K a1 = 2,5 × 10 −4 mol/L ; pKal 3,6 vid 25°C .
Detta är den sanna första syradissociationskonstanten, definierad som
där nämnaren endast inkluderar kovalent bunden H 2 CO 3 och inte inkluderar hydratiserad CO 2 (aq) . Det mycket mindre och ofta angivna värdet nära 4,16 × 10 −7 är ett skenbart värde beräknat på det (felaktiga) antagandet att all löst CO 2 är närvarande som kolsyra, så att
Eftersom det mesta av den lösta CO 2 förblir som CO 2 -molekyler, har K a1 (skenbar) en mycket större nämnare och ett mycket mindre värde än det sanna K a1 .
Bikarbonatjonen är en amfoter art som kan fungera som en syra eller som en bas, beroende på lösningens pH. Vid högt pH dissocierar det avsevärt till karbonatjonen ( CO 2− 3 ):
- K a2 = 4,69 × 10 −11 mol/L ; pKa2 = 10,329 _
katalyseras kolsyraproduktionen av enzymet kolsyraanhydras .
Kemiska reaktioner av CO 2
CO 2 är en potent elektrofil med en elektrofil reaktivitet som är jämförbar med bensaldehyd eller starka α,β-omättade karbonylföreningar . Till skillnad från elektrofiler med liknande reaktivitet är reaktionerna mellan nukleofiler och CO 2 emellertid termodynamiskt mindre gynnade och visar sig ofta vara mycket reversibla. Endast mycket starka nukleofiler, som de karbanjoner som tillhandahålls av Grignard-reagenser och organolitiumföreningar reagerar med CO 2 för att ge karboxylater :
I metallkoldioxidkomplex fungerar CO 2 som en ligand , vilket kan underlätta omvandlingen av CO 2 till andra kemikalier.
Reduktionen av CO 2 till CO är vanligtvis en svår och långsam reaktion:
Fotoautotrofer (dvs växter och cyanobakterier ) använder energin som finns i solljus för att fotosyntetisera enkla sockerarter från CO 2 som absorberas från luft och vatten:
Redoxpotentialen för denna reaktion nära pH 7 är cirka -0,53 V jämfört med standardväteelektroden . Det nickelhaltiga enzymet kolmonoxiddehydrogenas katalyserar denna process.
Fysikaliska egenskaper
Koldioxid är färglös. Vid låga koncentrationer är gasen luktfri; men vid tillräckligt höga koncentrationer har den en skarp, sur lukt. Vid standardtemperatur och -tryck är koldioxidens densitet cirka 1,98 kg/m 3 , cirka 1,53 gånger luftens .
Koldioxid har inget flytande tillstånd vid tryck under 0,517 95 (10) MPa ( 5,111 77 (99) atm ). Vid ett tryck på 1 atm ( 0,101 325 MPa ) avsätts gasen direkt till ett fast ämne vid temperaturer under 194,6855(30) K ( −78,4645(30) °C ) och det fasta ämnet sublimeras direkt till en gas över denna temperatur. I sitt fasta tillstånd kallas koldioxid vanligtvis för torris .

Flytande koldioxid bildas endast vid tryck över 0,517 95 (10) MPa ( 5,111 77 (99) atm ); trippelpunkten för koldioxid är 216.592(3) K ( −56.558(3) °C ) vid 0.517 95 (10) MPa ( 5.111 77 (99) atm ) ( se fasdiagram). Den kritiska punkten är 304,128(15) K ( 30,978(15)°C ) vid 7,3773(30) MPa ( 72,808(30) atm ). En annan form av fast koldioxid som observeras vid högt tryck är ett amorft glasliknande fast ämne. Denna form av glas, som kallas carbonia , produceras genom att underkyla upphettad CO 2 vid extrema tryck (40–48 GPa , eller cirka 400 000 atmosfärer) i ett diamantstäd . Denna upptäckt bekräftade teorin att koldioxid kunde existera i ett glastillstånd som liknar andra medlemmar av dess elementarfamilj, som kiseldioxid (kiseldioxidglas) och germaniumdioxid . Till skillnad från kiseldioxid- och germaniaglas är dock karboniaglas inte stabilt vid normala tryck och återgår till gas när trycket släpps.
Vid temperaturer och tryck över den kritiska punkten beter sig koldioxid som en superkritisk vätska känd som superkritisk koldioxid .
Tabell över termiska och fysikaliska egenskaper för mättad flytande koldioxid:
| Temperatur (°C) | Densitet (kg/m^3) | Specifik värme (kJ/kg K) | Kinematisk viskositet (m^2/s) | Konduktivitet (W/m K) | Termisk diffusivitet (m^2/s) | Prandtl nummer | Bulkmodul (K^-1) |
| -50 | 1156,34 | 1,84 | 1.19E-07 | 0,0855 | 4.02E-08 | 2,96 | - |
| -40 | 1117,77 | 1,88 | 1.18E-07 | 0,1011 | 4.81E-08 | 2,46 | - |
| -30 | 1076,76 | 1,97 | 1.17E-07 | 0,1116 | 5.27E-08 | 2.22 | - |
| -20 | 1032,39 | 2.05 | 1.15E-07 | 0,1151 | 5.45E-08 | 2.12 | - |
| -10 | 983,38 | 2.18 | 1.13E-07 | 0,1099 | 5.13E-08 | 2.2 | - |
| 0 | 926,99 | 2,47 | 1.08E-07 | 0,1045 | 4.58E-08 | 2,38 | - |
| 10 | 860,03 | 3.14 | 1.01E-07 | 0,0971 | 3.61E-08 | 2.8 | - |
| 20 | 772,57 | 5 | 9.10E-08 | 0,0872 | 2.22E-08 | 4.1 | 1.40E-02 |
| 30 | 597,81 | 36,4 | 8.00E-08 | 0,0703 | 0,279E-08 | 28.7 | - |
Tabell över termiska och fysikaliska egenskaper för koldioxid (CO 2 ) vid atmosfärstryck:
| Temperatur (K) | Densitet (kg/m^3) | Specifik värme (kJ/kg °C) | Dynamisk viskositet (kg/ms) | Kinematisk viskositet (m^2/s) | Värmeledningsförmåga (W/m °C) | Termisk diffusivitet (m^2/s) | Prandtl nummer |
| 220 | 2,4733 | 0,783 | 1.11E-05 | 4.49E-06 | 0,010805 | 5.92E-06 | 0,818 |
| 250 | 2,1657 | 0,804 | 1.26E-05 | 5.81E-06 | 0,012884 | 7.40E-06 | 0,793 |
| 300 | 1,7973 | 0,871 | 1.50E-05 | 8.32E-06 | 0,016572 | 1.06E-05 | 0,77 |
| 350 | 1,5362 | 0,9 | 1.72E-05 | 1.12E-05 | 0,02047 | 1.48E-05 | 0,755 |
| 400 | 1,3424 | 0,942 | 1.93E-05 | 1.44E-05 | 0,02461 | 1.95E-05 | 0,738 |
| 450 | 1,1918 | 0,98 | 2.13E-05 | 1.79E-05 | 0,02897 | 2.48E-05 | 0,721 |
| 500 | 1,0732 | 1,013 | 2.33E-05 | 2.17E-05 | 0,03352 | 3.08E-05 | 0,702 |
| 550 | 0,9739 | 1,047 | 2.51E-05 | 2.57E-05 | 0,03821 | 3.75E-05 | 0,685 |
| 600 | 0,8938 | 1,076 | 2.68E-05 | 3.00E-05 | 0,04311 | 4.48E-05 | 0,668 |
| 650 | 0,8143 | 1.1 | 2.88E-05 | 3.54E-05 | 0,0445 | 4.97E-05 | 0,712 |
| 700 | 0,7564 | 1.13E+00 | 3.05E-05 | 4.03E-05 | 0,0481 | 5.63E-05 | 0,717 |
| 750 | 0,7057 | 1.15 | 3.21E-05 | 4.55E-05 | 0,0517 | 6.37E-05 | 0,714 |
| 800 | 0,6614 | 1.17E+00 | 3.37E-05 | 5.10E-05 | 0,0551 | 7.12E-05 | 0,716 |
Biologisk roll
Koldioxid är en slutprodukt av cellandning i organismer som får energi genom att bryta ner sockerarter, fetter och aminosyror med syre som en del av deras ämnesomsättning . Detta inkluderar alla växter, alger och djur samt aeroba svampar och bakterier. Hos ryggradsdjur färdas koldioxiden i blodet från kroppens vävnader till huden (t.ex. amfibier ) eller gälarna (t.ex. fiskar ), varifrån den löses upp i vattnet eller till lungorna där den andas ut. Under aktiv fotosyntes kan växter absorbera mer koldioxid från atmosfären än vad de släpper ut i andningen.
Fotosyntes och kolfixering

Kolfixering är en biokemisk process genom vilken atmosfärisk koldioxid införlivas av växter, alger och (cyanobakterier) i energirika organiska molekyler som glukos , och skapar därmed sin egen mat genom fotosyntes. Fotosyntes använder koldioxid och vatten för att producera sockerarter från vilka andra organiska föreningar kan konstrueras, och syre produceras som en biprodukt.
Ribulos-1,5-bisfosfatkarboxylasoxygenas , vanligen förkortat till RuBisCO, är enzymet involverat i det första stora steget av kolfixering, produktionen av två molekyler av 3-fosfoglycerat från CO 2 och ribulosbisfosfat , som visas i diagrammet på vänster.
RuBisCO tros vara det enskilt vanligaste proteinet på jorden.
Fototrofer använder produkterna från sin fotosyntes som interna livsmedelskällor och som råmaterial för biosyntesen av mer komplexa organiska molekyler, såsom polysackarider , nukleinsyror och proteiner. Dessa används för sin egen tillväxt, och även som bas för näringskedjor och nät som matar andra organismer, inklusive djur som vi själva. Några viktiga fototrofer, coccolitoforerna syntetiserar hårda kalciumkarbonatfjäll . En globalt betydelsefull art av coccolithophore är Emiliania huxleyi vars kalcitfjäll har legat till grund för många sedimentära bergarter som kalksten , där det som tidigare var atmosfäriskt kol kan förbli fixerat för geologiska tidsskalor.

Växter kan växa så mycket som 50 procent snabbare i koncentrationer på 1 000 ppm CO 2 jämfört med omgivningsförhållandena, även om detta förutsätter ingen förändring i klimatet och ingen begränsning av andra näringsämnen. Förhöjda CO 2 -nivåer orsakar ökad tillväxt som återspeglas i den skördbara avkastningen av grödor, med vete, ris och sojabönor som alla visar en ökning i avkastning på 12–14 % under förhöjd CO 2 i FACE-experiment.
Ökade CO 2 -koncentrationer i atmosfären resulterar i att färre stomata utvecklas på växter, vilket leder till minskad vattenanvändning och ökad vattenanvändningseffektivitet . Studier med FACE har visat att CO 2 -anrikning leder till minskade koncentrationer av mikronäringsämnen i växter. Detta kan ha negativa effekter på andra delar av ekosystemen eftersom växtätare kommer att behöva äta mer mat för att få samma mängd protein.
Koncentrationen av sekundära metaboliter såsom fenylpropanoider och flavonoider kan också förändras i växter som utsätts för höga koncentrationer av CO 2 .
Växter släpper också ut CO 2 under andning, och därför är majoriteten av växter och alger, som använder C3-fotosyntes , bara nettoabsorbenter under dagen. Även om en växande skog kommer att absorbera många ton CO 2 varje år, kommer en mogen skog att producera lika mycket CO 2 från andning och nedbrytning av döda exemplar (t.ex. nedfallna grenar) som används vid fotosyntes i växande växter. I motsats till den långvariga uppfattningen att de är kolneutrala, kan mogna skogar fortsätta att ackumulera kol och förbli värdefulla kolsänkor , vilket hjälper till att upprätthålla kolbalansen i jordens atmosfär. Dessutom, och avgörande för livet på jorden, förbrukar fotosyntes av växtplankton löst CO 2 i övre havet och främjar därmed absorptionen av CO 2 från atmosfären.
Giftighet

Koldioxidhalten i frisk luft (i genomsnitt mellan havsnivå och 10 kPa-nivå, dvs. cirka 30 km (19 mi) höjd) varierar mellan 0,036 % (360 ppm) och 0,041 % (412 ppm), beroende på platsen. [ förtydligande behövs ]
CO 2 är en kvävande gas och inte klassificerad som giftig eller skadlig i enlighet med Globally Harmonized System of Classification and Labeling of Chemicals standarder från United Nations Economic Commission for Europe med hjälp av OECD:s riktlinjer för testning av kemikalier . I koncentrationer upp till 1 % (10 000 ppm) kommer det att få vissa människor att känna sig dåsig och ge lungorna en kvav känsla. Koncentrationer på 7 % till 10 % (70 000 till 100 000 ppm) kan orsaka kvävning, även i närvaro av tillräckligt med syre, vilket visar sig som yrsel, huvudvärk, syn- och hörselstörningar och medvetslöshet inom några minuter till en timme. De fysiologiska effekterna av akut koldioxidexponering grupperas under termen hyperkapni , en undergrupp av kvävning .
Eftersom den är tyngre än luft, på platser där gasen sipprar från marken (på grund av vulkanisk eller geotermisk aktivitet under ytan) i relativt höga koncentrationer, utan vindens spridningseffekter, kan den samlas på skyddade platser under genomsnittlig mark. nivå, vilket gör att djur som befinner sig däri kvävs. Kadavermatare som lockas till kadaverna dödas då också. Barn har dödats på samma sätt nära staden Goma av koldioxidutsläpp från den närliggande vulkanen Mount Nyiragongo . Swahili - termen för detta fenomen är mazuku .
Anpassning till ökade koncentrationer av CO 2 sker hos människor, inklusive modifierad andning och njurbikarbonatproduktion, för att balansera effekterna av blodförsurning ( acidos ). Flera studier antydde att 2,0 procent inspirerade koncentrationer skulle kunna användas för slutna luftrum (t.ex. en ubåt ) eftersom anpassningen är fysiologisk och reversibel, eftersom försämring av prestanda eller normal fysisk aktivitet inte sker vid denna exponeringsnivå under fem dagar. Ändå visar andra studier en minskning av kognitiv funktion även på mycket lägre nivåer. Dessutom, med pågående respiratorisk acidos, kommer anpassnings- eller kompensationsmekanismer inte att kunna vända ett sådant tillstånd .
Under 1 %
Det finns få studier av hälsoeffekterna av långvarig kontinuerlig CO 2 -exponering på människor och djur vid nivåer under 1 %. Yrkesmässiga exponeringsgränser för CO 2 har satts i USA till 0,5 % (5000 ppm) under en åtta timmars period. Vid denna CO 2 -koncentration upplevde den internationella rymdstationens besättning huvudvärk, letargi, mental långsamhet, känslomässig irritation och sömnstörningar. Studier på djur med 0,5 % CO 2 har visat njurförkalkning och benförlust efter åtta veckors exponering. En studie av människor exponerade i 2,5 timmars sessioner visade signifikanta negativa effekter på kognitiva förmågor vid koncentrationer så låga som 0,1% (1000 ppm) CO 2 troligtvis på grund av CO 2 inducerade ökningar av cerebralt blodflöde. En annan studie observerade en minskning av grundläggande aktivitetsnivå och informationsanvändning vid 1000 ppm, jämfört med 500 ppm. En genomgång av litteraturen visade dock att de flesta studier på fenomenet koldioxid inducerade kognitiv försämring för att ha en liten effekt på beslutsfattande på hög nivå och de flesta studierna förvirrades av otillräckliga studiedesigner, miljövänlighet, osäkerheter i exponeringsdoser och olika kognitiva bedömningar som används. På liknande sätt har en studie om effekterna av koncentrationen av CO 2 i motorcykelhjälmar kritiserats för att ha tveksam metodik för att inte notera motorcykelförares självrapporter och göra mätningar med skyltdockor. Ytterligare när normala motorcykelförhållanden uppnåddes (som motorvägs- eller stadshastigheter) eller visiret höjdes sjönk koncentrationen av CO 2 till säkra nivåer (0,2%).
Ventilation
Dålig ventilation är en av huvudorsakerna till för höga CO 2 -koncentrationer i slutna utrymmen, vilket leder till dålig inomhusluftkvalitet . Koldioxidskillnaden över utomhuskoncentrationer vid stationära förhållanden (när beläggningen och ventilationssystemets drift är tillräckligt lång för att CO 2 -koncentrationen har stabiliserats) används ibland för att uppskatta ventilationshastigheter per person. [ citat behövs ] Högre CO 2 -koncentrationer är förknippade med passagerarnas hälsa, komfort och prestationsförsämring. ASHRAE Standard 62.1–2007 ventilationshastigheter kan resultera i inomhuskoncentrationer upp till 2 100 ppm över omgivande utomhusförhållanden. Så om utomhuskoncentrationen är 400 ppm, kan inomhuskoncentrationerna nå 2 500 ppm med ventilationshastigheter som uppfyller denna industrikonsensusstandard. Koncentrationer i dåligt ventilerade utrymmen kan hittas ännu högre än detta (intervall på 3 000 eller 4 000 ppm).
Gruvarbetare, som är särskilt känsliga för gasexponering på grund av otillräcklig ventilation, hänvisade till blandningar av koldioxid och kväve som " blackdamp ", "choke damp" eller "stythe". Innan mer effektiv teknik utvecklades, övervakade gruvarbetare ofta för farliga nivåer av fukt och andra gaser i gruvschakt genom att ta med sig en burad kanariefågel när de arbetade. Kanariefågeln är känsligare för kvävande gaser än människor, och när den blev medvetslös slutade den att sjunga och ramlade av sin sittpinne. Davy -lampan kunde också upptäcka höga halter av blackdamp (som sjunker och samlas nära golvet) genom att brinna mindre starkt, medan metan , en annan kvävande gas och explosionsrisk, skulle få lampan att brinna starkare.
I februari 2020 dog tre personer av kvävning på en fest i Moskva när torris (frusen CO 2 ) lades till en simbassäng för att kyla ner den. En liknande olycka inträffade 2018 när en kvinna dog av CO 2 -ångor från den stora mängd torris hon transporterade i sin bil.
Utomhusområden med förhöjda koncentrationer
Lokala koncentrationer av koldioxid kan nå höga värden nära starka källor, särskilt de som är isolerade av omgivande terräng. Vid den varma källan Bossoleto nära Rapolano Terme i Toscana , Italien, belägen i en skålformad fördjupning med cirka 100 m (330 fot) i diameter, stiger koncentrationerna av CO 2 till över 75 % över natten, tillräckligt för att döda insekter och smådjur. Efter soluppgången sprids gasen genom konvektion. Höga koncentrationer av CO 2 producerad av störning av djupt sjövatten mättat med CO 2 tros ha orsakat 37 dödsfall vid Lake Monoun , Kamerun 1984 och 1700 dödsoffer vid Lake Nyos , Kamerun 1986.
Mänsklig psykologi
Innehåll
| Blodfack | ( kPa ) | ( mm Hg ) | |
|---|---|---|---|
| Venös blodkoldioxid | 5,5–6,8 | 41–51 | 41–51 |
| Alveolära lunggastryck _ |
4.8 | 36 | 36 |
| Koldioxid i arteriell blod | 4,7–6,0 | 35–45 | 35–45 |
Kroppen producerar cirka 2,3 pund (1,0 kg) koldioxid per dag och person, innehållande 0,63 pund (290 g) kol. Hos människor transporteras denna koldioxid genom vensystemet och andas ut genom lungorna, vilket resulterar i lägre koncentrationer i artärerna . Koldioxidhalten i blodet anges ofta som partialtrycket , vilket är det tryck som koldioxiden skulle ha haft om den ensam hade upptagit volymen. Hos människor visas koldioxidhalten i blodet i tabellen intill.
Transport i blodet
CO 2 transporteras i blodet på tre olika sätt. (Exakta procentsatser varierar mellan arteriellt och venöst blod).
- Majoriteten (ca 70 % till 80 %) omvandlas till bikarbonatjoner HCO − 3 av enzymet kolsyraanhydras i de röda blodkropparna, genom reaktionen CO 2 + H 2 O → H 2 CO 3 → H + + HCO − 3 .
- 5–10 % löses i blodplasma
- % är bundet till hemoglobin som karbaminoföreningar
Hemoglobin , den huvudsakliga syrebärande molekylen i röda blodkroppar , bär både syre och koldioxid. CO 2 bunden till hemoglobin binder dock inte till samma ställe som syre. Istället kombineras det med de N-terminala grupperna på de fyra globinkedjorna. Men på grund av allosteriska effekter på hemoglobinmolekylen, minskar bindningen av CO 2 mängden syre som är bundet för ett givet partialtryck av syre. Detta är känt som Haldane-effekten och är viktigt för transporten av koldioxid från vävnaderna till lungorna. Omvänt kommer en ökning av partialtrycket för CO 2 eller ett lägre pH att orsaka avlastning av syre från hemoglobin, vilket är känt som Bohr-effekten .
Reglering av andning
Koldioxid är en av förmedlarna av lokal autoreglering av blodtillförseln. Om dess koncentration är hög kapillärerna för att möjliggöra ett större blodflöde till den vävnaden.
Bikarbonatjoner är avgörande för att reglera blodets pH. En persons andningshastighet påverkar nivån av CO 2 i blodet. Andning som är för långsam eller ytlig orsakar respiratorisk acidos , medan andning som är för snabb leder till hyperventilation , vilket kan orsaka respiratorisk alkalos .
Även om kroppen kräver syre för ämnesomsättningen, stimulerar låga syrenivåer normalt inte andningen. Snarare stimuleras andningen av högre koldioxidnivåer. Som ett resultat kan inandning av lågtrycksluft eller en gasblandning utan syre alls (som rent kväve) leda till medvetslöshet utan att någonsin uppleva lufthunger . Detta är särskilt farligt för stridspiloter på hög höjd. Det är också anledningen till att flygvärdinnor instruerar passagerare, i händelse av förlust av kabintryck, att applicera syrgasmasken på sig själva först innan de hjälper andra; annars riskerar man att förlora medvetandet.
Andningscentralerna försöker hålla ett arteriellt CO 2 -tryck på 40 mm Hg. Med avsiktlig hyperventilering kan CO 2 -halten i arteriellt blod sänkas till 10–20 mm Hg (syrehalten i blodet påverkas lite) och andningsdriften minskar. Det är därför man kan hålla andan längre efter att ha hyperventilerat än utan att hyperventilera. Detta medför risken att medvetslöshet kan uppstå innan behovet av att andas blir överväldigande, varför hyperventilering är särskilt farligt före fridykning.
Koncentrationer och roll i miljön
Atmosfär

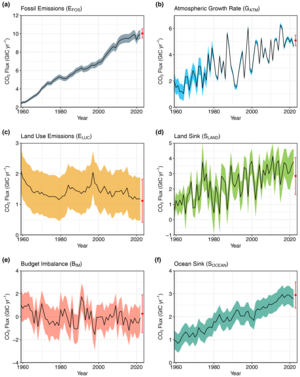
Koldioxid i jordens atmosfär är en spårgas som spelar en integrerad del i växthuseffekten , kolets kretslopp , fotosyntesen och det oceaniska kolets kretslopp . Det är en av flera växthusgaser i jordens atmosfär som bidrar till klimatförändringen på grund av ökande utsläpp av växthusgaser från mänsklig verksamhet. Den nuvarande globala genomsnittliga koncentrationen av CO 2 i atmosfären är 421 ppm i maj 2022. Detta är en ökning med 50 % sedan starten av den industriella revolutionen , upp från 280 ppm under de 10 000 åren före mitten av 1700-talet. Ökningen beror på mänsklig aktivitet . Förbränning av fossila bränslen är den främsta orsaken till dessa ökade CO 2 -koncentrationer och även den främsta orsaken till klimatförändringarna. Andra stora antropogena källor inkluderar cementproduktion, avskogning och biomassabränning.
koldioxid är transparent för synligt ljus är den en växthusgas som absorberar och avger infraröd strålning vid sina två infrarödaktiva vibrationsfrekvenser. CO 2 absorberar och avger infraröd strålning vid våglängder på 4,26 μm (2 347 cm −1 ) (asymmetriskt sträckande vibrationsläge ) och 14,99 μm (667 cm −1 ) (böjningsvibrationsläge). Det spelar en betydande roll för att påverka jordens yttemperatur genom växthuseffekten. Ljusemissionen från jordens yta är mest intensiv i det infraröda området mellan 200 och 2500 cm −1 , till skillnad från ljusemissionen från den mycket hetare solen som är mest intensiv i det synliga området. Absorption av infrarött ljus vid vibrationsfrekvenserna av atmosfärisk CO 2 fångar energi nära ytan, vilket värmer ytan och den lägre atmosfären. Mindre energi når den övre atmosfären, som därför är svalare på grund av denna absorption.
Ökning av atmosfäriska koncentrationer av CO 2 och andra långlivade växthusgaser som metan , dikväveoxid och ozon ökar absorptionen och emissionen av infraröd strålning från atmosfären, vilket orsakar den observerade ökningen av den globala medeltemperaturen och havsförsurningen . En annan direkt effekt är CO 2 - gödslingseffekten . Dessa förändringar orsakar en rad indirekta effekter av klimatförändringar på den fysiska miljön, ekosystemen och mänskliga samhällen. Koldioxid utövar en större total uppvärmningsinverkan än alla andra växthusgaser tillsammans. Den har en atmosfärisk livslängd som ökar med den ackumulerade mängden fossilt kol som utvinns och förbränns, på grund av den obalans som denna aktivitet har ålagt jordens snabba kolcykel . Detta betyder att en del (förutsedda 20-35 %) av det fossila kol som hittills har överförts kommer att finnas kvar i atmosfären som förhöjda CO 2 -nivåer i många tusen år efter att dessa kolöverföringsaktiviteter börjar avta. Kolets kretslopp är ett biogeokemiskt kretslopp där kol utbyts mellan jordens hav , jord, stenar och biosfären . Växter och andra fotoautotrofer använder solenergi för att producera kolhydrater från atmosfärisk koldioxid och vatten genom fotosyntes . Nästan alla andra organismer är beroende av kolhydrater som härrör från fotosyntesen som sin primära energikälla och kolföreningar.
Den nuvarande atmosfäriska koncentrationen av CO 2 är den högsta på 14 miljoner år. Koncentrationerna av CO 2 i atmosfären var så höga som 4 000 ppm under den kambriska perioden för cirka 500 miljoner år sedan, då koncentrationen var 20 gånger högre än idag, och så låg som 180 ppm under de senaste två miljoner årens kvartära glaciation . Rekonstruerade temperaturrekord för de senaste 420 miljoner åren indikerar att atmosfäriska CO 2 -koncentrationer nådde en topp vid ~2 000 ppm under devonperioden (~400 Ma) och återigen under triasperioden (220–200 Ma) och var fyra gånger nuvarande nivåer under Juraperiod (201-145 Ma).Hav
Havsförsurning
Koldioxid löses i havet och bildar kolsyra (H 2 CO 3 ), bikarbonat (HCO 3 − ) och karbonat (CO 3 2− ). Det finns ungefär femtio gånger så mycket koldioxid löst i haven som det finns i atmosfären. Havet fungerar som en enorm kolsänka och har tagit upp ungefär en tredjedel av koldioxid som släpps ut av mänsklig aktivitet.

Förändringar i havskemin kan ha omfattande direkta och indirekta effekter på organismer och deras livsmiljöer. En av de viktigaste återverkningarna av ökande havssyrahalt är produktionen av skal av kalciumkarbonat ( CaCO
3 ) . Denna process kallas förkalkning och är viktig för biologin och överlevnaden för ett brett spektrum av marina organismer. Förkalkning involverar utfällning av lösta joner i fasta CaCO
3 -strukturer, strukturer för många marina organismer, såsom kokolitoforer , foraminifer , kräftdjur , blötdjur , etc. Efter att de har bildats är dessa CaCO
3 -strukturer känsliga för upplösning om inte det omgivande havsvattnet innehåller mättande koncentrationer av karbonatjoner (CO 3 2− ).
Varmvatten ventilation
Koldioxid förs också in i haven genom hydrotermiska ventiler. Champagnens hydrotermiska ventil, som finns vid vulkanen Northwest Eifuku i Mariana Trench , producerar nästan ren flytande koldioxid, en av endast två kända platser i världen från 2004, den andra är i Okinawa - tråget . Fyndet av en undervattenssjö med flytande koldioxid i Okinawa-tråget rapporterades 2006.
Produktion
Biologiska processer
Koldioxid är en biprodukt från jäsningen av socker vid bryggning av öl , whisky och andra alkoholhaltiga drycker och vid produktion av bioetanol . Jäst metaboliserar socker för att producera CO 2 och etanol , även känd som alkohol, enligt följande:
Alla aeroba organismer producerar CO 2 när de oxiderar kolhydrater , fettsyror och proteiner . Det stora antalet inblandade reaktioner är ytterst komplexa och inte lätta att beskriva. Se ( cellandning , anaerob andning och fotosyntes ). Ekvationen för andningen av glukos och andra monosackarider är:
Anaeroba organismer bryter ner organiskt material och producerar metan och koldioxid tillsammans med spår av andra föreningar. Oavsett typ av organiskt material följer produktionen av gaser ett väldefinierat kinetiskt mönster . Koldioxid utgör cirka 40–45 % av den gas som härrör från nedbrytning i deponier (benämnt " deponigas" ). Merparten av de återstående 50–55 % är metan.
Industriella processer
Koldioxid kan erhållas genom destillation från luft, men metoden är ineffektiv. Industriellt är koldioxid till övervägande del en oåtervunnen avfallsprodukt, producerad med flera metoder som kan utövas i olika skalor.
Förbränning
Förbränning av alla kolbaserade bränslen , såsom metan ( naturgas ), petroleumdestillat ( bensin , diesel , fotogen , propan ) , kol, trä och generiskt organiskt material producerar koldioxid och, utom när det gäller rent kol, vatten . Som ett exempel, den kemiska reaktionen mellan metan och syre :
Järn reduceras från sina oxider med koks i en masugn och producerar tackjärn och koldioxid:
Biprodukt från väteproduktion
Koldioxid är en biprodukt av den industriella produktionen av väte genom ångreformering och vattengasskiftningsreaktionen vid ammoniakproduktion . Dessa processer börjar med reaktionen av vatten och naturgas (främst metan). Detta är en viktig källa till koldioxid av livsmedelskvalitet för användning vid kolsyresättning av öl och läsk , och används även för att bedöva djur som fjäderfä . Sommaren 2018 uppstod en brist på koldioxid för dessa ändamål i Europa på grund av att flera ammoniakanläggningar tillfälligt stängdes av för underhåll.
Termisk nedbrytning av kalksten
Det produceras genom termisk nedbrytning av kalksten, CaCO 3 genom upphettning ( kalcinering ) vid cirka 850 °C (1 560 °F), vid tillverkning av bränd kalk ( kalciumoxid , CaO ), en förening som har många industriella användningsområden:
Syror frigör CO 2 från de flesta metallkarbonater. Följaktligen kan den erhållas direkt från naturliga koldioxidkällor, där den produceras genom inverkan av försurat vatten på kalksten eller dolomit . Reaktionen mellan saltsyra och kalciumkarbonat (kalksten eller krita) visas nedan:
Kolsyran ( H 2 CO 3 ) sönderdelas sedan till vatten och CO 2 :
Sådana reaktioner åtföljs av skumning eller bubbling, eller bådadera, när gasen frigörs. De har utbredd användning inom industrin eftersom de kan användas för att neutralisera avfallssyraströmmar.
Kommersiell användning
Koldioxid används av livsmedelsindustrin, oljeindustrin och den kemiska industrin. Föreningen har olika kommersiella användningsområden men en av dess största användningsområden som kemikalie är vid framställning av kolsyrade drycker; det ger gnistan i kolsyrade drycker som sodavatten, öl och mousserande vin.
Prekursor till kemikalier
Inom den kemiska industrin konsumeras koldioxid huvudsakligen som en ingrediens i produktionen av urea , varvid en mindre del används för att producera metanol och en rad andra produkter. Vissa karboxylsyraderivat som natriumsalicylat framställs med hjälp av CO 2 genom Kolbe-Schmitt-reaktionen .
Förutom konventionella processer som använder CO 2 för kemisk produktion, utforskas även elektrokemiska metoder på forskningsnivå. I synnerhet är användningen av förnybar energi för produktion av bränslen från CO 2 (som metanol) attraktiv eftersom detta kan resultera i bränslen som lätt kan transporteras och användas inom konventionell förbränningsteknik men som inte har några nettoutsläpp av CO 2 .
Lantbruk
Växter kräver koldioxid för att utföra fotosyntes. Atmosfären i växthus kan (om den är stor, måste) berikas med ytterligare CO 2 för att upprätthålla och öka växternas tillväxttakt. Vid mycket höga koncentrationer (100 gånger atmosfärskoncentrationen eller mer) kan koldioxid vara giftigt för djurlivet, så att höja koncentrationen till 10 000 ppm (1 %) eller högre under flera timmar kommer att eliminera skadedjur som vitflugor och spindkvalster i en växthus.
Livsmedel
Koldioxid är en livsmedelstillsats som används som drivmedel och surhetsreglerande medel i livsmedelsindustrin. Den är godkänd för användning i EU (listad som E-nummer E290), USA och Australien och Nya Zeeland (listad med dess INS-nummer 290).
En godis som kallas Pop Rocks trycksätts med koldioxidgas vid cirka 4 000 kPa (40 bar ; 580 psi ). När det placeras i munnen löses det upp (precis som annat hårt godis) och släpper gasbubblorna med ett hörbart knall.
Jäsningsmedel får degen att jäsa genom att producera koldioxid. Bakerijäst producerar koldioxid genom jäsning av sockerarter i degen, medan kemiska jäser som bakpulver och bakpulver frigör koldioxid när den värms upp eller om den utsätts för syror .
Drycker
Koldioxid används för att producera kolsyrade läskedrycker och sodavatten . Traditionellt har kolsyran av öl och mousserande vin skett genom naturlig jäsning, men många tillverkare kolsyrar dessa drycker med koldioxid som återvinns från jäsningsprocessen. När det gäller öl på flaska och fat är den vanligaste metoden som används kolsyra med återvunnen koldioxid. Med undantag för brittisk real ale överförs fatöl vanligtvis från fat i ett kallt rum eller källare till att tappa kranar på stången med trycksatt koldioxid, ibland blandad med kväve.
Smaken av sodavatten (och relaterade smakupplevelser i andra kolsyrade drycker) är en effekt av den lösta koldioxiden snarare än gasens sprängande bubblor. Kolsyraanhydras 4 omvandlas till kolsyra vilket leder till en sur smak, och även den lösta koldioxiden inducerar en somatosensorisk respons.
Vinframställning
Koldioxid i form av torris används ofta under den kalla blötläggningsfasen vid vinframställning för att kyla druvklasar snabbt efter plockning för att förhindra spontan jäsning av vildjäst . Den största fördelen med att använda torris framför vattenis är att det kyler druvorna utan att tillsätta något extra vatten som kan minska sockerkoncentrationen i druvmusten och därmed alkoholkoncentrationen i det färdiga vinet. Koldioxid används också för att skapa en hypoxisk miljö för kolmaceration , den process som används för att producera Beaujolais -vin.
Koldioxid används ibland för att fylla på vinflaskor eller andra förvaringskärl såsom fat för att förhindra oxidation, även om det har problemet att det kan lösas upp i vinet, vilket gör ett tidigare stilla vin något kolsyrat. Av denna anledning föredras andra gaser som kväve eller argon för denna process av professionella vinmakare.
Fantastiska djur
Koldioxid används ofta för att "bedöva" djur före slakt. "Att bedöva" kan vara en felaktig benämning, eftersom djuren inte slås ut omedelbart och kan drabbas av nöd.
Inert gas
Koldioxid är en av de mest använda komprimerade gaserna för pneumatiska (tryckgas) system i bärbara tryckverktyg. Koldioxid används också som atmosfär för svetsning , även om den i svetsbågen reagerar för att oxidera de flesta metaller. Användning inom bilindustrin är vanlig trots betydande bevis för att svetsar gjorda i koldioxid är sprödare än de som görs i mer inerta atmosfärer. [ Citat behövs ] När det används för MIG-svetsning , kallas CO 2 -användning ibland som MAG-svetsning, för Metal Active Gas, eftersom CO 2 kan reagera vid dessa höga temperaturer. Det tenderar att producera en varmare pöl än verkligt inerta atmosfärer, vilket förbättrar flödesegenskaperna. Även om detta kan bero på atmosfäriska reaktioner som inträffar på pölplatsen. Detta är vanligtvis motsatsen till den önskade effekten vid svetsning, eftersom det tenderar att spröda platsen, men kanske inte är ett problem för allmän svetsning av mjukt stål, där den ultimata formbarheten inte är ett stort problem.
Koldioxid används i många konsumentprodukter som kräver trycksatt gas eftersom det är billigt och icke brandfarligt, och eftersom det genomgår en fasövergång från gas till vätska vid rumstemperatur vid ett uppnåeligt tryck på cirka 60 bar (870 psi ; 59 atm ) , vilket tillåter mycket mer koldioxid för att få plats i en given behållare än annars skulle. Flytvästar innehåller ofta kanistrar med trycksatt koldioxid för snabb uppblåsning. Aluminiumkapslar av CO 2 säljs också som förråd av komprimerad gas för luftpistoler , paintball- markörer/pistoler, pumpning av cykeldäck och för att göra kolsyrat vatten . Höga koncentrationer av koldioxid kan också användas för att döda skadedjur. Flytande koldioxid används vid superkritisk torkning av vissa livsmedelsprodukter och tekniska material, vid beredning av prover för svepelektronmikroskopi och vid koffeinering av kaffebönor .
Brandsläckare
Koldioxid kan användas för att släcka lågor genom att översvämma miljön runt lågan med gasen. Den reagerar inte själv för att släcka lågan, utan svälter lågan på syre genom att förskjuta den. Vissa brandsläckare , särskilt de som är konstruerade för elektriska bränder , innehåller flytande koldioxid under tryck. Koldioxidsläckare fungerar bra på små brandfarliga vätskor och elektriska bränder, men inte på vanliga brännbara bränder, eftersom de inte kyler ned de brinnande ämnena nämnvärt, och när koldioxiden sprids kan de fatta eld vid exponering för atmosfäriskt syre . De används främst i serverrum.
Koldioxid har också använts i stor utsträckning som släckningsmedel i fasta brandskyddssystem för lokal applicering av specifika faror och total översvämning av ett skyddat utrymme. International Maritime Organizations standarder erkänner koldioxidsystem för brandskydd av fartygslastrum och maskinrum. Koldioxidbaserade brandskyddssystem har kopplats till flera dödsfall, eftersom det kan orsaka kvävning i tillräckligt höga koncentrationer. En genomgång av CO 2 -system identifierade 51 incidenter mellan 1975 och rapportens datum (2000), som orsakade 72 dödsfall och 145 skador.
Superkritisk CO 2 som lösningsmedel
Flytande koldioxid är ett bra lösningsmedel för många lipofila organiska föreningar och används för att ta bort koffein från kaffe . Koldioxid har uppmärksammats inom läkemedels- och andra kemiska processindustrier som ett mindre giftigt alternativ till mer traditionella lösningsmedel som organoklorider . Det används också av vissa kemtvättar av denna anledning. Det används vid framställning av vissa aerogeler på grund av egenskaperna hos superkritisk koldioxid.
Medicinsk och farmakologisk användning
Inom medicin tillsätts upp till 5 % koldioxid (130 gånger atmosfärskoncentrationen) till syre för att stimulera andningen efter apné och för att stabilisera O 2 /CO 2 -balansen i blodet.
Koldioxid kan blandas med upp till 50 % syre och bildar en inhalerbar gas; detta är känt som Carbogen och har en mängd olika medicinska och forskningsanvändningar.
En annan medicinsk användning är mofette , torra spa som använder koldioxid från postvulkaniska urladdningar för terapeutiska ändamål.
Energi
Superkritisk CO 2 används som arbetsvätska i Allam- motorn.
Återvinning av fossila bränslen
Koldioxid används för ökad oljeutvinning där den injiceras i eller intill producerande oljekällor, vanligtvis under superkritiska förhållanden, när den blir blandbar med oljan. Detta tillvägagångssätt kan öka den ursprungliga oljeutvinningen genom att minska kvarvarande oljemättnad med 7–23 % utöver primärextraktionen . Det fungerar både som ett trycksättande medel och, när det löses upp i den underjordiska råoljan , minskar det avsevärt dess viskositet och förändrar ytkemin, vilket gör att oljan kan flöda snabbare genom reservoaren till borttagningsbrunnen. I mogna oljefält används omfattande rörnät för att transportera koldioxiden till injektionsställena.
I förbättrad kolbäddsmetanutvinning skulle koldioxid pumpas in i kollagen för att ersätta metan, i motsats till nuvarande metoder som i första hand förlitar sig på avlägsnande av vatten (för att minska trycket) för att få kollagen att släppa sin instängda metan.
Bioomvandling till bränsle
Det har föreslagits att CO 2 från kraftproduktion bubblas in i dammar för att stimulera tillväxt av alger som sedan kan omvandlas till biodiesel . En stam av cyanobakterien Synechococcus elongatus har genmanipulerats för att producera bränslena isobutyraldehyd och isobutanol från CO 2 med hjälp av fotosyntes.
Forskare har utvecklat en process som kallas elektrolys, som använder enzymer isolerade från bakterier för att driva de kemiska reaktionerna som omvandlar CO 2 till bränslen.
Kylmedel
Flytande och fast koldioxid är viktiga kylmedel , särskilt inom livsmedelsindustrin, där de används under transport och lagring av glass och andra frysta livsmedel. Fast koldioxid kallas "torris" och används för små försändelser där kylutrustning inte är praktisk. Fast koldioxid är alltid under −78,5 °C (−109,3 °F) vid vanligt atmosfärstryck, oavsett lufttemperatur.
klorfluorkolförening av användes som ett köldmedium före användningen diklordifluormetan ( R12, en (CFC)) . CO 2 kan få en renässans eftersom en av de främsta ersättningarna för CFC, 1,1,1,2-tetrafluoretan ( R134a , en hydrofluorocarbon (HFC)-förening) bidrar till klimatförändringen mer än CO 2 gör. CO 2 fysikaliska egenskaper är mycket gynnsamma för kylning, kylning och uppvärmning, med en hög volymetrisk kylkapacitet. På grund av behovet av att arbeta vid tryck på upp till 130 bar (1 900 psi; 13 000 kPa) kräver CO 2 -system mycket mekaniskt motståndskraftiga reservoarer och komponenter som redan har utvecklats för massproduktion i många sektorer. I billuftkonditionering fungerar CO 2 (R744) mer effektivt i mer än 90 % av alla körförhållanden för breddgrader högre än 50° än system som använder HFC (t.ex. R134a). Dess miljöfördelar ( GWP på 1, icke-ozonnedbrytande, giftfri, icke brandfarlig) skulle kunna göra den till den framtida arbetsvätskan för att ersätta nuvarande HFC i bland annat bilar, stormarknader och värmepumpsvattenberedare. Coca-Cola har ställt in CO 2 -baserade dryckskylare och den amerikanska armén är intresserad av CO 2 kyl- och värmeteknik.
Mindre användningsområden
Koldioxid är det lasrande mediet i en koldioxidlaser , som är en av de tidigaste typerna av lasrar.
Koldioxid kan användas som ett sätt att kontrollera pH-värdet i simbassänger, genom att kontinuerligt tillföra gas till vattnet, vilket förhindrar att pH-värdet stiger. Bland fördelarna med detta är undvikandet av hantering av (farligare) syror. På liknande sätt används det också i underhållsrevets akvarier , där det vanligtvis används i kalciumreaktorer för att tillfälligt sänka pH-värdet i vatten som passeras över kalciumkarbonat för att tillåta kalciumkarbonatet att lösas upp i vattnet mer fritt, där det är används av vissa koraller för att bygga sitt skelett.
Används som primärkylvätska i den brittiska avancerade gaskylda reaktorn för kärnkraftsproduktion.
Koldioxidinduktion används vanligtvis för avlivning av försöksdjur. Metoder för att administrera CO 2 inkluderar att placera djur direkt i en sluten, förfylld kammare som innehåller CO 2 , eller exponering för en gradvis ökande koncentration av CO 2 . American Veterinary Medical Associations 2020 riktlinjer för koldioxidinduktion säger att en förskjutningshastighet på 30–70 % av kammarens eller burens volym per minut är optimal för human dödshjälp av små gnagare. Procentandelen CO 2 varierar för olika arter, baserat på identifierade optimala procentsatser för att minimera nöd.
Koldioxid används också i flera relaterade rengörings- och ytbehandlingstekniker .
Upptäcktshistoria

Koldioxid var den första gasen som beskrevs som ett diskret ämne. Omkring 1640 observerade den flamländska kemisten Jan Baptist van Helmont att när han brände kol i ett stängt kärl, var massan av den resulterande askan mycket mindre än den för det ursprungliga kolet. Hans tolkning var att resten av kolet hade omvandlats till en osynlig substans som han kallade en "gas" eller "vild ande" ( spiritus sylvestris ).
Koldioxidens egenskaper studerades ytterligare på 1750-talet av den skotske läkaren Joseph Black . Han fann att kalksten ( kalciumkarbonat ) kunde värmas eller behandlas med syror för att ge en gas som han kallade "fixerad luft". Han observerade att den fasta luften var tätare än luft och stödde varken flammor eller djurliv. Black fann också att när det bubblades genom kalkvatten (en mättad vattenlösning av kalciumhydroxid ), skulle det fälla ut kalciumkarbonat. Han använde detta fenomen för att illustrera att koldioxid produceras av djurs andning och mikrobiell jäsning. År 1772 publicerade den engelske kemisten Joseph Priestley en artikel med titeln Impregnating Water with Fixed Air där han beskrev en process för att droppa svavelsyra (eller olja av vitriol som Priestley kände det) på krita för att producera koldioxid och tvinga gasen att lös upp genom att röra om en skål med vatten i kontakt med gasen.
Koldioxid kondenserades först (vid förhöjda tryck) 1823 av Humphry Davy och Michael Faraday . Den tidigaste beskrivningen av fast koldioxid ( torris ) gavs av den franske uppfinnaren Adrien-Jean-Pierre Thilorier, som 1835 öppnade en trycksatt behållare med flytande koldioxid, bara för att konstatera att den kylning som skapades av den snabba förångningen av vätskan gav en "snö" av fast CO 2 .
Se även
- Arteriell blodgas – Ett test av blod taget från en artär som mäter mängden av vissa lösta gaser
- Bosch-reaktion – bildar elementärt kol från CO2 och väte med hjälp av en metallisk katalysator
- Borttagning av koldioxid – Avlägsnande av atmosfärisk koldioxid (från atmosfären)
- Lista över minst koldioxideffektiva kraftverk
- Lista över länder efter koldioxidutsläpp
- Meromiktisk sjö – Permanent skiktad sjö med vattenlager som inte blandas
- Gilbert Plass – kanadensisk fysiker (tidigt arbete med CO 2 och klimatförändringar)
- Sabatier-reaktion – Metaniseringsprocess av koldioxid med väte
- NASA:s Orbiting Carbon Observatory 2 – NASA klimatsatellitsidor
- Växthusgaser som observerar satellit – Jordobservationssatellit
- Jordgas – jord – utbyte av gaser mellan växtrötter och atmosfären
externa länkar
|
Biblioteksresurser om koldioxid |




![{\displaystyle K_{\mathrm {h} }={\frac {{\ce {[H2CO3]}}}{{\ce {[CO2_{(aq)}]}}}}=1.70\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b01be634ec0c3d83cbf3aa2c71bbd51b9ce0e26)

![{\displaystyle K_{\mathrm {a1} }={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6013fac05dba06751345e4d824c525ed2c43b12)
![{\displaystyle K_{\mathrm {a1} }{\rm {(apparent)}}={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3] + [CO2_{(aq)}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ae2fa07440c037d6054ce4e7ef95c15c59264e7)