Iridium
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iridium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Uttal |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | silvervit | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomvikt A r °(Ir) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iridium i det periodiska systemet | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer ( Z ) | 77 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupp | grupp 9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blockera | d-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [ Xe ] 4f 14 5d 7 6s 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner per skal | 2, 8, 18, 32, 15, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikaliska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fas vid STP | fast | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | 2719 K (2446 °C, 4435 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kokpunkt | 4403 K (4130 °C, 7466 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitet (nära rt ) | 22,56 g/cm 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| när flytande (vid mp ) | 19 g/cm 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Värme av fusion | 41,12 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Förångningsvärme | 564 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molär värmekapacitet | 25,10 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ångtryck
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomegenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | −3, −1, 0, +1, +2, +3 , +4 , +5, +6, +7, +8, +9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronnegativitet | Pauling-skala: 2,20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Joniseringsenergier |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom radie | empiri: 136 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radie | 141±6 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spektrallinjer av iridium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Andra egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naturlig förekomst | ursprunglig | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | <a i=0>ansiktscentrerad kubik (fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ljudhastighet tunn stång | 4825 m/s (vid 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termisk expansion | 6,4 µm/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Värmeledningsförmåga | 147 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk resistans | 47,1 nΩ⋅m (vid 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetisk beställning | paramagnetisk | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetisk känslighet | +25,6 × 10 −6 cm 3 /mol (298 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Youngs modul | 528 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skjuvmodul | 210 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulkmodul | 320 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson-förhållande | 0,26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hårdhet | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers hårdhet | 1760–2200 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hårdhet | 1670 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7439-88-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Upptäckt och första isolering | Smithson Tennant (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoper av iridium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Iridium är ett kemiskt grundämne med symbolen Ir och atomnummer 77. En mycket hård, spröd, silvervit övergångsmetall av platinagruppen , den anses vara den näst tätaste naturligt förekommande metallen (efter osmium ) med en densitet på 22,56 g /cm3 ( 0,815 lb/cu tum) enligt definition med experimentell röntgenkristallografi . Det är en av de mest korrosionsbeständiga metallerna, även vid temperaturer så höga som 2 000 °C (3 630 °F). Korrosionsbeständighet är dock inte kvantifierbar i absoluta termer; även om endast vissa smälta salter och halogener är frätande för fast iridium, är finfördelat iridiumdamm mycket mer reaktivt och kan vara brandfarligt, medan gulddamm inte är brandfarligt utan kan angripas av ämnen som iridium motstår, såsom aqua regia .
Iridium upptäcktes 1803 bland olösliga föroreningar i naturlig platina . Smithson Tennant , den primära upptäckaren, döpte den efter den grekiska gudinnan Iris , personifiering av regnbågen, på grund av de slående och olika färgerna på dess salter. Iridium är ett av de mest sällsynta elementen i jordskorpan , med en årlig produktion och konsumtion på endast 3 ton (6,6 tusen pund). 191 Ir och 193 Ir är de enda två naturligt förekommande isotoper av iridium, samt de enda stabila isotoper ; den senare är desto rikligare.
De dominerande användningsområdena för iridium är själva metallen och dess legeringar, som i högpresterande tändstift , deglar för omkristallisering av halvledare vid höga temperaturer och elektroder för produktion av klor i kloralkaliprocessen . Viktiga föreningar av iridium är klorider och jodider i industriell katalys . Iridium är en komponent i vissa OLED.
Iridium finns i meteoriter i mycket högre mängd än i jordskorpan. Av denna anledning gav den ovanligt höga förekomsten av iridium i lerlagret vid gränsen mellan Krita och Paleogen upphov till Alvarez-hypotesen att inverkan av ett massivt utomjordiskt föremål orsakade utrotningen av dinosaurier och många andra arter för 66 miljoner år sedan, nu känd. att produceras av nedslaget som bildade Chicxulub-kratern . På samma sätt antydde en iridiumanomali i kärnprover från Stilla havet Eltanin-effekten för cirka 2,5 miljoner år sedan.
Man tror att den totala mängden iridium på planeten Jorden är mycket högre än den som observeras i jordskorpan, men som med andra metaller i platinagruppen orsakade den höga densiteten och tendensen hos iridium att binda till järn det mesta av iridium att sjunka under skorpan när planeten var ung och fortfarande smält.
Egenskaper
Fysikaliska egenskaper
En medlem av platinagruppen metaller , iridium är vit, liknar platina , men med en lätt gulaktig cast. På grund av sin hårdhet , sprödhet och mycket höga smältpunkt är fast iridium svårt att bearbeta, forma eller bearbeta; sålunda används vanligen pulvermetallurgi istället. Det är den enda metallen som upprätthåller goda mekaniska egenskaper i luft vid temperaturer över 1 600 °C (2 910 °F). Den har den 10:e högsta kokpunkten bland alla element och blir en supraledare vid temperaturer under 0,14 K (−273,010 °C; −459,418 °F).
Iridiums elasticitetsmodul är den näst högsta bland metallerna och överträffas endast av osmium . Detta, tillsammans med en hög skjuvmodul och en mycket låg siffra för Poissons förhållande (förhållandet mellan längsgående och lateral töjning ), indikerar den höga graden av styvhet och motståndskraft mot deformation som har gjort tillverkningen till användbara komponenter till en stor svårighetsfråga. Trots dessa begränsningar och iridiums höga kostnad har ett antal applikationer utvecklats där mekanisk hållfasthet är en väsentlig faktor i några av de extremt svåra förhållanden som uppstår i modern teknik.
Den uppmätta densiteten för iridium är bara något lägre (med cirka 0,12%) än den för osmium, den tätaste metallen som är kända. En viss tvetydighet uppstod angående vilket av de två elementen som var tätare, på grund av den lilla storleken på skillnaden i densitet och svårigheter att mäta den exakt, men med ökad noggrannhet i faktorer som användes för att beräkna densitet, gav röntgenkristallografiska data densiteter på 22,56 g/cm3 ( 0,815 lb/cu in) för iridium och 22,59 g/cm3 ( 0,816 lb/cu in) för osmium.
Iridium är extremt skört, till den grad att det är svårt att svetsa eftersom den värmepåverkade zonen spricker, men den kan göras mer seg genom att tillsätta små mängder titan och zirkonium (0,2% av varje fungerar tydligen bra).-
Vickers -hårdheten för ren platina är 56 HV, medan platina med 50 % iridium kan nå över 500 HV.
Kemiska egenskaper
Iridium är den mest korrosionsbeständiga metallen som är känd: den angrips inte av syror , inklusive aqua regia . I närvaro av syre reagerar det med cyanidsalter . Traditionella oxidanter reagerar också, inklusive halogener och syre vid högre temperaturer. Iridium reagerar också direkt med svavel vid atmosfärstryck för att ge iridiumdisulfid .
Isotoper
Iridium har två naturligt förekommande, stabila isotoper , 191 Ir och 193 Ir, med naturliga mängder av 37,3% respektive 62,7%. Minst 37 radioisotoper har också syntetiserats, med ett masstal från 164 till 202. 192 Ir , som faller mellan de två stabila isotoperna, är den mest stabila radioisotopen, med en halveringstid på 73,827 dagar, och finner tillämpning i brachyterapi och inom industriell radiografi , särskilt för oförstörande provning av svetsar i stål i olje- och gasindustrin; iridium-192-källor har varit inblandade i ett antal radiologiska olyckor. Tre andra isotoper har halveringstider på minst ett dygn - 188 Ir, 189 Ir och 190 Ir. Isotoper med massor under 191 sönderfaller genom någon kombination av β + sönderfall , α sönderfall och (sällsynt) protonemission , med undantag av 189 Ir, som sönderfaller genom elektronfångning . Syntetiska isotoper som är tyngre än 191 sönderfaller genom β − sönderfall , även om 192 Ir också har en mindre elektroninfångningsväg. Alla kända isotoper av iridium upptäcktes mellan 1934 och 2008, med de senaste upptäckterna 200–202 Ir.
Minst 32 metastabila isomerer har karakteriserats, med ett masstal från 164 till 197. Den mest stabila av dessa är 192 m2 Ir, som sönderfaller genom isomer övergång med en halveringstid på 241 år, vilket gör den mer stabil än någon av iridiums syntetiska material. isotoper i deras grundtillstånd. Den minst stabila isomeren är 190m3 Ir med en halveringstid på endast 2 μs. Isotopen 191 Ir var den första av något element som visades presentera en Mössbauer-effekt . Detta gör det användbart för Mössbauer-spektroskopi för forskning inom fysik, kemi, biokemi, metallurgi och mineralogi.
Kemi
| Oxidationstillstånd | |
|---|---|
| −3 |
[Ir(CO) 3 ] 3− |
| −1 | [Ir(CO) 3 (PPh 3 )] 1− |
| 0 | Ir4 ( CO) 12 |
| +1 | [IrCl(CO)( PPh3 ) 2 ] |
| +2 | Ir ( C5H5 ) 2 _ |
| +3 | IrCl 3 |
| +4 | IrO 2 |
| +5 | Ir 4 F 20 |
| +6 |
IrF 6 |
| +7 | [Ir( O2 ) O2 ] + |
| +8 | IrO 4 |
| +9 | [ IrO4 ] + |
Oxidationstillstånd
Iridium bildar föreningar i oxidationstillstånd mellan -3 och +9, men de vanligaste oxidationstillstånden är +1, +3 och +4. Välkarakteriserade föreningar som innehåller iridium i +6-oxidationstillståndet inkluderar IrF 6 och oxiderna Sr 2 MgIrO 6 och Sr 2 CaIrO 6 . iridium (VIII)oxid ( IrO4 . ) genererades under matrisisoleringsbetingelser vid 6 K i argon Det högsta oxidationstillståndet (+9), vilket också är det högsta registrerade för något grundämne, finns i gasformig [IrO 4 ] + .
Binära föreningar
Iridium bildar inte binära hydrider . Endast en binär oxid är välkarakteriserad: iridiumdioxid , IrO
2 . Det är en blå svart fast substans som antar fluoritstrukturen . En seskvioxid , Ir
2 O
3 , har beskrivits som ett blåsvart pulver, som oxideras till IrO
2 av HNO
3 . Motsvarande disulfider, diselenider, seskvisulfider och sesquiselenider är kända, såväl som IrS3
.
Binära trihalider, IrX3
, är kända för alla halogener. För oxidationstillstånd +4 och högre är endast tetrafluorid , pentafluorid och hexafluorid kända. Iridiumhexafluorid, IrF
6 , är ett flyktigt gult fast ämne som består av oktaedriska molekyler. Det sönderdelas i vatten och reduceras till IrF
4 . Iridiumpentafluorid är också en stark oxidant, men det är en tetramer , Ir
4 F
20 , bildad av fyra hörndelade oktaedrar.
Komplex

Iridium har omfattande koordinationskemi .
Iridium i dess komplex är alltid lågspinnande . Ir(III) och Ir(IV) bildar i allmänhet oktaedriska komplex . Polyhydridkomplex är kända för +5 och +3 oxidationstillstånd. Ett IrH5 ( PiPr3 ) 2 . _ exempel är Den ternära hydriden Mg
6 Ir
2 H
11 tros innehålla både IrH
4− 5 och 18-elektronens IrH
5− 4 anjon.
Iridium bildar även oxyanjoner med oxidationstillstånden +4 och +5. K
2 IrO
3 och KIrO
3 kan framställas från reaktionen av kaliumoxid eller kaliumsuperoxid med iridium vid höga temperaturer. Sådana fasta ämnen är inte lösliga i konventionella lösningsmedel.
Precis som många grundämnen bildar iridium viktiga kloridkomplex. Hexakloriridinsyra (IV), H
2 IrCl
6 , och dess ammoniumsalt är de vanligaste iridiumföreningarna ur ett industriellt och preparativt perspektiv. De är mellanprodukter vid rening av iridium och används som prekursorer för de flesta andra iridiumföreningar, såväl som vid framställning av anodbeläggningar . IrCl vice 2−6
IrCl -jonen har en intensiv mörkbrun färg och kan lätt reduceras till den ljusare 3−6 och
. versa Iridiumtriklorid , IrCl
3 , som kan erhållas i vattenfri form från direkt oxidation av iridiumpulver med klor vid 650 °C, eller i hydratiserad form genom att lösa Ir
2 O
3 i saltsyra , används ofta som utgångsmaterial för syntesen av andra Ir(III)-föreningar. En annan förening som används , (
NH4 )
3IrCl6
som utgångsmaterial är ammoniumhexakloriridat(III) .
I närvaro av luft löses iridiummetall i smälta alkalimetallcyanider för att producera Ir(CN) 3−6
. (hexacyanoiridat)-jonen
Organoiridium kemi

Organoiridiumföreningar innehåller iridium- kolbindningar . Tidiga studier identifierade den mycket stabila tetrairidiumdodekakarbonyl , Ir
4 (CO)
12 . I denna förening är var och en av iridiumatomerna bunden till de andra tre och bildar ett tetraedriskt kluster. Upptäckten av Vaskas komplex ( IrCl(CO)[P(C
6 H
5 )
3 ]
2 ) öppnade dörren för oxidativa additionsreaktioner , en process som är grundläggande för användbara reaktioner. Till exempel, Crabtree's catalyst , en homogen katalysator för hydreringsreaktioner .

Iridiumkomplex spelade en avgörande roll i utvecklingen av kol-vätebindningsaktivering (CH-aktivering), som lovar att möjliggöra funktionalisering av kolväten, som traditionellt betraktas som oreaktiva.
Historia
Platinagruppen

Upptäckten av iridium är sammanflätad med den av platina och de andra metallerna i platinagruppen. Den första europeiska referensen till platina förekommer 1557 i den italienske humanisten Julius Caesar Scaligers skrifter som en beskrivning av en okänd ädelmetall som hittats mellan Darién och Mexiko, "som ingen eld eller något spanskt konstverk ännu har kunnat göra flytande". Från sina första möten med platina såg spanjorerna i allmänhet metallen som en sorts förorening i guld, och den behandlades som sådan. Det slängdes ofta helt enkelt och det fanns ett officiellt dekret som förbjöd förfalskning av guld med platinaföroreningar.


År 1735 såg Antonio de Ulloa och Jorge Juan y Santacilia indianer bryta platina medan spanjorerna reste genom Colombia och Peru i åtta år. Ulloa och Juan hittade minor med de vitaktiga metallklumparna och tog dem hem till Spanien. Antonio de Ulloa återvände till Spanien och etablerade det första mineralogilaboratoriet i Spanien och var den första som systematiskt studerade platina, vilket var 1748. Hans historiska redogörelse för expeditionen inkluderade en beskrivning av platina som varken separerbar eller brännbar . Ulloa förutsåg också upptäckten av platinagruvor. Efter att ha publicerat rapporten 1748 fortsatte Ulloa inte att undersöka den nya metallen. 1758 skickades han till övervakare för kvicksilverbrytning i Huancavelica .
1741 hittade Charles Wood, en brittisk metallurg , olika prover av colombiansk platina på Jamaica, som han skickade till William Brownrigg för vidare undersökning.
År 1750, efter att ha studerat platina som Wood skickade till honom, presenterade Brownrigg en detaljerad redogörelse för metallen för Royal Society, och påstod att han inte hade sett något omnämnande av det i några tidigare redovisningar av kända mineraler. Brownrigg noterade också platinas extremt höga smältpunkt och eldfasthet mot borax . [ förtydligande behövs ] Andra kemister över hela Europa började snart studera platina, inklusive Andreas Sigismund Marggraf , Torbern Bergman , Jöns Jakob Berzelius , William Lewis och Pierre Macquer . År 1752 Henrik Scheffer en detaljerad vetenskaplig beskrivning av metallen, som han kallade "vitt guld", inklusive en redogörelse för hur han lyckades smälta platinamalm med hjälp av arsenik . Scheffer beskrev platina som mindre böjlig än guld, men med liknande motståndskraft mot korrosion.
Upptäckt
Kemister som studerade platina löste det i aqua regia (en blandning av saltsyra och salpetersyra ) för att skapa lösliga salter. De observerade alltid en liten mängd av en mörk, olöslig rest. Joseph Louis Proust trodde att resten var grafit . De franska kemisterna Victor Collet-Descotils , Antoine François , comte de Fourcroy och Louis Nicolas Vauquelin observerade också den svarta återstoden 1803, men fick inte tillräckligt för ytterligare experiment.
År 1803 analyserade den brittiske vetenskapsmannen Smithson Tennant (1761–1815) den olösliga återstoden och drog slutsatsen att den måste innehålla en ny metall. Vauquelin behandlade pulvret växelvis med alkali och syror och fick en ny flyktig oxid, som han trodde var av denna nya metall – som han kallade ptene , från det grekiska ordet πτηνός ptēnós , "vingad". Tennant, som hade fördelen av en mycket större mängd rester, fortsatte sin forskning och identifierade de två tidigare oupptäckta grundämnena i den svarta resten, iridium och osmium. Han erhöll mörkröda kristaller (troligen av Na
2 [IrCl
6 ]· n H
2 O ) genom en sekvens av reaktioner med natriumhydroxid och saltsyra . Han döpte iridium efter Iris ( Ἶρις ), den grekiska bevingade regnbågens gudinna och de olympiska gudarnas budbärare, eftersom många av de salter han fick var starkt färgade. Upptäckten av de nya elementen dokumenterades i ett brev till Royal Society den 21 juni 1804.
Metallbearbetning och applikationer
Den brittiske forskaren John George Children var den första att smälta ett prov av iridium 1813 med hjälp av "det största galvaniska batteriet som någonsin har konstruerats" (vid den tiden). Den första som fick högrent iridium var Robert Hare 1842. Han fann att den hade en densitet på cirka 21,8 g/cm 3 (0,79 lb/cu in) och noterade att metallen är nästan orubblig och mycket hård. Den första smältningen i märkbar mängd gjordes av Henri Sainte-Claire Deville och Jules Henri Debray 1860. De krävde förbränning av mer än 300 liter (79 US gal) ren O
2 och H
2 gas för varje kilogram (2,2 lb) av iridium.
Dessa extrema svårigheter att smälta metallen begränsade möjligheterna att hantera iridium. John Isaac Hawkins var ute efter att få en fin och hård spets för reservoarpennor och lyckades 1834 skapa en iridiumspetsad guldpenna. År 1880 kunde John Holland och William Lofland Dudley smälta iridium genom att tillsätta fosfor och patenterade processen i USA; Det brittiska företaget Johnson Matthey uppgav senare att de hade använt en liknande process sedan 1837 och hade redan presenterat smält iridium på ett antal världsutställningar . Den första användningen av en legering av iridium med rutenium i termoelement gjordes av Otto Feussner 1933. Dessa gjorde det möjligt att mäta höga temperaturer i luft upp till 2 000 °C (3 630 °F).
I München, Tyskland 1957 upptäckte Rudolf Mössbauer , i vad som har kallats ett av "landmärkeexperimenten i 1900-talets fysik", resonans- och rekylfria emissioner och absorption av gammastrålar av atomer i ett fast metallprov innehållande endast 191 Ir. Detta fenomen, känt som Mössbauer-effekten, resulterade i tilldelningen av Nobelpriset i fysik 1961, vid 32 års ålder, bara tre år efter att han publicerade sin upptäckt.
Förekomst
Tillsammans med alla element som har högre atomvikter än järn , bildas iridium endast naturligt av r-processen (snabb neutronfångst) i supernovor och neutronstjärnefusioner .

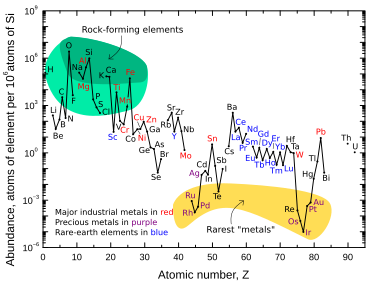
Iridium är ett av de nio minst förekommande stabila elementen i jordskorpan, med en genomsnittlig massfraktion på 0,001 ppm i jordskorpan; platina är 10 gånger rikligare, guld är 40 gånger rikligare och silver och kvicksilver är 80 gånger rikligare. Tellur är ungefär lika rikligt som iridium. I motsats till dess låga förekomst i jordskorpan, är iridium relativt vanligt i meteoriter , med koncentrationer av 0,5 ppm eller mer. Den totala koncentrationen av iridium på jorden tros vara mycket högre än vad som observeras i jordskorpan, men på grund av densiteten och den siderofila ("järnälskande") karaktären hos iridium sjönk det ner under jordskorpan och in i jordens kärna när planeten var fortfarande smält.
Iridium finns i naturen som ett okombinerat grundämne eller i naturliga legeringar ; speciellt iridium-osmium-legeringarna, osmiridium (osmium-rik) och iridosmium (iridium-rik). I nickel- och kopparavlagringarna förekommer metallerna från platinagruppen som sulfider (dvs ( Pt,Pd)S ), tellurider (dvs PtBiTe), antimonider (PdSb) och arsenider (dvs PtAs
2 ). I alla dessa föreningar byts platina ut med en liten mängd iridium och osmium. Som med alla metaller från platinagruppen kan iridium finnas naturligt i legeringar med rå nickel eller rå koppar . Ett antal iridiumdominanta mineral, med iridium som artbildande element, är kända. De är ytterst sällsynta och representerar ofta iridiumanalogerna av de ovan givna. Exemplen är irarsite och cuproiridsite, för att nämna några. Inom jordskorpan finns iridium i högsta koncentrationer i tre typer av geologiska strukturer: magmatiska avlagringar (jordskorpanträngningar underifrån), nedslagskratrar och avlagringar omarbetade från en av de tidigare strukturerna. De största kända primära reserverna finns i Bushvelds magmatiska komplex i Sydafrika (nära den största kända nedslagsstrukturen, Vredefort-nedslagsstrukturen ) genom de stora koppar-nickelavlagringarna nära Norilsk i Ryssland och Sudbury Basin (också en nedslagskrater) i Kanada är också betydande källor till iridium. Mindre reserver finns i USA. Iridium finns också i sekundära avlagringar, i kombination med platina och andra platinagruppmetaller i alluviala avlagringar. De alluvialavlagringar som används av förcolumbianska människor i Chocó-avdelningen i Colombia är fortfarande en källa för metaller från platinagruppen. Från och med 2003 har världsreserverna inte uppskattats.
Marin oceanografi
Iridium finns i marina organismer, sediment och vattenpelaren. Förekomsten av iridium i havsvatten och organismer är relativt låg, eftersom det inte lätt bildar kloridkomplex . Förekomsten av organismer är cirka 20 delar per biljon, eller cirka fem storleksordningar mindre än i sedimentära bergarter vid gränsen mellan Krita och Paleogen (K–T) . Koncentrationen av iridium i havsvatten och marina sediment är känsliga för marin syresättning , havsvattentemperatur och olika geologiska och biologiska processer.
Iridium i sediment kan komma från kosmiskt damm , vulkaner, nederbörd från havsvatten, mikrobiella processer eller hydrotermiska öppningar , och dess överflöd kan starkt tyda på källan. Det tenderar att associeras med andra järnhaltiga metaller i manganknölar . Iridium är ett av de karakteristiska beståndsdelarna i utomjordiska bergarter och kan tillsammans med osmium användas som spårelement för meteoritiskt material i sediment. Till exempel antydde kärnprover från Stilla havet med förhöjda iridiumnivåer Eltanin-effekten för cirka 2,5 miljoner år sedan.
Några av massutdöendena , som kritets utdöende , kan identifieras av anomalt höga koncentrationer av iridium i sediment, och dessa kan kopplas till stora asteroidnedslag .
Gränsnärvaro av krita–paleogen

Gränsen Krita-Paleogene för 66 miljoner år sedan, som markerar den tidsmässiga gränsen mellan Krita- och Paleogenperioderna av geologisk tid , identifierades av ett tunt skikt av iridiumrik lera . Ett team ledd av Luis Alvarez föreslog 1980 ett utomjordiskt ursprung för detta iridium, och tillskrev det till en asteroid- eller kometnedslag . Deras teori, känd som Alvarez-hypotesen , är nu allmänt accepterad för att förklara utrotningen av icke- fågeldinosaurierna . En stor nedgrävd nedslagskraterstruktur med en uppskattad ålder av omkring 66 miljoner år identifierades senare under vad som nu är Yucatánhalvön ( Chicxulub- kratern ) . Dewey M. McLean och andra hävdar att iridium kan ha varit av vulkaniskt ursprung istället, eftersom jordens kärna är rik på iridium, och aktiva vulkaner som Piton de la Fournaise, på ön Réunion , släpper fortfarande iridium.
Produktion
| År |
Förbrukning (ton) |
Pris ( USD ) |
|---|---|---|
| 2001 | 2.6 | 415,25 USD/ ozt (13,351 USD/g) |
| 2002 | 2.5 | 294,62 USD/ ozt (9,472 USD/g) |
| 2003 | 3.3 | 93,02 USD/ ozt (2,991 USD/g) |
| 2004 | 3,60 | 185,33 USD/ ozt (5,958 USD/g) |
| 2005 | 3,86 | 169,51 USD/ ozt (5,450 USD/g) |
| 2006 | 4.08 | 349,45 USD/ ozt (11,235 USD/g) |
| 2007 | 3,70 | 444,43 USD/ ozt (14,289 USD/g) |
| 2008 | 3.10 | 448,34 USD/ ozt (14,414 USD/g) |
| 2009 | 2,52 | 420,4 USD/ ozt (13,52 USD/g) |
| 2010 | 10.40 | 642,15 USD/ ozt (20,646 USD/g) |
| 2011 | 9,36 | 1 035,87 USD/ ozt (33,304 USD/g) |
| 2012 | 5,54 | 1 066,23 USD/ ozt (34,280 USD/g) |
| 2013 | 6.16 | 826,45 USD/ ozt (26,571 USD/g) |
| 2014 | 6.1 | 556,19 USD/ ozt (17,882 USD/g) |
| 2015 | 7,81 | 544 USD/ ozt (17,5 USD/g) |
| 2016 | 7,71 | 586,90 USD/ ozt (18,869 USD/g) |
| 2017 | nd | 908,35 USD/ ozt (29,204 USD/g) |
| 2018 | nd | 1 293,27 USD/ ozt (41 580 USD/g) |
| 2019 | nd | 1 485,80 USD/ ozt (47,770 USD/g) |
| 2020 | nd | 1 633,51 USD/ ozt (52,519 USD/g) |
| 2021 | nd | 5 400,00 USD/ ozt (173,614 USD/g) |
Den globala produktionen av iridium är cirka 7 500 kg (16 500 lb). Priset är högt och varierande (se tabell). Belysande faktorer som påverkar priset är bland annat överutbud av Ir-deglar och förändringar i LED- teknik.
Platinametaller förekommer tillsammans som utspädda malmer. Iridium är en av de mer sällsynta platinametallerna: för varje 190 ton platina som erhålls från malmer, isoleras endast 7,5 ton iridium. För att separera metallerna måste de först bringas i lösning . Två metoder för att göra Ir-innehållande malmer lösliga är (i) sammansmältning av det fasta ämnet med natriumperoxid följt av extraktion av det resulterande glaset i regenvatten och (ii) extraktion av det fasta ämnet med en blandning av klor med saltsyra . Från lösliga extrakt separeras iridium genom att fälla ut fast ammoniumhexakloriridat ( (NH
4 )
2 IrCl
6 ) eller genom att extrahera IrCl
2− 6 med organiska aminer. Den första metoden liknar proceduren som Tennant och Wollaston använde för sin ursprungliga separation. Den andra metoden kan planeras som kontinuerlig vätske-vätskeextraktion och är därför mer lämpad för produktion i industriell skala. I båda fallen reduceras produkten, ett iridiumkloridsalt, med väte, vilket ger metallen som ett pulver eller en svamp , som är mottaglig för pulvermetallurgiska tekniker. Iridium erhålls också kommersiellt som en biprodukt från nickel- och kopparbrytning och bearbetning. Under elektroraffinering av koppar och nickel lägger sig ädelmetaller som silver, guld och platinagruppens metaller samt selen och tellur till botten av cellen som anodslam , vilket utgör utgångspunkten för deras utvinning.
| Land | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Värld | 7,720 | 7 180 | 7 540 | 7 910 | 8 170 |
|
|
6,624 | 6 057 | 6,357 | 6,464 | 6,786 |
|
|
598 | 619 | 586 | 845 | 836 |
|
|
300 | 200 | 400 | 300 | 300 |
|
|
200 | 300 | 200 | 300 | 250 |
Ansökningar
De huvudsakliga användningsområdena för iridium är elektroder för att producera klor och andra aggressiva produkter, OLED :er, deglar, katalysatorer (t.ex. ättiksyra) och tändspetsar för tändstift.
Ir metall och legeringar
Beständighet mot värme och korrosion är grunden för flera användningar av iridium och dess legeringar.
På grund av sin höga smältpunkt, hårdhet och korrosionsbeständighet används iridium för att tillverka deglar. Sådana deglar används i Czochralski-processen för att producera oxidenkristaller (såsom safirer ) för användning i datorminnesenheter och i halvledarlasrar. Kristallerna, såsom gadoliniumgalliumgranat och yttriumgalliumgranat, odlas genom att smälta försintrade laddningar av blandade oxider under oxiderande förhållanden vid temperaturer upp till 2 100 °C (3 810 °F).
Vissa flygplansmotordelar med lång livslängd är gjorda av en iridiumlegering, och en iridium- titaniumlegering används för djupvattenrör på grund av dess korrosionsbeständighet. Iridium används för spinndynor med flera porer , genom vilka en plastpolymersmälta extruderas för att bilda fibrer, såsom rayon . Osmium–iridium används för kompasslager och för balanser.
På grund av deras motståndskraft mot bågeerosion används iridiumlegeringar av vissa tillverkare för elektriska kontakter för tändstift , och iridiumbaserade tändstift används särskilt inom flyget.
Katalys
Iridiumföreningar används som katalysatorer i Cativa-processen för karbonylering av metanol för att producera ättiksyra .
Iridiumkomplex är ofta aktiva för asymmetrisk hydrering både genom traditionell hydrering . och överföringshydrering . Denna egenskap är grunden för den industriella vägen till den kirala herbiciden (S)-metolaklor. Såsom utövas av Syngenta i en skala av 10 000 ton/år, komplexet [[[Ir(COD)Cl] 2 i närvaro av Josiphos-ligander .
Medicinsk avbildning
Radioisotopen iridium-192 är en av de två viktigaste energikällorna för användning i industriell γ-radiografi för oförstörande testning av metaller . Dessutom används 192
Ir som en källa för
gammastrålning för behandling av cancer med brachyterapi , en form av strålbehandling där en förseglad radioaktiv källa placeras inuti eller bredvid det område som kräver behandling. Specifika behandlingar inkluderar prostatabrachyterapi med hög dosfrekvens, brachyterapi av gallvägar och intrakavitär cervixbrachyterapi. Iridium-192 produceras normalt genom neutronaktivering av isotopen iridium-191 i naturligt förekommande iridiummetall.
Fotokatalys och OLED
Iridiumkomplex är nyckelkomponenter i vita OLED:er . Liknande komplex används i fotokatalys .
Vetenskaplig
En legering av 90% platina och 10% iridium användes 1889 för att konstruera den internationella prototypmätaren och kilogram massa, som hölls av International Bureau of Weights and Measures nära Paris . Meterstången ersattes som definitionen av den grundläggande längdenheten 1960 av en linje i kryptons atomspektrum , men kilogramprototypen förblev den internationella standarden för massa fram till den 20 maj 2019, då kilogram omdefinierades i termer av Planck konstant .
Historisk

Iridium-osmiumlegeringar användes i reservoarpennas spetsar . Den första stora användningen av iridium var 1834 i spetsar monterade på guld. Sedan 1944 har den berömda reservoarpennan Parker 51 försetts med en spets spetsad av en rutenium- och iridiumlegering (med 3,8 % iridium). Spetsmaterialet i moderna reservoarpennor kallas fortfarande konventionellt "iridium", även om det sällan finns något iridium i det; andra metaller som rutenium , osmium och volfram har tagit dess plats.
En iridium-platinalegering användes för beröringshålen eller ventilbitarna av kanoner . Enligt en rapport från Parisutställningen 1867 har ett av de föremål som ställs ut av Johnson och Matthey "använts i en Whitworth-pistol i mer än 3000 skott och visar knappt tecken på slitage ännu. De som känner till de ständiga problemen och kostnader som orsakas av bärandet av kanonens ventilationsstycken när de är i aktiv tjänst, kommer att uppskatta denna viktiga anpassning."
Pigmentet iridium black , som består av mycket finfördelat iridium, används för att måla porslin intensivt svart; det sades att "alla andra svarta porslinsfärger verkar gråa vid sidan av det".
Försiktighetsåtgärder
Iridium i bulkmetallisk form är inte biologiskt viktigt eller hälsofarligt på grund av dess bristande reaktivitet med vävnader; det finns bara cirka 20 delar per biljon iridium i mänsklig vävnad. Som de flesta metaller kan finfördelat iridiumpulver vara farligt att hantera, eftersom det är irriterande och kan antändas i luft. År 2015 är mycket lite känt om toxiciteten hos iridiumföreningar, främst för att det används så sällan att få människor kommer i kontakt med det och de som bara gör det med mycket små mängder. Lösliga salter, såsom iridiumhalogenider, kan emellertid vara farliga på grund av andra element än iridium eller på grund av iridium i sig. Samtidigt är de flesta iridiumföreningar olösliga, vilket försvårar upptaget i kroppen.
En radioisotop av iridium, 192
Ir , är farlig, precis som andra radioaktiva isotoper. De enda rapporterade skadorna relaterade till iridium gäller oavsiktlig exponering för strålning från 192
Ir som används i brachyterapi . Högenergisk gammastrålning från 192
Ir kan öka risken för cancer. Extern exponering kan orsaka brännskador, strålningsförgiftning och dödsfall. Förtäring av 192 Ir kan bränna slemhinnan i magen och tarmarna. 192 Ir, 192m Ir och 194m Ir tenderar att avsättas i levern och kan utgöra hälsorisker från både gamma- och betastrålning .
Anteckningar
externa länkar
- Iridium vid The Periodic Table of Videos (University of Nottingham)
- Iridium i Encyclopædia Britannica