Zinkoxid

|
|
| Namn | |
|---|---|
| Andra namn Zinkvit, kalamin, filosofens ull, kinesisk vit, blommor av zink
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.013.839 |
| EG-nummer |
|
| 13738 | |
| KEGG | |
|
PubChem CID
|
|
| RTECS-nummer |
|
| UNII | |
| FN-nummer | 3077 |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| Zn O | |
| Molar massa | 81,406 g/mol |
| Utseende | Vitt fast material |
| Odör | Luktfri |
| Densitet | 5,606 g/cm 3 |
| Smältpunkt | 1 974 °C (3 585 °F; 2 247 K) (sönderdelas) |
| Kokpunkt | 2 360 °C (4 280 °F; 2 630 K) (sönderdelas) |
| 0,0004 % (17,8°C) | |
| Bandgap | 3,3 eV ( direkt ) |
| −27,2·10 −6 cm 3 /mol | |
|
Brytningsindex ( n D )
|
ni = 2,013, n2 = 2,029 |
| Strukturera | |
| Wurtzite | |
| C 6v 4 - P 6 3 mc | |
|
a = 3,2495 Å, c = 5,2069 Å
|
|
|
Formelenheter ( Z )
|
2 |
| Tetraedrisk | |
| Termokemi | |
|
Värmekapacitet ( C )
|
40,3 J·K −1 mol −1 |
|
Std molär entropi ( S ⦵ 298 ) |
43,7±0,4 J·K −1 mol −1 |
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
-350,5±0,3 kJ mol -1 |
|
Gibbs fri energi (Δ f G ⦵ )
|
-320,5 kJ mol -1 |
| Farmakologi | |
| QA07XA91 ( WHO ) | |
| Faror | |
| GHS- märkning : | |

|
|
| Varning | |
| H400 , H401 | |
| P273 , P391 , P501 | |
| NFPA 704 (branddiamant) | |
| Flampunkt | 1 436 °C (2 617 °F; 1 709 K) |
| Dödlig dos eller koncentration (LD, LC): | |
|
LD 50 ( mediandos )
|
240 mg/kg (intraperitoneal, råtta) 7950 mg/kg (råtta, oral) |
|
LC 50 ( mediankoncentration )
|
2500 mg/m 3 (mus) |
|
LC Lo ( lägst publicerad )
|
2500 mg/m 3 (marsvin, 3–4 timmar) |
| NIOSH (USA:s hälsoexponeringsgränser): | |
|
PEL (tillåtet)
|
TWA 5 mg/m 3 (rök) TWA 15 mg/m 3 (totalt damm) TWA 5 mg/m 3 (resp. damm) |
|
REL (rekommenderas)
|
Damm: TWA 5 mg/m 3 C 15 mg/m 3 Rök: TWA 5 mg/m 3 ST 10 mg/m 3 |
|
IDLH (Omedelbar fara)
|
500 mg/m 3 |
| Säkerhetsdatablad (SDS) | ICSC 0208 |
| Besläktade föreningar | |
|
Andra anjoner
|
Zinksulfid Zinkselenid Zinktellurid |
|
Andra katjoner
|
Kadmiumoxid Kvicksilver(II)oxid |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Zinkoxid är en oorganisk förening med formeln Zn O . Det är ett vitt pulver som är olösligt i vatten. ZnO används som tillsats i många material och produkter inklusive kosmetika, kosttillskott, gummi, plast, keramik, glas, cement, smörjmedel, färger, solskyddsmedel, salvor, lim, tätningsmedel, pigment, livsmedel, batterier, ferriter, brandskyddsmedel , halvledare och första hjälpen-band. Även om det förekommer naturligt som mineralet zincit , produceras det mesta av zinkoxid syntetiskt.
Historia
Zinkföreningar användes förmodligen av tidiga människor, i bearbetade och obearbetade former, som färg eller medicinsk salva, men deras sammansättning är osäker. Användningen av pushpanjan , troligen zinkoxid, som salva för ögon och öppna sår, nämns i den indiska medicinska texten Charaka Samhita , som tros vara från 500 f.Kr. eller tidigare. Zinkoxidsalva nämns också av den grekiske läkaren Dioscorides (1:a århundradet e.Kr.). Galen föreslog att man skulle behandla sårbildande cancer med zinkoxid, vilket även Avicenna gjorde i hans The Canon of Medicine . Det används som ingrediens i produkter som babypuder och krämer mot blöjutslag , kalaminkräm , schampon mot mjäll och antiseptiska salvor.
Romarna producerade avsevärda mängder mässing (en legering av zink och koppar ) så tidigt som 200 f.Kr. genom en cementeringsprocess där koppar reagerade med zinkoxid. Zinkoxiden tros ha framställts genom uppvärmning av zinkmalm i en schaktugn. Detta frigjorde metallisk zink som en ånga, som sedan steg upp i rökkanalen och kondenserade som oxiden. Denna process beskrevs av Dioscorides på 1:a århundradet e.Kr. Zinkoxid har också utvunnits från zinkgruvor i Zawar i Indien , med anor från andra hälften av det första årtusendet f.Kr.
Från 1100- till 1500-talet kändes zink och zinkoxid igen och producerades i Indien med en primitiv form av den direkta syntesprocessen. Från Indien flyttade zinktillverkningen till Kina på 1600-talet. År 1743 etablerades det första europeiska zinksmältverket i Bristol , Storbritannien. Runt 1782 föreslog Louis-Bernard Guyton de Morveau att man skulle ersätta blyvitt med zinkoxid.
Den huvudsakliga användningen av zinkoxid (zinkvit) var i färger och som tillsats till salvor. Zinkvitt accepterades som pigment i oljemålningar 1834 men det blandade sig inte bra med olja. Detta problem löstes genom att optimera syntesen av ZnO. 1845 Edme-Jean Leclaire i Paris oljefärgen i stor skala, och 1850 tillverkades zinkvitt i hela Europa. Framgången med zinkvit färg berodde på dess fördelar jämfört med det traditionella vita blyet: zinkvitt är i huvudsak permanent i solljus, det svärtas inte av svavelhaltig luft, det är giftfritt och mer ekonomiskt. Eftersom zinkvitt är så "rent" är det värdefullt för att göra nyanser med andra färger, men det ger en ganska skör torr film när den inte blandas med andra färger. Till exempel, under slutet av 1890-talet och början av 1900-talet, använde vissa konstnärer zinkvitt som grund för sina oljemålningar. Alla dessa målningar utvecklade sprickor under åren.
På senare tid har det mesta zinkoxiden använts i gummiindustrin för att motstå korrosion . På 1970-talet var den näst största tillämpningen av ZnO fotokopiering . Högkvalitativ ZnO producerad genom den "franska processen" lades till fotokopieringspapper som fyllmedel. Denna applikation ersattes snart av titan .
Kemiska egenskaper
Ren ZnO är ett vitt pulver, men i naturen förekommer det som det sällsynta mineralet zincit , som vanligtvis innehåller mangan och andra föroreningar som ger en gul till röd färg.
Kristallin zinkoxid är termokrom , ändras från vit till gul när den värms upp i luft och återgår till vit vid kylning. Denna färgförändring orsakas av en liten förlust av syre till miljön vid höga temperaturer för att bilda den icke-stökiometriska Zn 1+x O, där vid 800 °C, x = 0,00007.
Zinkoxid är en amfoter oxid . Det är nästan olösligt i vatten, men det kommer att lösas upp i de flesta syror , såsom saltsyra :
- ZnO + 2 HCl → ZnCl2 + H2O
Fast zinkoxid kommer också att lösas upp i alkalier för att ge lösliga zinkater:
- ZnO + 2 NaOH + H2O → Na2 [ Zn(OH) 4 ]
ZnO reagerar långsamt med fettsyror i oljor för att producera motsvarande karboxylater , såsom oleat eller stearat . När den blandas med en stark vattenlösning av zinkklorid , bildar ZnO cementliknande produkter som bäst beskrivs som zinkhydroxiklorider. Detta cement användes inom tandvården.
ZnO bildar också cementliknande material när det behandlas med fosforsyra ; relaterade material används inom tandvården. En huvudkomponent i zinkfosfatcement som produceras genom denna reaktion är hopeit , Zn 3 (PO 4 ) 2 · 4H 2 O.
ZnO sönderdelas till zinkånga och syre vid cirka 1975 °C med ett standardsyretryck. I en karbotermisk reaktion omvandlar uppvärmning med kol oxiden till zinkånga vid en mycket lägre temperatur (cirka 950 °C).
- ZnO + C → Zn (ånga) + CO
Fysikaliska egenskaper
Strukturera
Zinkoxid kristalliseras i två huvudformer , hexagonal wurtzite och cubic zincblende . Wurtzitestrukturen är mest stabil vid omgivningsförhållanden och därmed vanligast. Zinkblendeformen kan stabiliseras genom att odla ZnO på substrat med kubisk gitterstruktur. I båda fallen är zink- och oxidcentra tetraedriska , den mest karakteristiska geometrin för Zn(II). ZnO omvandlas till bergsaltmotivet vid relativt höga tryck cirka 10 GPa. De många anmärkningsvärda medicinska egenskaperna hos krämer som innehåller ZnO kan förklaras av dess elastiska mjukhet, som är karakteristisk för tetraedriskt koordinerade binära föreningar nära övergången till oktaedriska strukturer.
Hexagonala och zinkblandade polymorfer har ingen inversionssymmetri (reflektion av en kristall i förhållande till en given punkt omvandlar den inte till sig själv). Denna och andra gittersymmetriegenskaper resulterar i piezoelektricitet för den hexagonala och zinkblandade ZnO, och pyroelektricitet för hexagonal ZnO.
Den hexagonala strukturen har en punktgrupp 6 mm ( Hermann–Mauguin-notation ) eller C 6v ( Schönflies-notation ), och rymdgruppen är P6 3 mc eller C 6v 4 . Gitterkonstanterna är a = 3,25 Å och c = 5,2 Å; deras förhållande c/a ~ 1,60 är nära det ideala värdet för hexagonal cell c/a = 1,633. Som i de flesta grupp II-VI- material är bindningen i ZnO till stor del jonisk (Zn 2+ O 2− ) med motsvarande radier på 0,074 nm för Zn 2+ och 0,140 nm för O 2− . Denna egenskap står för den föredragna bildningen av wurtzite snarare än zinkblandningsstrukturen, såväl som den starka piezoelektriciteten hos ZnO. På grund av de polära Zn−O-bindningarna är zink- och syreplan elektriskt laddade. För att upprätthålla elektrisk neutralitet rekonstruerar dessa plan på atomnivå i de flesta relativa material, men inte i ZnO - dess ytor är atomärt plana, stabila och uppvisar ingen rekonstruktion. Studier som använder wurtzoidstrukturer förklarade emellertid ursprunget till ytplanhet och frånvaron av rekonstruktion vid ZnO wurtzite-ytor förutom ursprunget för laddningar på ZnO-plan.
Mekaniska egenskaper
ZnO är en bredbandig gap-halvledare i II-VI-halvledargruppen . Den naturliga dopningen av halvledaren på grund av syrevakanser eller zinkmellanrum är n-typ.
ZnO är ett relativt mjukt material med en ungefärlig hårdhet på 4,5 på Mohs-skalan . Dess elastiska konstanter är mindre än de för relevanta III-V-halvledare, såsom GaN . Den höga värmekapaciteten och värmeledningsförmågan, låga termiska expansionen och höga smälttemperaturen hos ZnO är fördelaktiga för keramik. Den optiska E2- fononen i ZnO uppvisar en ovanligt lång livslängd på 133 ps vid 10 K.
Bland de tetraedriskt bundna halvledarna har det angetts att ZnO har den högsta piezoelektriska tensorn, eller åtminstone en jämförbar med den för GaN och AlN . Denna egenskap gör det till ett tekniskt viktigt material för många piezoelektriska applikationer, som kräver en stor elektromekanisk koppling. Därför har ZnO i form av tunnfilm varit ett av de mest studerade resonatormaterialen för tunnfilmsbulk akustiska resonatorer .
Elektriska och optiska egenskaper
Gynnsamma egenskaper hos zinkoxid inkluderar god transparens, hög elektronrörlighet , brett bandgap och stark luminescens vid rumstemperatur . Dessa egenskaper gör ZnO värdefull för en mängd nya tillämpningar: transparenta elektroder i LCD-skärmar , energibesparande eller värmeskyddande fönster och elektronik som tunnfilmstransistorer och lysdioder .
ZnO har ett relativt brett direkt bandgap på ~3,3 eV vid rumstemperatur. Fördelar förknippade med ett brett bandgap inkluderar högre genombrottsspänningar , förmåga att upprätthålla stora elektriska fält, lägre elektroniskt brus och drift med hög temperatur och hög effekt. Bandgapet för ZnO kan ytterligare ställas in till ~3–4 eV genom att det legeras med magnesiumoxid eller kadmiumoxid .
De flesta ZnO har karaktär av n -typ , även i frånvaro av avsiktlig dopning . Icke-stökiometri är vanligtvis ursprunget till n-typ karaktär, men ämnet förblir kontroversiellt. En alternativ förklaring har föreslagits, baserad på teoretiska beräkningar, att oavsiktliga substitutionella väteföroreningar är ansvariga. Kontrollerbar dopning av n-typ uppnås lätt genom att ersätta Zn med grupp-III-element såsom Al, Ga, In eller genom att ersätta syre med grupp-VII-element klor eller jod .
Tillförlitlig dopning av p-typ av ZnO är fortfarande svårt. Detta problem härrör från låg löslighet av p-typ dopämnen och deras kompensation genom rikliga n-typ föroreningar. Detta problem observeras med GaN och ZnSe . Mätning av p-typ i "inneboende" material av n-typ kompliceras av provernas inhomogenitet.
Nuvarande begränsningar för p-dopning begränsar elektroniska och optoelektroniska tillämpningar av ZnO, som vanligtvis kräver korsningar av n-typ och p-typ material. Kända dopmedel av p-typ inkluderar grupp-I-element Li, Na, K; grupp-V-element N, P och As; samt koppar och silver. Många av dessa bildar emellertid djupa acceptorer och producerar inte signifikant ledning av p-typ vid rumstemperatur.
Elektronrörligheten för ZnO varierar kraftigt med temperaturen och har ett maximum på ~2000 cm 2 /(V·s) vid 80 K. Data om hålrörlighet är knapphändig med värden i intervallet 5–30 cm 2 / (V·s).
ZnO-skivor, som fungerar som en varistor , är det aktiva materialet i de flesta överspänningsavledare .
Zinkoxid är känt för sina starkt olinjära optiska egenskaper, särskilt i bulk. Olinjäriteten hos ZnO nanopartiklar kan finjusteras efter deras storlek.
Produktion
För industriellt bruk produceras ZnO i nivåer av 10 5 ton per år genom tre huvudprocesser:
Indirekt process
I den indirekta eller franska processen smälts metalliskt zink i en grafitdegel och förångas vid temperaturer över 907 °C (vanligtvis runt 1000 °C). Zinkånga reagerar med syret i luften för att ge ZnO, åtföljt av en sänkning av dess temperatur och ljusa luminescens. Zinkoxidpartiklar transporteras in i en kylkanal och samlas upp i ett påshus. Denna indirekta metod populariserades av Edme Jean LeClaire från Paris 1844 och är därför allmänt känd som den franska processen. Dess produkt består normalt av agglomererade zinkoxidpartiklar med en medelstorlek på 0,1 till några mikrometer. I vikt tillverkas det mesta av världens zinkoxid via fransk process.
Direkt process
Den direkta eller amerikanska processen börjar med olika förorenade zinkkompositer, såsom zinkmalmer eller biprodukter från smältverket. Zinkprekursorerna reduceras ( karbotermisk reduktion ) genom uppvärmning med en kolkälla såsom antracit för att producera zinkånga, som sedan oxideras som i den indirekta processen. På grund av den lägre renheten hos källmaterialet är slutprodukten också av lägre kvalitet i den direkta processen jämfört med den indirekta.
Våt kemisk process
En liten mängd industriell produktion involverar våtkemiska processer, som börjar med vattenlösningar av zinksalter, från vilka zinkkarbonat eller zinkhydroxid fälls ut. Den fasta fällningen kalcineras sedan vid temperaturer runt 800 °C.
Laboratoriesyntes
Det finns många specialiserade metoder för att producera ZnO för vetenskapliga studier och nischapplikationer. Dessa metoder kan klassificeras efter den resulterande ZnO-formen (bulk, tunnfilm, nanotråd ), temperatur ("låg", som är nära rumstemperatur eller "hög", det vill säga T ~ 1000 °C), processtyp (ångavsättning eller tillväxt från lösning) och andra parametrar.
Stora enkristaller (många kubikcentimeter) kan odlas genom gastransport (ångfasavsättning), hydrotermisk syntes eller smälttillväxt. Men på grund av det höga ångtrycket hos ZnO är tillväxt från smältan problematisk. Tillväxt genom gastransport är svår att kontrollera, vilket lämnar den hydrotermiska metoden som en preferens. Tunna filmer kan framställas genom kemisk ångavsättning , metallorganisk ångfasepitaxi , elektroavsättning , pulsad laseravsättning , sputtering , sol- gelsyntes, atomskiktsavsättning , spraypyrolys, etc.
Vanlig vit pulveriserad zinkoxid kan framställas i laboratoriet genom att elektrolysera en lösning av natriumbikarbonat med en zinkanod. Zinkhydroxid och vätgas produceras. Zinkhydroxiden sönderdelas vid uppvärmning till zinkoxid:
- Zn + 2 H 2 O → Zn(OH) 2 + H 2
- Zn(OH) 2 → ZnO + H 2 O
ZnO nanostrukturer
Nanostrukturer av ZnO kan syntetiseras till en mängd olika morfologier inklusive nanotrådar, nanorods , tetrapods, nanobelts, nanoflowers, nanopartiklar etc. Nanostrukturer kan erhållas med de flesta ovan nämnda tekniker, under vissa förhållanden, och även med ånga–vätska– fast-metoden . Syntesen utförs typiskt vid temperaturer på cirka 90 °C, i en ekvimolär vattenlösning av zinknitrat och hexamin , varvid den senare tillhandahåller den grundläggande miljön. Vissa tillsatser, såsom polyetylenglykol eller polyetylenimin, kan förbättra bildförhållandet för ZnO nanotrådarna. Doping av ZnO nanotrådarna har uppnåtts genom att tillsätta andra metallnitrater till tillväxtlösningen. Morfologin hos de resulterande nanostrukturerna kan ställas in genom att ändra parametrarna relaterade till prekursorsammansättningen (såsom zinkkoncentrationen och pH) eller till den termiska behandlingen (såsom temperatur och uppvärmningshastighet).
Riktade ZnO nanotrådar på försådda kisel- , glas- och galliumnitridsubstrat har odlats med hjälp av vattenhaltiga zinksalter som zinknitrat och zinkacetat i grundläggande miljöer. Försådd substrat med ZnO skapar platser för homogen kärnbildning av ZnO-kristall under syntesen. Vanliga försåddsmetoder inkluderar in-situ termisk nedbrytning av zinkacetatkristalliter , spincoating av ZnO-nanopartiklar och användningen av fysiska ångavsättningsmetoder för att deponera ZnO-tunna filmer. Försådd kan utföras i samband med top-down mönstringsmetoder såsom elektronstrålelitografi och nanosfärlitografi för att ange kärnbildningsställen före tillväxt. Justerade ZnO nanotrådar kan användas i färgsensibiliserade solceller och fältemissionsenheter.
Ansökningar
Tillämpningarna av zinkoxidpulver är många, och de viktigaste sammanfattas nedan. De flesta tillämpningar utnyttjar oxidens reaktivitet som en prekursor till andra zinkföreningar. För materialvetenskapliga tillämpningar har zinkoxid högt brytningsindex , hög värmeledningsförmåga, bindande, antibakteriella och UV-skyddande egenskaper. Följaktligen tillsätts det i material och produkter inklusive plast, keramik, glas, cement, gummi, smörjmedel, färger, salvor, lim, tätningsmedel, betongtillverkning, pigment, livsmedel, batterier, ferriter, brandskyddsmedel , etc.
Gummiindustrin
Mellan 50 % och 60 % av ZnO-användningen sker inom gummiindustrin. Zinkoxid tillsammans med stearinsyra används vid svavelvulkanisering av gummi. ZnO-tillsatser skyddar även gummi från svamp (se medicinska tillämpningar) och UV-ljus.
Keramisk industri
Keramisk industri förbrukar en betydande mängd zinkoxid, särskilt i keramiska glasyr- och frittakompositioner. Den relativt höga värmekapaciteten, värmeledningsförmågan och höga temperaturstabiliteten hos ZnO i kombination med en jämförelsevis låg expansionskoefficient är önskvärda egenskaper vid framställning av keramik. ZnO påverkar smältpunkten och optiska egenskaper hos glasyrer, emaljer och keramiska formuleringar. Zinkoxid som en låg expansion, sekundärt flussmedel förbättrar elasticiteten hos glasyrer genom att minska förändringen i viskositet som en funktion av temperaturen och hjälper till att förhindra krackelering och skakning. Genom att ersätta BaO och PbO med ZnO minskas värmekapaciteten och värmeledningsförmågan ökas. Zink i små mängder förbättrar utvecklingen av glansiga och briljanta ytor. Men i måttliga till höga mängder producerar den matta och kristallina ytor. När det gäller färg har zink ett komplicerat inflytande.
Medicin
Zinkoxid som en blandning med ca 0,5 % järn(III)oxid (Fe 2 O 3 ) kallas kalamin och används i kalaminlotion. Historiskt sett kalamin en blandning av mineralformerna av dessa oxider, zincit och hemimorfit . När den blandas med eugenol , bildas zinkoxid eugenol , som har tillämpningar som ett reparativ och proteser inom tandvården .
Pulveriserad zinkoxid har deodoriserande och antibakteriella egenskaper. ZnO tillsätts i bomullstyg, gummi, munvårdsprodukter och livsmedelsförpackningar. Förbättrad antibakteriell verkan av fina partiklar jämfört med bulkmaterial är inte exklusivt för ZnO och observeras för andra material, såsom silver . Denna egenskap är resultatet av den ökade ytarean hos de fina partiklarna.
Zinkoxid används i munvattenprodukter och tandkrämer som ett antibakteriellt medel som föreslagits för att förhindra bildning av plack och tandsten , och för att kontrollera dålig andedräkt genom att minska de flyktiga gaserna och flyktiga svavelföreningarna (VSC) i munnen. Tillsammans med zinkoxid eller zinksalter innehåller dessa produkter vanligtvis andra aktiva ingredienser , såsom cetylpyridiniumklorid , xylitol , hinokitiol , eteriska oljor och växtextrakt .
Zinkoxid används ofta för att behandla en mängd olika hudåkommor, inklusive atopisk dermatit , kontakteksem , klåda på grund av eksem , blöjutslag och akne . Det används i produkter som babypuder och barriärkrämer för att behandla blöjutslag , kalaminkräm , antimjällschampon och antiseptiska salvor . Den kombineras ofta med ricinolja för att bilda en mjukgörande och sammandragande , zink- och ricinoljekräm, som vanligtvis används för att behandla spädbarn.
Det är också en komponent i tejp (kallad "zinkoxidtejp") som används av idrottare som ett bandage för att förhindra mjukvävnadsskador under träningspass. Zinkoxid tillsätts också ofta i solskyddsmedel .
Zinkoxid kan användas i salvor, krämer och lotioner för att skydda mot solbränna och andra skador på huden som orsakas av ultraviolett ljus (se solskyddsmedel ). Det är det bredaste spektrum av UVA- och UVB-absorbenter som är godkänd för användning som solskyddsmedel av US Food and Drug Administration (FDA), och är helt fotostabil. När den används som ingrediens i solskyddsmedel blockerar zinkoxid både UVA (320–400 nm) och UVB (280–320 nm) strålar av ultraviolett ljus . Zinkoxid och det andra vanligaste fysiska solskyddet, titandioxid , anses vara icke-irriterande, icke-allergiframkallande och icke- komdogena . Zink från zinkoxid absorberas dock något i huden.
Många solskyddsmedel använder nanopartiklar av zinkoxid (tillsammans med nanopartiklar av titandioxid) eftersom sådana små partiklar inte sprider ljus och därför inte ser vita ut. Nanopartiklarna absorberas inte i huden mer än zinkoxidpartiklar av vanlig storlek och absorberas endast i yttersta lager men inte i kroppen.
Livsmedelstillsats
Zinkoxid tillsätts i många livsmedelsprodukter, inklusive frukostflingor , som en källa till zink, ett nödvändigt näringsämne . ( Zinksulfat används också för samma ändamål.) Vissa färdigförpackade livsmedel innehåller även spårmängder av ZnO även om det inte är avsett som ett näringsämne.
Pigment
Zinkoxid (zinkvit) används som pigment i färger och är mer ogenomskinlig än litopon , men mindre ogenomskinlig än titandioxid . Det används också i beläggningar för papper. Kinesisk vit är en speciell sort av zinkvit som används i konstnärspigment . Användningen av zinkvitt som pigment i oljemålning började i mitten av 1700-talet. Den har delvis ersatt det giftiga blyvita och användes av målare som Böcklin , Van Gogh , Manet , Munch m.fl. Det är också en huvudingrediens i mineralsmink (CI 77947).
UV-absorbent
Mikroniserad och nanoskalig zinkoxid ger ett starkt skydd mot UVA och UVB ultraviolett strålning och används följaktligen i solskyddsmedel och även i UV-blockerande solglasögon för användning i rymden och för skydd vid svetsning , efter forskning av forskare vid Jet Propulsion Laboratory ( JPL ).
Beläggningar
Färger som innehåller zinkoxidpulver har länge använts som antikorrosiva beläggningar för metaller. De är särskilt effektiva för galvaniserat järn. Järn är svårt att skydda eftersom dess reaktivitet med organiska beläggningar leder till sprödhet och bristande vidhäftning. Zinkoxidfärger behåller sin flexibilitet och vidhäftning på sådana ytor under många år.
ZnO mycket n-typ dopad med aluminium , gallium eller indium är transparent och ledande ( transparens ~90%, lägsta resistivitet ~10 −4 Ω·cm). ZnO:Al-beläggningar används för energibesparande eller värmeskyddande fönster. Beläggningen släpper in den synliga delen av spektrumet men reflekterar antingen den infraröda (IR) strålningen tillbaka in i rummet (energibesparing) eller släpper inte in IR-strålningen i rummet (värmeskydd), beroende på vilken sida av fönstret har beläggningen.
Plast, såsom polyetylennaftalat (PEN), kan skyddas genom att applicera zinkoxidbeläggning. Beläggningen minskar diffusionen av syre genom PEN. Zinkoxidskikt kan också användas på polykarbonat i utomhusapplikationer. Beläggningen skyddar polykarbonat från solstrålning och minskar dess oxidationshastighet och fotogulning.
Korrosionsskydd i kärnreaktorer
Zinkoxid utarmad i 64 Zn ( zinkisotopen med atommassa 64) används för att förhindra korrosion i kärnkraftsreaktorer med tryckvatten . Utarmningen är nödvändig, eftersom 64 Zn omvandlas till radioaktivt 65 Zn under bestrålning av reaktorns neutroner.
Metanreformering
Zinkoxid (ZnO) används som ett förbehandlingssteg för att avlägsna vätesulfid (H 2 S) från naturgas efter hydrering av eventuella svavelföreningar före en metanreformer , som kan förgifta katalysatorn. Vid temperaturer mellan cirka 230–430 °C (446–806 °F) omvandlas H 2 S till vatten genom följande reaktion:
- H2S + ZnO → H2O + ZnS
Elektronik
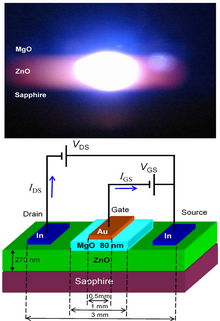

ZnO har brett direktbandgap (3,37 eV eller 375 nm vid rumstemperatur). Därför är dess vanligaste potentiella tillämpningar i laserdioder och lysdioder ( LED). Dessutom har ultrasnabba olinjäriteter och fotokonduktiva funktioner rapporterats i ZnO. Vissa optoelektroniska tillämpningar av ZnO överlappar den för GaN , som har ett liknande bandgap (~3,4 eV vid rumstemperatur). Jämfört med GaN har ZnO en större excitonbindningsenergi (~60 meV, 2,4 gånger den termiska energin vid rumstemperatur), vilket resulterar i ljusa rumstemperaturemissioner från ZnO. ZnO kan kombineras med GaN för LED-applikationer. Till exempel ger ett transparent ledande oxidskikt och ZnO nanostrukturer bättre ljusutkoppling. Andra egenskaper hos ZnO som är gynnsamma för elektroniska tillämpningar inkluderar dess stabilitet mot högenergistrålning och dess förmåga att mönstras genom våtkemisk etsning. Strålningsmotstånd gör ZnO till en lämplig kandidat för rymdtillämpningar. ZnO är den mest lovande kandidaten inom området för slumpmässiga lasrar för att producera en elektroniskt pumpad UV-laserkälla.
De spetsiga spetsarna på ZnO nanorods resulterar i en stark förbättring av ett elektriskt fält. Därför kan de användas som fältsändare .
Aluminiumdopade ZnO-skikt används som transparenta elektroder . Komponenterna Zn och Al är mycket billigare och mindre giftiga jämfört med den allmänt använda indiumtennoxiden ( ITO). En tillämpning som har börjat bli kommersiellt tillgänglig är användningen av ZnO som frontkontakt för solceller eller flytande kristallskärmar .
Genomskinliga tunnfilmstransistorer (TTFT) kan tillverkas med ZnO . Som fälteffekttransistorer behöver de inte en ap–n-övergång, vilket undviker dopningsproblemet av p-typ av ZnO. Vissa av fälteffekttransistorerna använder till och med ZnO nanorods som ledande kanaler.
Zinkoxid nanorodsensor
Zinkoxid nanorodsensorer är enheter som upptäcker förändringar i elektrisk ström som passerar genom zinkoxidnanotrådar på grund av adsorption av gasmolekyler . Selektivitet för vätgas uppnåddes genom att sputtera palladiumkluster på nanorodytan. Tillsatsen av palladium verkar vara effektiv i den katalytiska dissocieringen av vätemolekyler till atomärt väte, vilket ökar sensoranordningens känslighet. Sensorn detekterar vätekoncentrationer ner till 10 ppm vid rumstemperatur, medan det inte finns något svar på syre. ZnO har använts som immobiliseringsskikt i immunosensorer som möjliggör fördelning av antikroppar över hela regionen undersökt av det elektriska mätfältet som appliceras på mikroelektroderna.
Piezoelektricitet
Piezoelektriciteten i textilfibrer belagda med ZnO har visat sig kunna tillverka "självdrivna nanosystem" med vardaglig mekanisk påfrestning från vind eller kroppsrörelser .
År 2008 rapporterade Center for Nanostructure Characterization vid Georgia Institute of Technology att de producerade en elgenererande enhet (kallad flexibel laddningspumpgenerator) som levererar växelström genom att sträcka ut och släppa ut zinkoxidnanotrådar. Denna minigenerator skapar en oscillerande spänning upp till 45 millivolt och omvandlar nära sju procent av den tillförda mekaniska energin till elektricitet. Forskare använde ledningar med längder på 0,2–0,3 mm och diametrar på tre till fem mikrometer, men enheten kunde skalas ner till mindre storlek.
I form av en tunnfilm har ZnO demonstrerats i miniatyriserade högfrekventa tunnfilmsresonatorer, sensorer och filter.
Li-ion batteri och superkondensatorer
ZnO är ett lovande anodmaterial för litiumjonbatterier eftersom det är billigt, biokompatibelt och miljövänligt. ZnO har en högre teoretisk kapacitet (978 mAh g −1 ) än många andra övergångsmetalloxider som CoO (715 mAh g −1 ), NiO (718 mAh g −1 ) och CuO (674 mAh g −1 ). ZnO används också som elektrod i superkondensatorer.
Säkerhet
Som en livsmedelstillsats finns zinkoxid på amerikanska FDA:s lista över allmänt erkända som säkra eller GRAS-ämnen.
Zinkoxid i sig är ogiftig; Det är dock farligt att andas in zinkoxidångor, som till exempel genereras när zink eller zinklegeringar smälts och oxideras vid hög temperatur. Detta problem uppstår vid smältning av legeringar som innehåller mässing eftersom smältpunkten för mässing är nära kokpunkten för zink. Exponering för zinkoxid i luften, vilket också uppstår vid svetsning av galvaniserat (förzinkat) stål , kan resultera i en sjukdom som kallas metallröksfeber . Av denna anledning svetsas vanligtvis inte galvaniserat stål, eller så avlägsnas zinken först. [ tveksamt ]
I solskyddsmedel, formuleringar som kombinerade zinkoxid med andra petrokemiska UV-absorbenter, visade det sig att zinkoxid orsakade fotonedbrytning av småmolekylära petrokemiska UV-absorbenter, som uppvisade toxicitet i embryonala zebrafiskanalyser.
Se även
Anförda källor
- Haynes WM, red. (2011). CRC Handbook of Chemistry and Physics (92:a upplagan). CRC Tryck på . ISBN 978-1439855119 .
Recensioner
- Özgür Ü, Alivov YI, Liu C, Teke A, Reshchikov M, Doğan S, et al. (2005). "En omfattande genomgång av ZnO-material och -enheter" . Journal of Applied Physics . 98 (4): 041301–041301–103. Bibcode : 2005JAP....98d1301O . doi : 10.1063/1.1992666 .
- Bakin A, Waag A (29 mars 2011). "ZnO epitaxiell tillväxt". I Bhattacharya P, Fornari R, Kamimura H (red.). Omfattande halvledarvetenskap och teknik 6 volymuppslagsverk . Elsevier. ISBN 978-0-444-53143-8 .
- Baruah S, Dutta J (februari 2009). "Hydrotermisk tillväxt av ZnO nanostrukturer" . Vetenskap och teknik för avancerade material . 10 (1): 013001. Bibcode : 2009STAdM..10a3001B . doi : 10.1088/1468-6996/10/1/013001 . PMC 5109597 . PMID 27877250 .
- Janisch R (2005). "Övergångsmetalldopad TiO 2 och ZnO - aktuell status för fältet". Journal of Physics: Condensed Matter . 17 (27): R657–R689. Bibcode : 2005JPCM...17R.657J . doi : 10.1088/0953-8984/17/27/R01 . S2CID 118610509 .
- Heo YW (2004). "ZnO nanotrådstillväxt och enheter". Materialvetenskap och teknik: R: Rapporter . 47 (1–2): 1–47. doi : 10.1016/j.mser.2004.09.001 .
- Klingshirn C (2007). "ZnO: Från grunderna till applikationer". Physica Status Solidi B . 244 (9): 3027–3073. Bibcode : 2007PSSBR.244.3027K . doi : 10.1002/pssb.200743072 . S2CID 97461963 .
- Klingshirn C (april 2007). "ZnO: material, fysik och tillämpningar" . ChemPhysChem . 8 (6): 782–803. doi : 10.1002/cphc.200700002 . PMID 17429819 .
- Lu JG, Chang P, Fan Z (2006). "Kvasi-endimensionella metalloxidmaterial—Syntes, egenskaper och tillämpningar". Materialvetenskap och teknik: R: Rapporter . 52 (1–3): 49–91. CiteSeerX 10.1.1.125.7559 . doi : 10.1016/j.mser.2006.04.002 .
- Xu S, Wang ZL (2011). "Endimensionella ZnO nanostrukturer: Lösningstillväxt och funktionella egenskaper". Nanoforskning . 4 (11): 1013–1098. CiteSeerX 10.1.1.654.3359 . doi : 10.1007/s12274-011-0160-7 . S2CID 137014543 .
- Xu S, Wang ZL (2011). "Oxid nanotrådarrayer för lysdioder och piezoelektriska energiskördare". Ren och tillämpad kemi . 83 (12): 2171–2198. doi : 10.1351/PAC-CON-11-08-17 . S2CID 18770461 .
externa länkar
- Zincitegenskaper
- Internationellt kemikaliesäkerhetskort 0208 .
- NIOSH Pocket Guide to Chemical Hazards .
- Zinkoxid i Pesticide Properties DataBase (PPDB)
- Zinkvitt pigment hos ColourLex





