Metan

|
|||
|
|
|||
| Namn | |||
|---|---|---|---|
|
Föredraget IUPAC-namn
Metan |
|||
|
Systematiskt IUPAC-namn
Carbane (rekommenderas aldrig) |
|||
Andra namn
|
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| 3DMet | |||
| 1718732 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.739 | ||
| EG-nummer |
|
||
| 59 | |||
| KEGG | |||
| Maska | Metan | ||
|
PubChem CID
|
|||
| RTECS-nummer |
|
||
| UNII | |||
| FN-nummer | 1971 | ||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| CH 4 _ | |||
| Molar massa | 16,043 g·mol -1 | ||
| Utseende | Färglös gas | ||
| Odör | Luktfri | ||
| Densitet |
|
||
| Smältpunkt | −182,456 °C (−296,421 °F; 90,694 K) | ||
| Kokpunkt | −161,5 °C (−258,7 °F; 111,6 K) | ||
| Kritisk punkt ( T , P ) | 190,56 K (−82,59 °C; −116,66 °F), 4,5992 megapascal (45,391 atm) | ||
| 22,7 mg·L -1 | |||
| Löslighet | Löslig i etanol , dietyleter , bensen , toluen , metanol , aceton och olöslig i vatten | ||
| log P | 1,09 | ||
|
Henrys lagkonstant ( k H ) |
14 nmol·Pa -1 ·kg -1 | ||
| Konjugerad syra | Metanium | ||
| Konjugerad bas | Metylanjon | ||
| −17,4 × 10 −6 cm 3 ·mol −1 | |||
| Strukturera | |||
| T d | |||
| Tetraeder | |||
| 0 D | |||
| Termokemi | |||
|
Värmekapacitet ( C )
|
35,7 J·(K·mol) -1 | ||
|
Std molär entropi ( S ⦵ 298 ) |
186,3 J-(K-mol) -1 | ||
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
-74,6 kJ·mol -1 | ||
|
Gibbs fri energi (Δ f G ⦵ )
|
-50,5 kJ·mol -1 | ||
|
Standardentalpi för förbränning (Δ c H ⦵ 298 ) |
-891 kJ·mol -1 | ||
| Faror | |||
| GHS- märkning : | |||

|
|||
| Fara | |||
| H220 | |||
| P210 | |||
| NFPA 704 (branddiamant) | |||
| Flampunkt | −188 °C (−306,4 °F; 85,1 K) | ||
| 537 °C (999 °F; 810 K) | |||
| Explosiva gränser | 4,4–17 % | ||
|
Besläktade alkaner
|
|||
| Kompletterande datasida | |||
| Metan (datasida) | |||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Metan ( USA : / ˈ m ɛ θ eɪ n / MEH -thayn , Storbritannien : / ˈ m iː θ eɪ n / MEE -thayn ) är en kemisk förening med den kemiska formeln CH 4 ( en kolatom bunden till fyra väteatomer ) . Det är en grupp-14-hydrid , den enklaste alkanen och huvudbeståndsdelen i naturgas . Den relativa mängden metan på jorden gör det till ett ekonomiskt attraktivt bränsle , även om infångning och lagring av det innebär tekniska utmaningar på grund av dess gasformiga tillstånd under normala förhållanden för temperatur och tryck .
Naturligt förekommande metan finns både under jord och under havsbotten och bildas av både geologiska och biologiska processer. Den största reservoaren av metan finns under havsbotten i form av metanklatrater . När metan når ytan och atmosfären kallas det atmosfärisk metan . Jordens metankoncentration i atmosfären har ökat med cirka 150 % sedan 1750, och den står för 20 % av den totala strålningskraften från alla långlivade och globalt blandade växthusgaser . Det har också upptäckts på andra planeter, inklusive Mars , vilket har konsekvenser för astrobiologiforskning .
Egenskaper och bindning
Metan är en tetraedrisk molekyl med fyra ekvivalenta C–H-bindningar . Dess elektroniska struktur beskrivs av fyra bindande molekylära orbitaler (MOs) som är ett resultat av överlappningen av valensorbitaler på C och H . MO med lägst energi är resultatet av överlappningen av 2s-orbitalen på kol med kombinationen i fas av 1s-orbitalen på de fyra väteatomerna. Ovanför denna energinivå finns en trefaldigt degenererad uppsättning av MO som involverar överlappning av 2p-orbitaler på kol med olika linjära kombinationer av 1s-orbitaler på väte. Det resulterande "tre-över-ett"-bindningsschemat överensstämmer med fotoelektronspektroskopiska mätningar.
Metan är en luktfri gas och verkar vara färglös. Den absorberar synligt ljus speciellt i den röda änden av spektrumet på grund av övertonsband , men effekten är bara märkbar om ljusvägen är mycket lång. Det är detta som ger Uranus och Neptunus deras blå eller blågröna färger, när ljus passerar genom deras atmosfärer som innehåller metan och sedan sprids ut igen.
Den välbekanta lukten av naturgas som används i hemmen uppnås genom tillsats av ett luktämne , vanligtvis blandningar som innehåller tert-butyltiol , som en säkerhetsåtgärd. Metan har en kokpunkt på -161,5 °C vid ett tryck av en atmosfär . Som gas är den brandfarlig över ett intervall av koncentrationer (5,4–17%) i luft vid standardtryck .
Fast metan finns i flera modifieringar . För närvarande är nio kända. Kylning av metan vid normalt tryck resulterar i bildning av metan I. Detta ämne kristalliseras i det kubiska systemet ( rymdgrupp Fm 3 m). Väteatomernas positioner är inte fixerade i metan I, dvs metanmolekyler kan rotera fritt. Därför är det en plastkristall .
Kemiska reaktioner
De primära kemiska reaktionerna av metan är förbränning , ångreformering till syngas och halogenering . I allmänhet är metanreaktioner svåra att kontrollera.
Selektiv oxidation
Partiell oxidation av metan till metanol , ett bekvämare flytande bränsle, är utmanande eftersom reaktionen vanligtvis fortskrider hela vägen till koldioxid och vatten även med otillräcklig tillförsel av syre . Enzymet metanmonooxygenas producerar metanol från metan , men kan inte användas för reaktioner i industriell skala. Vissa homogent katalyserade system och heterogena system har utvecklats, men alla har betydande nackdelar. Dessa fungerar i allmänhet genom att generera skyddade produkter som är skyddade från överoxidation. Exempel inkluderar Catalytica-systemet , kopparzeoliter och järnzeoliter som stabiliserar det alfa-syreaktiva stället .
En grupp bakterier katalyserar metanoxidation med nitrit som oxidant i frånvaro av syre , vilket ger upphov till den så kallade anaeroba oxidationen av metan .
Syra-bas-reaktioner
Liksom andra kolväten är metan en extremt svag syra . Dess pKa i DMSO uppskattas vara 56. Det kan inte deprotoneras i lösning, men konjugatbasen är känd i former som metyllitium .
En mängd positiva joner som härrör från metan har observerats, mestadels som instabila arter i lågtrycksgasblandningar. Dessa inkluderar metenium eller metylkatjon CH
+ 3 , metankatjon CH
+ 4 och metan eller protonerad metan CH
+ 5 . Några av dessa har upptäckts i yttre rymden . Metan kan även framställas som utspädda lösningar av metan med supersyror . Katjoner med högre laddning, såsom CH
2+ 6 och CH
3+ 7 , har studerats teoretiskt och antas vara stabila.
Trots styrkan hos dess C–H-bindningar finns det ett intensivt intresse för katalysatorer som underlättar aktivering av C–H-bindningar i metan (och andra lägre numrerade alkaner ).
Förbränning
Metans förbränningsvärme är 55,5 MJ/kg. Förbränning av metan är en reaktion i flera steg som sammanfattas enligt följande:
Peters fyrstegskemi är en systematiskt reducerad fyrstegskemi som förklarar förbränningen av metan.
Metan radikala reaktioner
Givet lämpliga förhållanden reagerar metan med halogenradikaler enligt följande :
där X är en halogen : fluor (F), klor (Cl), brom (Br) eller jod (I). Denna mekanism för denna process kallas halogenering av fria radikaler . Det initieras när UV-ljus eller någon annan radikalinitiator (som peroxider ) producerar en halogenatom . En kedjereaktion i två steg uppstår där halogenatomen abstraherar en väteatom från en metanmolekyl, vilket resulterar i bildandet av en vätehalogenidmolekyl och en metylradikal ( CH 3 • ). Metylradikalen reagerar sedan med en molekyl av halogenen för att bilda en molekyl av halogenetan, med en ny halogenatom som biprodukt. Liknande reaktioner kan inträffa på den halogenerade produkten, vilket leder till att ytterligare väteatomer ersätts med halogenatomer med dihalometan- , trihalometan- och slutligen tetrahalometanstrukturer , beroende på reaktionsförhållandena och halogen-till-metan-förhållandet.
Används
Metan används i industriella kemiska processer och kan transporteras som en kyld vätska (flytande naturgas eller LNG ). Medan läckor från en kyld vätskebehållare initialt är tyngre än luft på grund av den ökade densiteten hos den kalla gasen, är gasen vid omgivningstemperatur lättare än luft. Gasledningar distribuerar stora mängder naturgas, där metan är huvudkomponenten.
Bränsle
Metan används som bränsle för ugnar, hem, varmvattenberedare, ugnar, bilar, turbiner etc. Aktivt kol används för att lagra metan. Raffinerad flytande metan används som raketbränsle , i kombination med flytande syre , som i BE-4- och Raptor -motorerna.
Som huvudbeståndsdelen i naturgas är metan viktig för elproduktion genom att förbränna den som bränsle i en gasturbin eller ånggenerator . Jämfört med andra kolvätebränslen producerar metan mindre koldioxid för varje enhet av värme som frigörs. Vid cirka 891 kJ/mol är metans förbränningsvärme lägre än för något annat kolväte, men förhållandet mellan förbränningsvärmen (891 kJ/mol) och molekylmassan (16,0 g/mol, varav 12,0 g/mol) är kol) visar att metan, som är det enklaste kolvätet, producerar mer värme per massenhet (55,7 kJ/g) än andra komplexa kolväten. I många städer leds metan in i hemmen för uppvärmning och matlagning. I detta sammanhang brukar det kallas naturgas , som anses ha ett energiinnehåll på 39 megajoule per kubikmeter, eller 1 000 BTU per standard kubikfot . Flytande naturgas (LNG) är till övervägande del metan (CH 4 ) som omvandlas till flytande form för att underlätta lagring eller transport.
Som ett flytande raketbränsle erbjuder metan fördelen framför fotogen att det producerar små avgasmolekyler. Detta avsätter mindre sot på de inre delarna av raketmotorer, vilket minskar svårigheten att återanvända booster. Avgasens lägre molekylvikt ökar också den del av värmeenergin som finns i form av kinetisk energi tillgänglig för framdrivning, vilket ökar raketens specifika impuls . Flytande metan har också ett temperaturområde (91–112 K) nästan kompatibelt med flytande syre (54–90 K).
Kemiskt råmaterial
Naturgas , som mestadels består av metan, används för att producera vätgas i industriell skala. Ångmetanreformering (SMR), eller helt enkelt känd som ångreformering, är den industriella standardmetoden för att producera kommersiell vätgas i bulk. Mer än 50 miljoner ton produceras årligen över hela världen (2013), främst från SMR av naturgas. Mycket av detta väte används i petroleumraffinaderier , vid tillverkning av kemikalier och i livsmedelsförädling . Mycket stora mängder väte används vid industriell syntes av ammoniak .
Vid höga temperaturer (700–1100 °C) och i närvaro av en metallbaserad katalysator ( nickel ), reagerar ånga med metan för att ge en blandning av CO och H 2 , känd som "vattengas" eller " syngas " :
Denna reaktion är starkt endoterm (förbrukar värme, Δ H r = 206 kJ/mol). Ytterligare väte erhålls genom reaktionen av CO med vatten via vatten-gas-skiftreaktionen :
Denna reaktion är svagt exoterm (producerar värme, Δ H r = -41 kJ/mol).
Metan utsätts också för friradikalklorering vid produktion av klormetaner, även om metanol är en mer typisk prekursor.
Väte kan också produceras genom direkt nedbrytning av metan, även känd som metanpyrolys . Till skillnad från ångreformering producerar själva metanpyrolysreaktionen inte växthusgaser . Värmen som behövs för reaktionen kan också vara fri från växthusgaser, t.ex. från koncentrerat solljus, förnybar elektricitet eller förbränning av en del av det producerade vätet. Om metanet kommer från biogas kan processen vara en kolsänka. Temperaturer över 1200 °C krävs för att bryta bindningarna av metan för att producera vätgas och fast kol. Genom användning av en lämplig katalysator kan emellertid reaktionstemperaturen sänkas till mellan 600°C och 1000°C beroende på den valda katalysatorn. Reaktionen är måttligt endoterm som visas i reaktionsekvationen nedan.
- ( ΔH° = 74,8 kJ/mol )
Generation
Geologiska vägar
De två huvudvägarna för geologisk metangenerering är (i) organisk (termiskt genererad eller termogen) och (ii) oorganisk ( abiotisk ). Termogent metan uppstår på grund av sönderdelning av organiskt material vid förhöjda temperaturer och tryck i djupa sedimentära skikt . Mest metan i sedimentära bassänger är termogent; därför är termogen metan den viktigaste källan till naturgas. Termogena metankomponenter anses vanligtvis vara reliker (från en tidigare tid). Generellt kan bildning av termogen metan (på djupet) ske genom sönderdelning av organiskt material eller organisk syntes. Båda sätten kan involvera mikroorganismer ( metanogenes ), men kan också förekomma oorganiskt. De inblandade processerna kan också förbruka metan, med och utan mikroorganismer.
Den viktigaste källan till metan på djupet (kristallin berggrund) är abiotisk. Abiotisk betyder att metan skapas från oorganiska föreningar, utan biologisk aktivitet, antingen genom magmatiska processer eller via vatten-bergreaktioner som sker vid låga temperaturer och tryck, som serpentinisering .
Biologiska vägar
Det mesta av jordens metan är biogen och produceras av metanogenes , en form av anaerob andning som endast är känd för att föras av några medlemmar av domänen Archaea . Metanogener upptar soptippar och andra jordar , idisslare (till exempel nötkreatur ), termiters tarmar och de syrefria sedimenten under havsbotten och botten av sjöar. Risfält genererar också stora mängder metan under växttillväxt. Denna flerstegsprocess används av dessa mikroorganismer för energi. Nettoreaktionen av metanogenes är:
Det sista steget i processen katalyseras av enzymet metylkoenzym M-reduktas ( MCR).

Idisslare
Idisslare, såsom nötkreatur, rapar metan, som står för cirka 22% av USA:s årliga metanutsläpp till atmosfären. En studie rapporterade att boskapssektorn i allmänhet (främst nötkreatur, kycklingar och grisar) producerar 37 % av all humaninducerad metan. En studie från 2013 uppskattade att boskap stod för 44 % av mänskligt inducerat metan och cirka 15 % av mänskligt inducerade växthusgasutsläpp. Många ansträngningar pågår för att minska boskapens metanproduktion, såsom medicinska behandlingar och kostanpassningar, och för att fånga gasen för att använda dess förbränningsenergi.
Havsbottensediment
Det mesta av undervattensbotten är anoxiskt eftersom syre avlägsnas av aeroba mikroorganismer inom de första centimeterna av sedimentet . Under den syrefyllda havsbotten producerar metanogener metan som antingen används av andra organismer eller blir fångad i gashydrater . Dessa andra organismer som använder metan för energi är kända som metanotrofer ('metanätande'), och är huvudorsaken till att lite metan som genereras på djupet når havsytan. Konsortier av Archaea och Bacteria har visat sig oxidera metan via anaerob oxidation av metan (AOM); de organismer som ansvarar för detta är anaeroba metanotrofiska Archaea (ANME) och sulfatreducerande bakterier (SRB).
Industrivägar
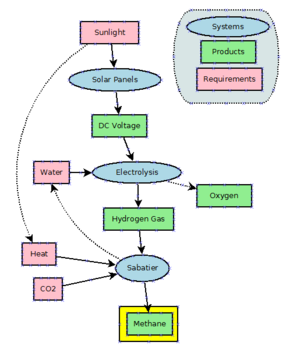
Med tanke på dess billiga överflöd av naturgas finns det få incitament att producera metan industriellt. Metan kan framställas genom att hydrera koldioxid genom Sabatierprocessen . Metan är också en biprodukt av hydreringen av kolmonoxid i Fischer-Tropsch-processen , som praktiseras i stor skala för att producera molekyler med längre kedja än metan.
Ett exempel på storskalig kol-till-metangassning är Great Plains Synfuels- anläggningen, som startade 1984 i Beulah, North Dakota som ett sätt att utveckla rikliga lokala resurser av låggradigt brunkol , en resurs som annars är svår att transportera för dess vikt, askhalt , låga värmevärde och benägenhet till självantändning under lagring och transport. Ett antal liknande anläggningar finns runt om i världen, även om dessa anläggningar oftast är inriktade på produktion av långkedjiga alkaner för användning som bensin , diesel eller råmaterial till andra processer.
Power to metan är en teknik som använder elektrisk kraft för att producera väte från vatten genom elektrolys och använder Sabatier-reaktionen för att kombinera väte med koldioxid för att producera metan. Från och med 2021 är detta mestadels under utveckling och inte i storskalig användning. Teoretiskt sett skulle processen kunna användas som en buffert för överskotts- och lågenergi som genereras av kraftigt fluktuerande vindturbiner och solpaneler . Men eftersom för närvarande mycket stora mängder naturgas används i kraftverk (t.ex. CCGT ) för att producera elektrisk energi, är effektivitetsförlusterna inte acceptabla.
Laboratoriesyntes
Metan kan framställas genom protonering av metyllitium eller ett metyl Grignard-reagens såsom metylmagnesiumklorid . Den kan också tillverkas av vattenfritt natriumacetat och torr natriumhydroxid , blandas och upphettas över 300 °C (med natriumkarbonat som biprodukt). [ citat behövs ] I praktiken kan ett krav på ren metan enkelt uppfyllas av en gasflaska av stål från vanliga gasleverantörer.
Förekomst
Metan upptäcktes och isolerades av Alessandro Volta mellan 1776 och 1778 när han studerade kärrgas från Lago Maggiore . Det är huvudkomponenten i naturgas, cirka 87 volymprocent. Den huvudsakliga källan till metan är utvinning från geologiska fyndigheter som kallas naturgasfält , med gasutvinning från kollag som blir en viktig källa (se metanutvinning i kolbädd , en metod för att utvinna metan från en kolfyndighet , medan förbättrad metanutvinning i kolbädd är en metod för att återvinna metan från icke-brytbara kollag). Det är förknippat med andra kolvätebränslen , och ibland åtföljs av helium och kväve . Metan produceras på grunda nivåer (lågt tryck) genom anaerobt sönderfall av organiskt material och omarbetad metan från djupt under jordens yta. I allmänhet sedimenten som genererar naturgas begravda djupare och vid högre temperaturer än de som innehåller olja .
Metan transporteras i allmänhet i bulk med rörledning i sin naturgasform eller av LNG-fartyg i flytande form; få länder transporterar den med lastbil.
Atmosfärisk metan
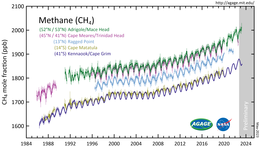
2010 uppmättes metanhalterna i Arktis till 1850 nmol/mol. Denna nivå är över dubbelt så hög som någon gång under de senaste 400 000 åren. Historiska metankoncentrationer i världens atmosfär har varierat mellan 300 och 400 nmol/mol under glaciala perioder, allmänt kända som istider , och mellan 600 och 700 nmol/mol under de varma interglaciala perioderna. Jordens hav är en potentiell viktig källa till arktisk metan.
Metan är en viktig växthusgas med en global uppvärmningspotential på 34 jämfört med CO 2 (potential på 1) under en 100-årsperiod och 72 under en 20-årsperiod.
Jordens metankoncentration i atmosfären har ökat med cirka 150 % sedan 1750, och den står för 20 % av den totala strålningskraften från alla långlivade och globalt blandade växthusgaser. IPCC :s AR6 säger: "Observerade ökningar av koncentrationer av välblandade växthusgaser (GHG) sedan omkring 1750 är otvetydigt orsakade av mänskliga aktiviteter. Sedan 2011 (mätningar rapporterade i AR5) har koncentrationerna fortsatt att öka i atmosfären och nått årliga medelvärden på 410 ppm för koldioxid (CO 2 ), 1866 ppb för metan (CH 4 ), och 332 ppb för dikväveoxid (N 2 O) 2019. (...) Under 2019 var atmosfäriska CO 2 -koncentrationer högre än någon annanstans. tid på minst 2 miljoner år (hög konfidens), och koncentrationerna av CH 4 och N 2 O var högre än någon gång på minst 800 000 år (mycket hög konfidens). Sedan 1750 har ökningar av CO 2 (47%) och CH 4 (156 %) koncentrationer överstiger vida, och ökningar av N 2 O (23 %) liknar, de naturliga flertusenåriga förändringarna mellan glaciala och interglaciala perioder under åtminstone de senaste 800 000 åren (mycket hög konfidens)".
Från 2015 till 2019 har kraftiga ökningar av nivåerna av metan i atmosfären registrerats. I februari 2020 rapporterades det att flyktiga utsläpp och gasutsläpp från fossilbränsleindustrin kan ha underskattats avsevärt.
Klimatförändringar kan öka atmosfärens metannivåer genom att öka metanproduktionen i naturliga ekosystem, vilket bildar en klimatförändringsfeedback . En annan förklaring till de ökade metanutsläppen kan vara en avmattning av den kemiska reaktion som tar bort metan från atmosfären.
Clathrates
Metanklatrater (även kända som metanhydrater) är solida burar av vattenmolekyler som fångar enstaka molekyler av metan. Betydande reservoarer av metanklatrater har hittats i arktisk permafrost och längs kontinentala marginaler under havsbotten inom gasklatratstabilitetszonen, belägen vid höga tryck (1 till 100 MPa; nedre delen kräver lägre temperatur) och låga temperaturer (< 15 °C ; övre änden kräver högre tryck). Metanklatrater kan bildas från biogen metan, termogen metan eller en blandning av de två. Dessa fyndigheter är både en potentiell källa till metanbränsle och en potentiell bidragsgivare till den globala uppvärmningen. Den globala massan av kol som lagras i gasklatrater är fortfarande osäker och har uppskattats så hög som 12 500 Gt kol och så låg som 500 Gt kol. Uppskattningen har minskat över tiden med en senaste uppskattning på ~1800 Gt kol. En stor del av denna osäkerhet beror på vår kunskapslucka i källor och sänkor av metan och distributionen av metanklatrater på global skala. Till exempel upptäcktes en metankälla relativt nyligen i en ås som sprider sig ultralångsamt i Arktis. Vissa klimatmodeller tyder på att dagens metanemissionsregim från havsbotten potentiellt liknar den under perioden för Paleocen–Eocen Thermal Maximum ( PETM ) för cirka 55,5 miljoner år sedan, även om det inte finns några data som tyder på att metan från klatratdissociation för närvarande når atmosfären. Arktisk metanutsläpp från permafrost och metanklatrater från havsbotten är en potentiell konsekvens och ytterligare orsak till den globala uppvärmningen ; detta är känt som clathrate gun-hypotesen . Data från 2016 indikerar att arktisk permafrost tinar snabbare än förutspått.
Utomjordisk metan
Interstellärt medium
Metan finns i överflöd i många delar av solsystemet och skulle potentiellt kunna skördas på ytan av en annan solsystemkropp (särskilt genom att använda metanproduktion från lokala material som finns på Mars eller Titan ), vilket ger bränsle för en returresa.
Mars
Metan har upptäckts på alla planeter i solsystemet och de flesta av de större månarna. [ citat behövs ] Med eventuellt undantag för Mars , tros det ha kommit från abiotiska processer.

Curiosity - rovern har dokumenterat säsongsmässiga fluktuationer av atmosfäriska metannivåer på Mars. Dessa fluktuationer toppade i slutet av marssommaren med 0,6 delar per miljard.
Metan har föreslagits som ett möjligt raketdrivmedel vid framtida Mars-uppdrag , delvis på grund av möjligheten att syntetisera det på planeten genom resursanvändning på plats . En anpassning av Sabatier-metaneringsreaktionen kan användas med en blandad katalysatorbädd och ett omvänt vatten-gasskifte i en enda reaktor för att producera metan från de råvaror som finns tillgängliga på Mars, med användning av vatten från Mars undergrund och koldioxid i Mars atmosfär .
Metan kan produceras genom en icke-biologisk process som kallas serpentinisering som involverar vatten, koldioxid och mineralet olivin , som är känt för att vara vanligt på Mars.
Historia
I november 1776 identifierades metan för första gången vetenskapligt av den italienske fysikern Alessandro Volta i kärren vid Lago Maggiore som grenslar Italien och Schweiz . Volta blev inspirerad att söka efter ämnet efter att ha läst en artikel skriven av Benjamin Franklin om "brandbar luft". Volta samlade upp gasen som steg från träsket och hade 1778 isolerat ren metan. Han visade också att gasen kunde antändas med en elektrisk gnista.
Efter katastrofen i Felling-gruvan 1812, där 92 män omkom, konstaterade Sir Humphry Davy att det fruktade eldgaset i själva verket till stor del var metan.
Namnet "metan" myntades 1866 av den tyske kemisten August Wilhelm von Hofmann . Namnet härrörde från metanol .
Etymologi
Etymologiskt är ordet metan myntat från det kemiska suffixet " -an ", som betecknar ämnen som tillhör alkanfamiljen; och ordet methyl , som härstammar från tyskans methyl (1840) eller direkt från franskans méthyle , som är en bakformation från franskans méthylène (motsvarande engelska "methylene"), vars rot myntades av Jean- Baptiste Dumas och Eugène Péligot 1834 från grekiskans μέθυ methy (vin) (besläktat med engelska "mjöd") och ὕλη hyle (som betyder "trä"). Radikalen är uppkallad efter detta eftersom den först upptäcktes i metanol , en alkohol som först isolerades genom destillation av trä. Det kemiska suffixet -ane är från det koordinerande kemiska suffixet -ine som kommer från latinska feminina suffixet -ina som används för att representera abstrakt. Samordningen av "-ane", "-ene", "-one", etc. föreslogs 1866 av den tyske kemisten August Wilhelm von Hofmann .
Förkortningar
Förkortningen CH 4 -C kan betyda massan av kol som finns i en massa av metan, och massan av metan är alltid 1,33 gånger massan av CH 4 -C. CH 4 -C kan också betyda förhållandet metan-kol, vilket är 1,33 i massa. Metan på skalor i atmosfären mäts vanligtvis i teragram (Tg CH 4 ) eller miljoner metriska ton (MMT CH 4 ), vilket betyder samma sak. Andra standardenheter används också, såsom nanomol (nmol, en miljarddel av en mol), mol (mol), kilogram och gram .
Säkerhet
Metan är ogiftigt , men det är extremt brandfarligt och kan bilda explosiva blandningar med luft. Metan är också kvävande om syrekoncentrationen sänks till under cirka 16% genom förskjutning, eftersom de flesta människor kan tolerera en minskning från 21% till 16% utan negativa effekter . Koncentrationen av metan vid vilken kvävningsrisken blir betydande är mycket högre än koncentrationen på 5–15 % i en brandfarlig eller explosiv blandning. Metangas kan tränga in i byggnader nära soptippar och utsätta de boende för betydande halter av metan. Vissa byggnader har specialkonstruerade återvinningssystem under sina källare för att aktivt fånga upp denna gas och ventilera bort den från byggnaden.
Metangasexplosioner är ansvariga för många dödliga gruvkatastrofer. En metangasexplosion var orsaken till kolgruvan i Upper Big Branch i West Virginia den 5 april 2010 och dödade 29. Olycksutsläpp av naturgas har också varit ett stort fokus inom säkerhetsteknik, på grund av tidigare oavsiktliga utsläpp som slutsatsen i bildandet av jetbrandkatastrofer.
Se även
- 2007 Zasyadko gruvkatastrof
- Abiogent petroleumursprung
- Aerob metanproduktion
- Anaerob matsmältning
- Anaerob andning
- Arktiska metanutsläpp
- Biogas
- Coal Oil Point sippfält
- Energi densitet
- Flyktiga gasutsläpp
- Global Metan Initiative
- Thomas Guld
- Halometan , halogenerade metanderivat.
- Vätgascykel
- Industrigas
- Kivusjön (mer allmänt: limniskt utbrott )
- Lista över rakkedjiga alkaner
- Metanering
- Metanutsläpp
- Metan på Mars:
- Metanogen , arkéer som producerar metan.
- Metanogenes , mikrober som producerar metan.
- Metanotrof , bakterier som växer med metan.
- Metylgrupp , en funktionell grupp relaterad till metan.
Förklarande anteckningar
Citat
Anförda källor
- Haynes, William M., red. (2016). CRC Handbook of Chemistry and Physics (97:e upplagan). CRC Tryck på . ISBN 9781498754293 .
externa länkar
- Metan vid The Periodic Table of Videos (University of Nottingham)
- Internationellt kemikaliesäkerhetskort 0291
- Gas (metan) hydrater – en ny gräns – United States Geological Survey
- Lunsford, Jack H. (2000). "Katalytisk omvandling av metan till mer användbara kemikalier och bränslen: En utmaning för 2000-talet". Katalys idag . 63 (2–4): 165–174. doi : 10.1016/S0920-5861(00)00456-9 .
- CDC – Handbok för metankontroll vid gruvdrift