Infraröd spektroskopi
Infraröd spektroskopi ( IR-spektroskopi eller vibrationsspektroskopi ) är mätningen av interaktionen mellan infraröd strålning och materia genom absorption , emission eller reflektion . Det används för att studera och identifiera kemiska ämnen eller funktionella grupper i fast, flytande eller gasform. Den kan användas för att karakterisera nya material eller identifiera och verifiera kända och okända prover. Metoden eller tekniken för infraröd spektroskopi utförs med ett instrument som kallas en infraröd spektrometer (eller spektrofotometer) som producerar ett infrarött spektrum . Ett IR-spektrum kan visualiseras i en graf av infrarött ljusabsorbans ( eller transmittans ) på den vertikala axeln kontra frekvens , vågnummer eller våglängd på den horisontella axeln. Typiska enheter av vågtal som används i IR-spektra är reciproka centimeter , med symbolen cm −1 . Enheter för IR-våglängd anges vanligtvis i mikrometer (tidigare kallade "mikroner"), symbolen μm, som är relaterade till vågnumret på ett reciprokt sätt. Ett vanligt laboratorieinstrument som använder denna teknik är en Fourier transform infraröd (FTIR) spektrometer . Tvådimensionell IR är också möjlig som diskuteras nedan .
Den infraröda delen av det elektromagnetiska spektrumet är vanligtvis uppdelad i tre områden; de nära- , mellan- och fjärrinfraröda , uppkallade efter deras relation till det synliga spektrumet. Nära-IR med högre energi, cirka 14 000–4 000 cm −1 (0,7–2,5 μm våglängd) kan excitera övertons- eller kombinationslägen av molekylära vibrationer . Den mellaninfraröda, cirka 4 000–400 cm −1 (2,5–25 μm) används vanligtvis för att studera de grundläggande vibrationerna och tillhörande rotations-vibrationsstruktur . Det långt infraröda, cirka 400–10 cm −1 (25–1 000 μm) har låg energi och kan användas för rotationsspektroskopi och lågfrekventa vibrationer. Området från 2–130 cm −1 , som gränsar till mikrovågsområdet , anses vara terahertzområdet och kan undersöka intermolekylära vibrationer. Namnen och klassificeringarna av dessa subregioner är konventioner och är endast löst baserade på de relativa molekylära eller elektromagnetiska egenskaperna.
Teori

Infraröd spektroskopi utnyttjar det faktum att molekyler absorberar frekvenser som är karakteristiska för deras struktur . Dessa absorptioner sker vid resonansfrekvenser , dvs frekvensen av den absorberade strålningen matchar vibrationsfrekvensen. Energierna påverkas av formen på de molekylära potentiella energiytorna , atommassorna och den tillhörande vibroniska kopplingen .

I synnerhet i Born–Oppenheimer och harmoniska approximationer, dvs när den molekylära Hamiltonian som motsvarar det elektroniska grundtillståndet kan approximeras av en harmonisk oscillator i närheten av jämviktsmolekylgeometrin , är resonansfrekvenserna associerade med de normala vibrationssätten motsvarande den molekylära elektroniska jordtillståndets potentiella energiyta.
Resonansfrekvenserna är också relaterade till bindningens styrka och massan av atomerna i vardera änden av den. Således är vibrationernas frekvens associerad med ett speciellt normalt rörelsesätt och en speciell bindningstyp.
Antal vibrationslägen
För att ett vibrationsläge i ett prov ska vara "IR-aktivt" måste det vara associerat med förändringar i dipolmomentet. En permanent dipol är inte nödvändig, eftersom regeln endast kräver en förändring av dipolmomentet.
En molekyl kan vibrera på många sätt, och varje sätt kallas ett vibrationsläge. För molekyler med N antal atomer har geometriskt linjära molekyler 3 N – 5 grader av vibrationslägen, medan icke-linjära molekyler har 3 N – 6 grader av vibrationslägen (även kallade vibrationsgrader av frihet). Som exempel har linjär koldioxid (CO 2 ) 3 × 3 – 5 = 4, medan icke-linjärt vatten (H 2 O) endast har 3 × 3 – 6 = 3.

Enkla diatomiska molekyler har bara en bindning och bara ett vibrationsband. Om molekylen är symmetrisk, t.ex. N 2 , observeras bandet inte i IR-spektrumet, utan endast i Raman-spektrumet . Asymmetriska diatomiska molekyler, t.ex. kolmonoxid ( CO ), absorberas i IR-spektrat. Mer komplexa molekyler har många bindningar och deras vibrationsspektra är på motsvarande sätt mer komplexa, dvs stora molekyler har många toppar i sina IR-spektra.
Atomerna i en CH 2 X 2 -grupp, som vanligtvis finns i organiska föreningar och där X kan representera vilken annan atom som helst, kan vibrera på nio olika sätt. Sex av dessa vibrationer involverar endast CH2 - delen: två sträckningslägen (v): symmetrisk (v s ) och antisymmetrisk (v as ); och fyra böjningslägen : saxning (δ), gungning (ρ), viftande (ω) och vridning (τ), som visas nedan. Strukturer som inte har de två extra X-grupperna kopplade har färre lägen eftersom vissa lägen definieras av specifika relationer till de andra anslutna grupperna. Till exempel, i vatten existerar inte gungnings-, viftande- och vridningslägena eftersom dessa typer av rörelser av H-atomerna representerar enkel rotation av hela molekylen snarare än vibrationer inom den. I fallet med mer komplexa molekyler kan vibrationslägen utanför planet (y) också vara närvarande.
|
Symmetri
Riktning |
Symmetrisk | Antisymmetrisk |
|---|---|---|
| Radiell |
 Symmetrisk sträckning (ν s ) |
 Antisymmetrisk stretching (ν as ) |
| Latitud |
 Sax (δ) |
 Gungande (ρ) |
| Längsgående |
 Viftar (ω) |
 Vridning (τ) |
Dessa siffror representerar inte " rekylen " för C -atomerna, som, även om de nödvändigtvis är närvarande för att balansera molekylens övergripande rörelser, är mycket mindre än rörelserna för de lättare H -atomerna.
De enklaste och viktigaste eller grundläggande IR-banden uppstår från excitationerna av normala lägen, de enklaste distorsionerna av molekylen, från grundtillståndet med vibrationskvanttal v = 0 till det första exciterade tillståndet med vibrationskvanttal v = 1. I vissa fall observeras övertonsband . Ett övertonsband uppstår från absorptionen av en foton som leder till en direkt övergång från grundtillståndet till det andra exciterade vibrationstillståndet ( v = 2). Ett sådant band uppträder med ungefär dubbelt så stor energi som grundbandet för samma normalmod. Vissa excitationer, så kallade kombinationslägen , involverar samtidig excitering av mer än ett normalt läge. Fenomenet Fermi-resonans kan uppstå när två lägen är lika energimässigt; Fermi resonans resulterar i en oväntad förändring i energi och intensitet hos banden etc. [ citat behövs ]
Praktisk IR-spektroskopi
Det infraröda spektrumet för ett prov registreras genom att en stråle av infrarött ljus passerar genom provet. När frekvensen för IR är densamma som vibrationsfrekvensen för en bindning eller samling av bindningar, sker absorption. Undersökning av det transmitterade ljuset avslöjar hur mycket energi som absorberades vid varje frekvens (eller våglängd). Denna mätning kan uppnås genom att skanna våglängdsområdet med en monokromator . Alternativt mäts hela våglängdsområdet med användning av ett Fourier-transforminstrument och sedan genereras ett transmittans- eller absorbansspektrum med användning av en dedikerad procedur.
Denna teknik används ofta för att analysera prover med kovalenta bindningar . Enkla spektra erhålls från prover med få IR-aktiva bindningar och höga nivåer av renhet. Mer komplexa molekylära strukturer leder till fler absorptionsband och mer komplexa spektra.

Provberedning
Gasprover
Gasformiga prover kräver en provcell med lång väglängd för att kompensera för utspädningen. Provcellens väglängd beror på koncentrationen av föreningen av intresse. Ett enkelt glasrör med en längd på 5 till 10 cm försett med infrarödtransparenta fönster i båda ändar av röret kan användas för koncentrationer ner till flera hundra ppm. Provgaskoncentrationer långt under ppm kan mätas med en White's cell där det infraröda ljuset styrs med speglar för att färdas genom gasen. Whites celler finns med optisk väglängd från 0,5 m upp till hundra meter.
Flytande prover
Vätskeprover kan placeras mellan två plattor av ett salt (vanligtvis natriumklorid eller vanligt salt, även om ett antal andra salter som kaliumbromid eller kalciumfluorid också används). Plattorna är transparenta för det infraröda ljuset och introducerar inga linjer på spektra.
Fasta prover
Fasta prover kan framställas på en mängd olika sätt. En vanlig metod är att krossa provet med ett oljigt malningsmedel (vanligtvis mineralolja Nujol ). En tunn film av mullen appliceras på saltplattor och mäts. Den andra metoden är att mala en kvantitet av provet med ett speciellt renat salt (vanligtvis kaliumbromid ) fint (för att ta bort spridningseffekter från stora kristaller). Denna pulverblandning pressas sedan i en mekanisk press för att bilda en genomskinlig pellet genom vilken strålen från spektrometern kan passera. En tredje teknik är tekniken "gjutfilm", som används främst för polymera material. Provet löses först i ett lämpligt, icke- hygroskopiskt lösningsmedel. En droppe av denna lösning avsätts på ytan av KBr- eller NaCl -cellen. Lösningen indunstas sedan till torrhet och filmen som bildas på cellen analyseras direkt. Det är viktigt att se till att filmen inte är för tjock annars kan ljus inte passera igenom. Denna teknik är lämplig för kvalitativ analys. Den sista metoden är att använda mikrotomi för att skära en tunn (20–100 μm) film från ett fast prov. Detta är ett av de viktigaste sätten att analysera misslyckade plastprodukter, till exempel eftersom det fasta ämnets integritet bevaras.
Inom fotoakustisk spektroskopi är behovet av provbehandling minimalt. Provet, flytande eller fast, placeras i provkoppen som sätts in i den fotoakustiska cellen som sedan förseglas för mätningen. Provet kan vara en fast bit, pulver eller i princip i vilken form som helst för mätningen. Till exempel kan en stenbit sättas in i provkoppen och spektrumet mätas från den.
Jämföra med en referens
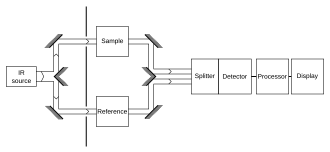
Det är typiskt att spela in spektrum av både provet och en "referens". Detta steg styr för ett antal variabler, t.ex. infraröd detektor , som kan påverka spektrumet. Referensmätningen gör det möjligt att eliminera instrumentpåverkan.
Lämplig "referens" beror på mätningen och dess mål. Den enklaste referensmätningen är att helt enkelt ta bort provet (ersätta det med luft). Men ibland är en annan referens mer användbar. Till exempel, om provet är ett utspätt löst ämne löst i vatten i en bägare, kan en bra referensmätning vara att mäta rent vatten i samma bägare. Då skulle referensmätningen eliminera inte bara alla instrumentella egenskaper (som vilken ljuskälla som används), utan också de ljusabsorberande och ljusreflekterande egenskaperna hos vattnet och bägaren, och det slutliga resultatet skulle bara visa egenskaperna hos löst ämne (åtminstone ungefär).
Ett vanligt sätt att jämföra med en referens är sekventiellt: mät först referensen, ersätt sedan referensen med provet och mät provet. Denna teknik är inte helt tillförlitlig; om den infraröda lampan är lite ljusare under referensmätningen, sedan lite svagare under provmätningen, kommer mätningen att förvrängas. Mer utarbetade metoder, såsom en "tvåstråle"-inställning (se figur), kan korrigera för dessa typer av effekter för att ge mycket exakta resultat. Standardadditionsmetoden kan användas för att statistiskt ta bort dessa fel .
Icke desto mindre, bland olika absorptionsbaserade tekniker som används för detektion av gasformiga arter, kan Cavity ring-down spectroscopy (CRDS) användas som en kalibreringsfri metod. Det faktum att CRDS är baserat på mätningar av fotons livstider (och inte laserintensiteten) gör det onödigt för någon kalibrering och jämförelse med en referens
FTIR
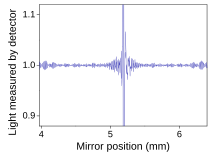
Fourier transform infraröd (FTIR) spektroskopi är en mätteknik som gör att man kan registrera infraröda spektra. Infrarött ljus leds genom en interferometer och sedan genom provet (eller vice versa). En rörlig spegel inuti apparaten ändrar fördelningen av infrarött ljus som passerar genom interferometern. Den direkt inspelade signalen, kallad ett "interferogram", representerar ljusutgången som en funktion av spegelpositionen. En databehandlingsteknik som kallas Fourier-transform förvandlar denna rådata till det önskade resultatet (provets spektrum): Ljuseffekt som en funktion av infraröd våglängd (eller motsvarande vågnummer ). Som beskrivits ovan jämförs provets spektrum alltid med en referens.
En alternativ metod för att erhålla spektra är metoden "dispersiv" eller "scanning monokromator ". I detta tillvägagångssätt bestrålas provet sekventiellt med olika enstaka våglängder. Den dispersiva metoden är vanligare vid UV-Vis-spektroskopi , men är mindre praktisk i infraröd än FTIR-metoden. En anledning till att FTIR gynnas kallas " Fellgetts fördel " eller "multiplexfördelen": informationen vid alla frekvenser samlas in samtidigt, vilket förbättrar både hastighet och signal-brusförhållande . En annan kallas "Jacquinot's Throughput Advantage": En dispersiv mätning kräver detektering av mycket lägre ljusnivåer än en FTIR-mätning. Det finns andra fördelar, såväl som vissa nackdelar, men praktiskt taget alla moderna infraröda spektrometrar är FTIR-instrument.
Infraröd mikroskopi
Olika former av infraröd mikroskopi finns. Dessa inkluderar IR-versioner av sub-diffraktionsmikroskopi som IR NSOM , fototermisk mikrospektroskopi , Nano-FTIR och atomkraftmikroskopbaserad infraröd spektroskopi (AFM-IR).
Andra metoder inom molekylär vibrationsspektroskopi
Infraröd spektroskopi är inte den enda metoden för att studera molekylära vibrationsspektra. Ramanspektroskopi involverar en oelastisk spridningsprocess där endast en del av energin hos en infallande foton absorberas av molekylen och den återstående delen sprids och detekteras. Energiskillnaden motsvarar absorberad vibrationsenergi.
Urvalsreglerna för infraröd och för Raman-spektroskopi är olika åtminstone för vissa molekylära symmetrier , så att de två metoderna är komplementära genom att de observerar vibrationer av olika symmetrier.
En annan metod är elektronenergiförlustspektroskopi (EELS), där den absorberade energin tillhandahålls av en oelastiskt spridd elektron snarare än en foton. Denna metod är användbar för att studera vibrationer av molekyler adsorberade på en fast yta.
Nyligen har högupplöst EELS (HREELS) dykt upp som en teknik för att utföra vibrationsspektroskopi i ett transmissionselektronmikroskop ( TEM). I kombination med TEM:s höga rumsliga upplösning, har aldrig tidigare skådade experiment utförts, såsom temperaturmätningar i nanoskala, kartläggning av isotopiskt märkta molekyler, kartläggning av fononlägen i positions- och momentum-rymd, kartläggning av vibrationsyta och bulkläge på nanokuber och undersökningar av polaritonlägen i van der Waals-kristaller. Analys av vibrationslägen som är IR-inaktiva men uppträder i oelastisk neutronspridning är också möjlig vid hög rumslig upplösning med EELS. Även om den rumsliga upplösningen för HREELs är mycket hög, är banden extremt breda jämfört med andra tekniker.
Beräkningsinfraröd mikroskopi
Genom att använda datorsimuleringar och normalmodsanalys är det möjligt att beräkna teoretiska frekvenser för molekyler.
Absorptionsband
IR-spektroskopi används ofta för att identifiera strukturer eftersom funktionella grupper ger upphov till karakteristiska band både vad gäller intensitet och position (frekvens). Positionerna för dessa band är sammanfattade i korrelationstabeller som visas nedan.
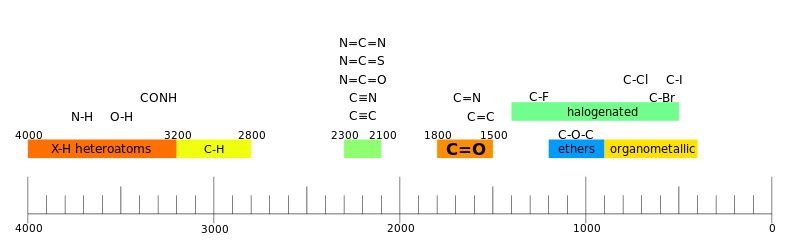
Regioner
En spektrograf tolkas ofta som att den har två regioner.
- funktionell gruppregion
I den funktionella regionen finns en till ett fåtal tråg per funktionell grupp.
- fingeravtrycksområde
I fingeravtrycksområdet finns det många tråg som bildar ett invecklat mönster som kan användas som ett fingeravtryck för att bestämma föreningen.
Grävlingens regel
För många typer av prover är uppdragen kända, dvs vilken/vilka bindningsdeformationer som är förknippade med vilken frekvens. I sådana fall kan ytterligare information samlas in om styrkan på en bindning, med hjälp av den empiriska riktlinjen som kallas Badger's Rule . Ursprungligen publicerad av Richard McLean Badger 1934, denna regel säger att styrkan hos en bindning (i termer av kraftkonstant) korrelerar med bindningslängden. Det vill säga, ökning av bindningsstyrkan leder till motsvarande bindningsförkortning och vice versa.
Användningsområden och tillämpningar


Infraröd spektroskopi är en enkel och pålitlig teknik som används mycket inom både organisk och oorganisk kemi, inom forskning och industri. Inom katalysforskning är det ett mycket användbart verktyg för att karakterisera katalysatorn, samt att upptäcka intermediärer och produkter under den katalytiska reaktionen. Den används i kvalitetskontroll, dynamisk mätning och övervakningstillämpningar som långtidsmätning av CO 2 -koncentrationer i växthus och växtkammare utan tillsyn med infraröda gasanalysatorer.
Det används också i kriminalteknisk analys i både brottmål och civilmål, till exempel för att identifiera polymernedbrytning . Det kan användas för att bestämma alkoholhalten i blodet hos en misstänkt rattfull förare.
IR-spektroskopi har framgångsrikt använts vid analys och identifiering av pigment i målningar och andra konstföremål som illuminerade manuskript .
Ett användbart sätt att analysera fasta prover utan att behöva skära prover använder ATR eller försvagad totalreflektansspektroskopi . Med detta tillvägagångssätt pressas prover mot ytan av en enkristall. Den infraröda strålningen passerar genom kristallen och interagerar endast med provet vid gränsytan mellan de två materialen.
Med ökande teknologi i datorfiltrering och manipulering av resultaten kan prover i lösning nu mätas noggrant (vatten ger en bred absorbans över det intressanta området och gör således spektrat oläsligt utan denna datorbehandling).
Vissa instrument identifierar också automatiskt ämnet som mäts från ett lager med tusentals referensspektra som lagras.
Infraröd spektroskopi är också användbar för att mäta graden av polymerisation vid polymertillverkning . Förändringar i karaktären eller kvantiteten hos en viss bindning bedöms genom att mäta med en specifik frekvens över tiden. Moderna forskningsinstrument kan göra infraröda mätningar över det intressanta området så ofta som 32 gånger per sekund. Detta kan göras medan samtidiga mätningar görs med andra tekniker. Detta gör observationerna av kemiska reaktioner och processer snabbare och mer exakta.
Infraröd spektroskopi har också framgångsrikt använts inom området för halvledarmikroelektronik: till exempel kan infraröd spektroskopi tillämpas på halvledare som kisel , galliumarsenid , galliumnitrid , zinkselenid , amorft kisel, kiselnitrid , etc.
En annan viktig tillämpning av infraröd spektroskopi är inom livsmedelsindustrin för att mäta koncentrationen av olika föreningar i olika livsmedelsprodukter.
Instrumenten är nu små och kan transporteras, även för användning i fältförsök.
Infraröd spektroskopi används också i gasläckagedetektionsenheter som DP-IR och EyeCGAs. Dessa enheter upptäcker kolvätegasläckor vid transport av naturgas och råolja.
I februari 2014 tillkännagav NASA en kraftigt uppgraderad databas, baserad på IR-spektroskopi, för spårning av polycykliska aromatiska kolväten (PAH) i universum . Enligt forskare kan mer än 20% av kolet i universum vara associerat med PAH, möjliga utgångsmaterial för bildandet av liv . PAH:er verkar ha bildats kort efter Big Bang , är utbredda i hela universum och är förknippade med nya stjärnor och exoplaneter . Infraröd spektroskopi är en viktig analysmetod i återvinningsprocessen av hushållsavfallsplast, och en bekväm stand-off metod för att sortera plast av olika polymerer ( PET , HDPE , ...).
Andra utvecklingar inkluderar en IR-spektrometer i miniatyr som är länkad till en molnbaserad databas och lämpar sig för personligt dagligt bruk, och NIR-spektroskopiska chips som kan bäddas in i smartphones och olika prylar.
Isotopeffekter
De olika isotoperna i en viss art kan uppvisa olika fina detaljer i infraröd spektroskopi. Till exempel bestäms O–O-sträckningsfrekvensen (i reciproka centimeter) för oxihemocyanin experimentellt till 832 och 788 cm −1 för ν( 16 O– 16 O) respektive ν( 18 O– 18 O).
Genom att betrakta O–O-bindningen som en fjäder kan absorbansfrekvensen beräknas som ett vågtal [= frekvens/(ljushastighet)]
där k är fjäderkonstanten för bindningen, c är ljusets hastighet och μ är den reducerade massan av A–B-systemet:
( är massan av atomen ).
De reducerade massorna för 16 O– 16 O och 18 O– 18 O kan uppskattas till 8 respektive 9. Således
Effekten av isotoper, både på vibration och sönderfallsdynamiken, har visat sig vara starkare än man tidigare trott. I vissa system, såsom kisel och germanium, involverar sönderfallet av det antisymmetriska sträckningssättet för interstitiellt syre det symmetriska sträckningsläget med ett starkt isotopberoende. Till exempel visades det att för ett naturligt kiselprov är livslängden för den antisymmetriska vibrationen 11,4 ps. När isotopen för en av kiselatomerna ökas till 29 Si, ökar livslängden till 19 ps. På liknande sätt, när kiselatomen ändras till 30 Si, blir livslängden 27 ps.
Tvådimensionell IR
Tvådimensionell infraröd korrelationsspektroskopianalys kombinerar flera prover av infraröda spektra för att avslöja mer komplexa egenskaper. Genom att utöka spektralinformationen för ett stört prov förenklas spektralanalys och upplösningen förbättras. De 2D-synkrona och 2D-asynkrona spektra representerar en grafisk översikt över de spektrala förändringarna på grund av en störning (såsom en ändrad koncentration eller ändrad temperatur) såväl som förhållandet mellan de spektrala förändringarna vid två olika vågnummer.
Icke-linjär tvådimensionell infraröd spektroskopi är den infraröda versionen av korrelationsspektroskopi . Icke-linjär tvådimensionell infraröd spektroskopi är en teknik som har blivit tillgänglig i och med utvecklingen av femtosekunds infraröda laserpulser. I detta experiment appliceras först en uppsättning pumppulser på provet. Detta följs av en väntetid under vilken systemet får slappna av. Den typiska väntetiden varar från noll till flera pikosekunder, och varaktigheten kan styras med en upplösning på tiotals femtosekunder. En sondpuls appliceras sedan, vilket resulterar i emission av en signal från provet. Det olinjära tvådimensionella infraröda spektrumet är ett tvådimensionellt korrelationsdiagram av frekvensen ω 1 som exciterades av de initiala pumppulserna och frekvensen ω 3 exciterade av sondpulsen efter väntetiden. Detta möjliggör observation av koppling mellan olika vibrationslägen; på grund av dess extremt fina tidsupplösning kan den användas för att övervaka molekylär dynamik på en pikosekunds tidsskala. Det är fortfarande en till stor del outforskad teknik och blir allt mer populär för grundforskning.
Som med tvådimensionell kärnmagnetisk resonansspektroskopi ( 2DNMR ) sprider denna teknik spektrumet i två dimensioner och möjliggör observation av korstoppar som innehåller information om kopplingen mellan olika moder. I motsats till 2DNMR involverar ickelinjär tvådimensionell infraröd spektroskopi också excitation till övertoner. Dessa excitationer resulterar i exciterade tillståndsabsorptionstoppar belägna under diagonal- och tvärtopparna. används ofta två distinkta tekniker, COSY och NOESY . Tvärtopparna i den första är relaterade till den skalära kopplingen, medan de i den senare är relaterade till spinnöverföringen mellan olika kärnor. I ickelinjär tvådimensionell infraröd spektroskopi har analoger dragits till dessa 2DNMR-tekniker. Icke-linjär tvådimensionell infraröd spektroskopi med noll väntetid motsvarar COSY, och olinjär tvådimensionell infraröd spektroskopi med ändlig väntetid som tillåter vibrationspopulationsöverföring motsvarar NOESY. COSY-varianten av icke-linjär tvådimensionell infraröd spektroskopi har använts för bestämning av proteinernas sekundära strukturinnehåll.
Se även
- Tillämpad spektroskopi
- Astrokemi
- Atom- och molekylär astrofysik
- Atomkraftsmikroskopi baserad infraröd spektroskopi (AFM-IR)
- Kosmokemi
- Fjärr-infraröd astronomi
- Rättsmedicinsk kemi
- Kriminalteknik
- Kriminalteknisk polymerteknik
- Infraröd astronomi
- Infraröd mikroskopi
- Infraröd multifoton dissociation
- Infraröd fotodissociationsspektroskopi
- Korrelationstabell för infraröd spektroskopi
- Infraröd spektroskopi av metallkarbonyler
- Nära-infraröd spektroskopi
- Kärnresonansvibrationsspektroskopi
- Fototermisk mikrospektroskopi
- Raman spektroskopi
- Rotationsvibrationsspektroskopi
- Tidsupplöst spektroskopi
- Vibrationsspektroskopi av linjära molekyler
externa länkar
- Infraröd spektroskopi för organiska kemister
- Spektrumdatabas för organiska föreningar Arkiverad 2013-01-14 på Wayback Machine










