Oxyanion
En oxyanion , eller oxoanion , är en jon med den generiska formeln A
x O
z − y (där A representerar ett kemiskt element och O representerar en syreatom ). Oxyanjoner bildas av en stor majoritet av de kemiska elementen . Formlerna för enkla oxyanjoner bestäms av oktettregeln . HzAxOy
.
i en är
Den motsvarande oxisyran oxianjon föreningen Strukturerna för kondenserade oxianjoner kan rationaliseras i termer av AO n polyedriska enheter med delning av hörn eller kanter mellan polyedrar. Oxyanjonerna (specifikt fosfat- och polyfosfatestrarna) adenosinmonofosfat ( AMP ), adenosindifosfat ( ADP ) och adenosintrifosfat (ATP) är viktiga inom biologin.
Monomera oxianjoner
Formeln för monomera oxyanjoner, AO
m − n , dikteras av oxidationstillståndet för elementet A och dess position i det periodiska systemet . Elementen i den första raden är begränsade till ett maximalt koordinationstal av 4. Inget av de första radens element har dock en monomer oxianjon med det koordinationsnumret. Istället karbonat ( CO
2− 3 ) och nitrat ( NO
− 3 ) en trigonal plan struktur med π-bindning mellan den centrala atomen och syreatomerna. Denna π-bindning gynnas av likheten i storleken av den centrala atomen och syre.
Oxyanjonerna av andra radens element i gruppens oxidationstillstånd är tetraedriska . Tetraedriska SiO 4 -enheter finns i olivinmineraler , (Mg,Fe) 2 SiO 4 , men anjonen har ingen separat existens då syreatomerna omges tetraedriskt av katjoner i fast tillstånd. Fosfat- ( PO
3− 4 ), sulfat- ( SO
2− 4 ) och perkloratjoner ( ClO
− 4 ) finns som sådana i olika salter. Många oxyanjoner av element i lägre oxidationstillstånd lyder oktettregeln och detta kan användas för att rationalisera de antagna formlerna. Till exempel har klor(V) två valenselektroner så det kan rymma tre elektronpar från bindningar med oxidjoner. Laddningen på jonen är +5 − 3 × 2 = −1, och därför är formeln ClO
− 3 . Jonens struktur förutsägs av VSEPR -teorin vara pyramidformad, med tre bindande elektronpar och ett ensamt par. På liknande sätt har oxyanjonen av klor(III) formeln ClO
− 2 och böjs med två ensamma par och två bindande par.
| Oxidationstillstånd | namn | Formel | Bild |
|---|---|---|---|
| +1 | Hypokloritjonen _ _ | ClO − |

|
| +3 | Kloritjonen _ _ |
ClO − 2 |

|
| +5 | Kloratjonen _ _ |
ClO - 3 |

|
| +7 | Perkloratjonen _ _ |
ClO - 4 |

|
I den tredje och efterföljande raden i det periodiska systemet är 6-koordination möjlig, men isolerade oktaedriska oxyanjoner är inte kända eftersom de skulle ha en för hög elektrisk laddning. Molybden(VI) bildar alltså inte MoO
6− 6 , utan bildar den tetraedriska molybdatanjonen , MoO
2− 4 . MoO 6 -enheter finns i kondenserade molybdater. Fullständigt protonerade oxyanjoner med en oktaedrisk struktur finns i sådana arter som Sn(OH)
2− 6 och Sb(OH)
− 6 . Dessutom kan ortoperiodat endast protoneras delvis, med H
3 IO
2− 6 ||⇌|| H2IO3−6 .
_ H
= || + + med pKa 11,60
Namngivning
Namnet på monomera oxyanjoner följer följande regler.
- Om central atom inte är i grupp VII eller VIII
| Centralatomoxidationsnummer | Namnschema | Exempel |
|---|---|---|
| = Gruppnummer | *-åt |
Borat ( BO 3− 3 ), Karbonat ( CO 2− 3 ), Nitrat ( NO − 3 ), Fosfat ( PO 3− 4 ), Sulfat ( SO 2− 4 ), Kromat ( CrO 2− 4 ), Arsenat ( AsO 3−4 _ ) FeO2−4 _ , Ferrat ( ) |
| = Gruppnummer − 2 | *-ite |
Nitrit ( NO − 2 ), Fosfit ( PO 3− 3 ), Sulfit ( SO 2− 3 ), Arsenit ( AsO 3− 3 ) |
| = Gruppnummer − 4 | hypo-*-ite |
Hypofosfit ( PO 3− 2 ), Hyposulfit ( SO 2− 2 ) |
- Om centralatomen är i grupp VII eller VIII
| Centralatomoxidationsnummer | Namnschema | Exempel |
|---|---|---|
| = Gruppnummer | per-*-ät |
Perklorat ( ClO − 4 ), perbromat ( BrO − 4 ), perjodat ( IO − 4 ), permanganat ( MnO − 4 ), perxenat ( XeO 4− 6 ) |
| = Gruppnummer − 2 | *-åt |
Klorat ( ClO − 3 ), Bromat ( BrO − 3 ), Jodat ( IO − 3 ) |
| = Gruppnummer − 4 | *-ite |
Klorit ( ClO − 2 ), bromit ( BrO − 2 ) |
| = Gruppnummer − 6 | hypo-*-ite | Hypoklorit (ClO − ), Hypobromit (BrO − ) |
Kondensationsreaktioner
I vattenlösning kan oxyanjoner med hög laddning genomgå kondensationsreaktioner, såsom vid bildning av dikromatjonen , Cr 2 O 2− 7 :
Drivkraften för denna reaktion är minskningen av den elektriska laddningstätheten på anjonen och elimineringen av hydroniumjonen ( H + ) . Mängden ordning i lösningen minskar, vilket frigör en viss mängd entropi som gör Gibbs fria energi mer negativ och gynnar framåtreaktionen. Det är ett exempel på en syra-bas-reaktion där den monomera oxyanjonen fungerar som en bas och den kondenserade oxyanjonen fungerar som dess konjugerade syra . Den omvända reaktionen är en hydrolysreaktion , eftersom en vattenmolekyl , som fungerar som en bas, delas. Ytterligare kondensation kan inträffa, särskilt med anjoner med högre laddning, såsom sker med adenosinfosfater.

|
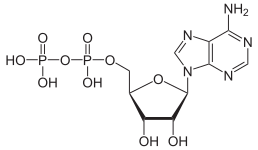
|
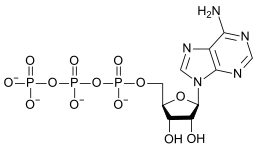
|
| AMP | ADP | ATP |
Omvandlingen av ATP till ADP är en hydrolysreaktion och är en viktig energikälla i biologiska system.
Bildandet av de flesta silikatmineraler kan ses som ett resultat av en dekondensationsreaktion där kiseldioxid reagerar med en basisk oxid, en syra-basreaktion i Lux-Flood- bemärkelse.
Strukturer och formler för polyoxianjoner
En polyoxianjon är en polymer oxianjon i vilken flera oxianjonmonomerer, vanligtvis betraktade som MO n polyedrar, förenas genom att dela hörn eller kanter. När två hörn av en polyeder delas kan den resulterande strukturen vara en kedja eller en ring. Korta kedjor förekommer till exempel i polyfosfater . Inosilikater, såsom pyroxener , har en lång kedja av SiO 4 -tetraedrar som var och en delar två hörn. Samma struktur förekommer i så kallade meta-vanadat, såsom ammoniummetavanadat , NH 4 VO 3 .
Formeln för oxianjonen SiO 2− 3 erhålls enligt följande: varje nominell kiseljon ( Si 4+ ) är bunden till två nominella oxidjoner ( O 2− ) och har en halv andel i två andra. Sålunda ges stökiometrin och laddningen av:
En ring kan ses som en kedja där de två ändarna har sammanfogats. Cyklisk trifosfat , P 3 O 3− 9 är ett exempel.
När tre hörn delas sträcker sig strukturen till två dimensioner. I amfiboler , (varav asbest är ett exempel) är två kedjor sammanlänkade genom att dela ett tredje hörn på alternerande ställen längs kedjan. Detta resulterar i en idealisk formel Si 4 O 6− 11 och en linjär kedjestruktur som förklarar den fibrösa naturen hos dessa mineral. Att dela alla tre hörnen kan resultera i en arkstruktur, som i glimmer , Si 2 O 2− 5 , där varje kisel har ett syre för sig själv och en halv andel i tre andra. Kristallin glimmer kan klyvas till mycket tunna ark.
Att dela alla fyra hörn av tetraedrarna resulterar i en 3-dimensionell struktur, som i kvarts . Aluminiumsilikater är mineraler där en del kisel ersätts med aluminium. Emellertid är oxidationstillståndet för aluminium ett mindre än det för kisel, så ersättningen måste åtföljas av tillsats av en annan katjon. Antalet möjliga kombinationer av en sådan struktur är mycket stort, vilket delvis är anledningen till att det finns så många aluminosilikater.
Oktaedriska MO 6 -enheter är vanliga i oxyanjoner av de större övergångsmetallerna. Vissa föreningar, såsom salter av den kedjepolymeriska jonen, Mo 2 O 2− 7 innehåller till och med både tetraedriska och oktaedriska enheter. Kantdelning är vanligt i joner som innehåller oktaedriska byggstenar och oktaedrarna är vanligtvis förvrängda för att minska spänningen vid de överbryggande syreatomerna. Detta resulterar i 3-dimensionella strukturer som kallas polyoxometalater . Typiska exempel förekommer i Keggin-strukturen för fosfomolybdatjonen . Kantdelning är ett effektivt sätt att minska den elektriska laddningstätheten, vilket kan ses med den hypotetiska kondensationsreaktionen som involverar två oktaedrar:
Här reduceras medelladdningen på varje M-atom med 2. Effektiviteten av kantdelning demonstreras av följande reaktion, som inträffar när en alkalisk vattenlösning av molybdat surgörs.
Den tetraedriska molybdatjonen omvandlas till ett kluster av 7 kantlänkade oktaedrar, vilket ger en genomsnittlig laddning på varje molybden på 6 ⁄ 7 . Heptamolybdatklustret är så stabilt att kluster med mellan 2 och 6 molybdatenheter inte har upptäckts trots att de måste bildas som mellanprodukter.
Heuristisk för surhet
PKa för de besläktade syrorna kan gissas från antalet dubbelbindningar till syre. Således är perklorsyra en mycket stark syra medan hypoklorsyra är mycket svag. En enkel regel fungerar vanligtvis inom cirka 1 pH-enhet.
Syra-bas egenskaper
De flesta oxyanjoner är svaga baser och kan protoneras för att ge syror eller sura salter. Till exempel kan fosfatjonen successivt protoneras för att bilda fosforsyra.
Omfattningen av protonering i vattenlösning kommer att bero på syradissociationskonstanter och pH . Till exempel har AMP (adenosinmonofosfat) ett ap K - värde på 6,21, så vid pH 7 kommer det att vara ca 10 % protonerat. Laddningsneutralisering är en viktig faktor i dessa protoneringsreaktioner. Däremot är de envärda anjonerna perklorat- och permanganatjoner mycket svåra att protonera och därför är motsvarande syror starka syror .
Även om syror som fosforsyra skrivs som H 3 PO 4 , är protonerna bundna till syreatomer som bildar hydroxylgrupper, så formeln kan också skrivas som OP(OH) 3 för att bättre återspegla strukturen. Svavelsyra kan skrivas som 2 ; O2S (OH ) detta är den molekyl som observeras i gasfasen.
Fosfitjonen , PO 3− 3 , är en stark bas och bär därför alltid minst en proton. I detta fall är protonen bunden direkt till fosforatomen med strukturen HPO 2− 3 . Vid bildandet av denna jon beter sig fosfitjonen som en Lewis-bas och donerar ett par elektroner till Lewis-syran, H + .
Som nämnts ovan är en kondensationsreaktion också en syra-basreaktion. I många system kan både protonations- och kondensationsreaktioner förekomma. Fallet med kromatjonen ger ett relativt enkelt exempel. I överviktsdiagrammet för kromat, som visas till höger, står pCr för den negativa logaritmen för kromkoncentrationen och pH står för den negativa logaritmen för H + jonkoncentrationen. Det finns två oberoende jämvikter. Jämviktskonstanter definieras enligt följande.
Överviktsdiagrammet tolkas enligt följande.
- Kromatjonen, CrO 2− 4 , är den dominerande arten vid högt pH. När pH stiger blir kromatjonen allt mer dominerande, tills den är den enda arten i lösningar med pH > 6,75.
- Vid pH < p K 1 är vätekromatjonen, HCrO − 4 dominerande i utspädd lösning.
- Dikromatjonen, Cr 2 O 2− 7 , är dominerande i mer koncentrerade lösningar, förutom vid högt pH.
Arterna H 2 CrO 4 och HCR 2 O − 7 visas inte då de bildas endast vid mycket lågt pH.
Överviktsdiagram kan bli mycket komplicerade när många polymera arter kan bildas, såsom i vanadater , molybdater och volframater . En annan komplikation är att många av de högre polymererna bildas extremt långsamt, så att jämvikt kanske inte uppnås ens på månader, vilket leder till möjliga fel i jämviktskonstanterna och överviktsdiagrammet.
Se även
externa länkar
-
 Media relaterade till Oxoanions på Wikimedia Commons
Media relaterade till Oxoanions på Wikimedia Commons
| HClO4 _ | han | |||||||||||||||||
| LiClO 4 | Be(ClO4)2 |
B(ClO4 ) - 4 B (ClO4)3 |
ROClO3 |
NH4ClO4NOClO4 N ( ) ClO4 3 |
H 3 OClO 4 | FClO 4 | Ne | |||||||||||
| NaClO4 _ | Mg( ClO4 ) 2 |
Al(ClO4)3 Al(ClO4 ) − 4 Al (ClO4)2−5 3−6 Al (ClO 4 ) |
Si | P | S |
ClO − 4 ClOClO 3 Cl 2 O 7 |
Ar | |||||||||||
| KClO 4 | Ca( ClO4 ) 2 | Sc( ClO4 ) 3 | Ti( ClO4 ) 4 |
VO(ClO 4 ) 3 VO 2 (ClO 4 ) |
Cr( ClO4 ) 3 | Mn(ClO4)2 |
Fe(ClO4 ) 2 Fe (ClO4)3 |
Co(ClO4)2, Co(ClO4)3 |
Ni( ClO4 ) 2 | Cu( ClO4 ) 2 | Zn(ClO4)2 | Ga(ClO4)3 | Ge | Som | Se | Br | Kr | |
| RbClO4 _ | Sr( ClO4 ) 2 | Y(ClO4)3 | Zr( ClO4 ) 4 | Nb(ClO4)5 | Mo | Tc | Ru | Rh( ClO4 ) 3 | Pd(ClO4)2 | AgClO 4 | Cd(ClO4)2 | I (ClO4)3 | Sn(ClO4)4 | Sb | TeO(ClO4)2 | jag | Xe | |
| CsClO4 _ | Ba( ClO4 ) 2 | Lu(ClO4)3 | Hf(ClO4)4 | Ta(ClO4)5 | W | Re | Os | Ir | Pt | Au |
Hg2(ClO4)2, Hg(ClO4)2 |
Tl(ClO4), Tl(ClO4)3 |
Pb( ClO4 ) 2 | Bi(ClO4)3 | Po | På | Rn | |
| FrClO4 | Ra | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | ||||||||||||||||||
| La | Ce(ClO4)x | Pr( ClO4 ) 3 | Nd( ClO4 ) 3 | Pm | Sm(ClO4)3 | Eu(ClO4)3 | Gd(ClO4)3 | Tb(ClO4)3 | Dy(ClO4)3 | Ho(ClO4)3 | Er(ClO4)3 | Tm(ClO4)3 | Yb(ClO4)3 | |||||
| Ac | Th(ClO4)4 | Pa | UO2(ClO4)2 | Np | Pu | Am | Centimeter | Bk | Jfr | Es | Fm | Md | Nej | |||||
















![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2-}} ][\mathrm {H^{+}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c28311b8a8a69931b4cfa144888a4d9e4306b1)


![K_{2}={\frac {[{\mathrm {Cr_{2}O_{7}^{{2-}}}}]}{[{\mathrm {HCrO_{4}^{-}}}]^{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)
