TRPV6
| TRPV6 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , ABP/ZF, CAT1, CATL, ECAC2, HSA277909, LP6728, ZFAB, transient receptor potentiell katjonkanal underfamilj V medlem 6, HRPTTN | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa IDs | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
TRPV6 är ett membrankalcium (Ca 2+ ) kanalprotein som är särskilt involverat i det första steget i Ca 2+ -absorption i tarmen .
Klassificering
Transient Receptor Potential Vanilloid underfamiljmedlem 6 (TRPV6) är en epitelial Ca 2+ -kanal som tillhör den transienta receptorpotentialfamiljen (TRP) av proteiner. TRP-familjen är en grupp av kanalproteiner som är avgörande för jonisk homeostas och uppfattningen av olika fysiska och kemiska stimuli. TRP-kanaler kan detektera temperatur , osmotiskt tryck , lukt , smak och mekaniska krafter. Det mänskliga genomet kodar för 28 TRP-kanaler, som inkluderar sex TRPV- kanaler. Den höga Ca2 + -selektiviteten hos TRPV5 och TRPV6 gör att dessa kanaler skiljer sig från de andra fyra TRPV-kanalerna (TRPV1-TRPV4). TRPV5 och TRPV6 är involverade i Ca 2+ transport, medan TRPV1 till TRPV3 är värmesensorer med olika temperaturtröskel för aktivering, och TRPV4 är involverad i avkänning av osmolaritet . Genetiska defekter i TRPV6-genen är kopplade till övergående neonatal hyperparatyreoidism och tidig kronisk pankreatit . Dysregulation av TRPV6 är också involverad i hyperkalciuri , njurstensbildning , benstörningar, defekter i keratinocytdifferentiering , skelettdeformiteter, artros , manlig sterilitet , Pendreds syndrom och vissa undertyper av cancer .
Identifiering
Peng et al identifierade TRPV6 1999 från råttduodenum i ett försök att söka efter Ca2 + -transporterande proteiner involverade i Ca2 + -absorption. TRPV6 kallades också kalciumtransportprotein 1 (CaT1) från början även om namnen epitelial kalciumkanal 2 (ECaC2) och CaT1-liknande (CaT-L) också användes i tidiga studier för att beskriva kanalen. Human- och musortologerna av TRPV6 klonades av Peng et al och Weber et al. Namnet TRPV6 bekräftades 2005.
Genplacering, kromosomal placering och fylogeni
Den humana TRPV6 -genen är lokaliserad på kromosomalt lokus 7q33-34 i nära anslutning till sin homolog TRPV5 på 7q35. TRPV6 - genen hos människa kodar för 2906 bp långt mRNA . I motsats till de flesta andra proteiner, som initierar translation med ett AUG- kodon , initieras TRPV6-translation av icke-AUG-kodonmedierad läsning. TRPV6-proteinet har en 40-aa-lång N-terminal förlängning i placenta och i vissa fysiologiska miljöer i jämförelse med den kommenterade versionen av proteinet som används i biologiska studier. Det återstår dock att fastställa om den långa versionen av TRPV6-proteinet är den dominerande formen i olika vävnader.
| Arter | Mänsklig | Råtta | Mus |
| Kromosomalt läge | 7q33-q34 | 4q22 | 6B2 |
| Kommenterad aa längd | 725 | 727 | 727 |
| In vivo aa längd a | 765 | 767 | 767 |
| RefSeq-nukleotid | NM_018646 | NM_053686 | NM_022413 |
| RefSeq protein | NP_061116 | NP_446138 | NP_071858 |
a Ska verifieras i olika vävnader.
Det har antagits att Trpv5- och Trpv6 -gener genererades från en enda förfäders gen genom gendupliceringshändelser . Fylogenetisk analys har visat att TRPV6- paraloger hos däggdjur , sauropsider , amfibier och kondrithyes uppstod ur oberoende dupliceringshändelser i varje grupps förfader. Det spekuleras att två specialiserade Ca 2+ -selektiva Trpv -homologer uppstod som en anpassning för att uppnå en högre grad av funktionell specialisering för att navigera distinkta njurproblem hos landlevande djur.
Två alleler av TRPV6 -genen har identifierats hos människor (ursprungligen noterade som CaT-La och CaT-Lb). Dessa alleler uppvisar kopplade polymorfismer som genererar två versioner av samma gen. Polymorfismerna ger upphov till en "förfädersvariant" och en "deriverad variant" som skiljer sig i fem baser och tre aminosyror. De förfäders allelkoder för C197(157, inom parentes är annoterade aminosyranumrering), M418(378) och M721(681) medan den härledda allelen kodar för R197(157), V418 (378) och T721(681). Frekvensen av den förfäders TRPV6- allel varierar mellan olika befolkningsgrupper. Det antas att selektionstryck som kunde ha förändrat TRPV6- allelfördelningen inkluderar förändringar i mönster för mjölkkonsumtion, domesticering av djur, förändring i exponering för ultraviolett ljus på grund av trans-ekvatorial migration, genomiska anpassningar som ger immunfördelar till populationer som möter nya patogener.
Vävnadsfördelning
TRPV6-proteinet uttrycks i epitelvävnader såsom tarm , njure , placenta , bitestikel och exokrina körtlar såsom bukspottkörteln , prostata och spott , svett och bröstkörtlar . TRPV6-proteinuttryck hos människor har visats i matstrupen , magen , tunntarmen , tjocktarmen , bukspottkörteln, bröstkörtlarna, äggstockarna , sköldkörteln och prostata genom immunhistokemi . TRPV6-uttryck begränsas huvudsakligen till det apikala membranet hos epitelceller. enterocytens borst-kantmembran .
Skillnader i TRPV6-expressionsprofilen har rapporterats möjligen på grund av variation i analysberoende sådan primerdesign , hybridiseringsprober , PCR vs. northern blotting , semikvantitativ PCR vs. RT-PCR och antikroppar som används för immunodetektion. TRPV6-uttrycksprofilen påverkas också av ålder, kön, Ca 2+ och vitamin D 3 -nivåer i födan, hormonell status, lokalisering i vävnaden, cellulär lokalisering, reproduktionsstatus och avvänjningsstatus (se avsnitt förordning ) .
Hos människor har TRPV6-transkript detekterats i moderkakan, bukspottkörteln, prostatacancer och tolvfingertarmen och prostata genom northern blotting; och i duodenum, jejunum, placenta, bukspottkörteln, testiklarna, njurarna, hjärnan och tjocktarmen genom semikvantitativ PCR. Hos gnagare har TRPV6-uttryck validerats i tolvfingertarmen, blindtarmen, tunntarmen, kolon, placenta, bukspottkörteln, prostata och bitestikel genom Northern Blotting. Hos mus är TRPV6-transkriptförekomsten mätt med RT-PCR enligt följande: prostata > mage, hjärna > lunga > duodenum, blindtarm, hjärta, njure, ben > kolon > skelettmuskel > pankreas.
Data från Human Protein Atlas och RNA-Seq-baserade tyder på att TRPV6-mRNA är lågt i de flesta vävnader förutom moderkakan, spottkörteln, bukspottkörteln och prostata. TRPV6 mRNA uttrycks i den apikala domänen av murina osteoklaster av kortikalt ben. Kortikala och trabekulära osteocyter uttrycker inte TRPV6-mRNA medan osteoblaster visar svagt uttryck.
Struktur och biofysiska egenskaper
Primär och sekundär struktur
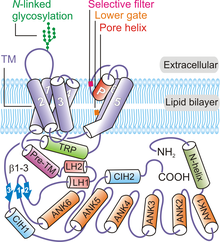
Sammantaget arrangerar fyra subenheter av TRPV6 att bilda en tetramer kanal som visar en fyrfaldig symmetri . Med början från N-terminalen och rör sig mot proteinets C-terminal , innehåller varje TRPV6- polypeptid : en N-terminal helix, en ankyrinupprepningsdomän (ARD) som innehåller sex ankyrinupprepningar, en länkdomän med β-hårnålsstruktur som består av två β -strängar , ett helix-turn-helix-motiv, en pre-SI-helix, TM-domän som består av sex TM-helixar (S1 till S6), en porslinga (även kallad P-loop), amfipatisk TRP-helix, C - terminal krok och en sex-rester β-sträng (β3) ( Figur 1) .
Tertiär och kvartär struktur
TRPV6-kanalproteinet uppvisar fyrfaldig symmetri och innehåller två huvudfack: en 30 Å-hög transmembrandomän med en central jonkanalpor och en ~70 Å-hög och en ~110 Å-bred intracellulär kjol som omsluter en 50 Å × 50 En hålighet bred hålighet under jonkanalen. Klustringen av fyra TRPV6-subenheter bildar en vattenhaltig por som uppvisar en fyrfaldig symmetri ( Figur 2 ) . En pre-SI-helix länkar den intracellulära delen av proteinet till TM-domänen genom en länkdomän som består av β-hårnålsstruktur och ett helix-turn-helix-motiv. Helixar S1 till S4 bildar ett transmembrant spiralknippe eller TM-domän som sätts in nästan vinkelrätt mot plasmamembranets plan .
Pormodulelementen är uppbyggda av S5, S6 och P-loopen i TM-domäner. Pormodulen från varje TRPV6-polypeptid deltar i inter-subenhetsinteraktioner för att bilda en central jonpor ( Figur 1) . De porbildande elementen i varje TRPV6-subenhet interagerar också med S1-S4-domäner av den intilliggande polypeptiden i ett domänbytt arrangemang. Intersubunit interaktioner förekommer också mellan S1-S2 extracellulära slingor och S5-P och S6-P loopar av de närliggande TRPV6 subenheterna. Det konserverade N-kopplade glykosyleringsstället på S1-S2-slingan krävs för den Klotho -medierade aktiveringen. Den intracellulära kjoldelen av TRPV6-proteinet består huvudsakligen av ankyrinupprepningarna. TRP-domänen är orienterad parallellt med membranet och deltar i hydrofoba interaktioner med TM-domänen och de hydrofila interaktionerna i den intracellulära kjolen. Den N-terminala helixen, C-terminala kroken och β-sheets (bildade av β-hårnålsstrukturen i länkdomänen) i kanalen deltar i intersubunit interaktioner med ARDs för att tillhandahålla ett ramverk för att hålla elementen i den intracellulära kjolen tillsammans.
Porarkitektur och katjonbindningsställen
TRPV6-poren har fyra huvudelement, nämligen den extracellulära vestibulen, ett selektivitetsfilter, en hydrofob kavitet och en nedre port. Mot kanalens centrala lumen är ett selektivitetsfilter med fyra rester ( 538 TIID 541 ) som innehåller fyra Aspartate 541 (D541) sidokedjor (en från varje protomer) avgörande för Ca 2+ selektivitet och andra biofysiska egenskaper hos kanalen. Detta filter bildar en negativt laddad ring som skiljer mellan joner baserat på deras storlek och laddning. Mutationer i den kritiska porbildande återstoden av TRPV6 blockerar Ca2 + -upptaget, en strategi har använts för att generera TRPV6-förlust-av-funktionsmodeller för att undersöka kanalens roll i djurfysiologi. Fyra olika typer av katjonbindningsställen tros existera i TRPV6-kanalen. Plats 1 är belägen i den centrala poren och delar samma plan som upptas av de nyckelselektiva resterna D541. Plats 2 tros vara närvarande cirka 6-8 Å under plats 1 följt av plats 3 som är belägen i den centrala poraxeln cirka 6,8 Å under plats 2. Plats 2 och 3 tros interagera med partiellt hydratiserat till ekvatorialt hydratiserat Ca 2+ joner. Slutligen förmedlar fyra symmetriska katjonbindningsställen i den extracellulära vestibulen rekryteringen av katjoner mot den extracellulära vestibulen av TRPV6 och kallas rekryteringsställen.
Jongenomträngning
Konduktansen för TRPV6 för tvåvärda katjoner följer preferensen: Ca 2+ > Ba 2+ > Sr 2+ > Mn 2 . Intracellulärt Mg 2+ hämmar TRPV6 och bidrar till den starka inåtriktade korrigeringen som kanalen uppvisar. TRPV6-upptagningsaktiviteten hämmas av tvåvärda Pb2 , Cu2 + , Cd2 + , Zn2 , Co2 + , Fe2 + och trevärda katjoner La3+ , Fe3 + , Gd3 + . Koncentrationen av joner för att uppnå hämningen varierar från 1 till 10 μM. TRPV6-proteinet är konstitutivt med en enkanalskonduktans på 42-58 ps. Vid låga Ca2 + -koncentrationer binder en enda Ca2 + -jon i selektivitetsfiltret som bildas av D541 och tillåter Na + -permeation. Vid hög Ca 2+ koncentration sker Ca 2+ permeation genom en knock-off mekanism som involverar bildandet av kortlivade konformationer som involverar bindning av tre Ca 2+ joner till rest D541.
Kanalport

De konformationsförändringar som är involverade i kanalöppning är ledade runt resten Alanine 566 (A566) och förekommer i porbeklädnadsspiralen S6 ( Figur 3 ). Den övre delen av S6-helixen genomgår en α-till-π-spiralövergång som tvingar den nedre delen av helixen att vända sig 100 grader och luta bort från poraxeln med 11 grader. Denna konformationsförändring flyttar den nedre delen av spiralen som gränsar poren och vidgar därigenom porstorleken. Konformationsförändringen förändrar resterna som är vända mot poraxeln och utlöser bildandet av nya elektrostatiska bindningar , subenhet och saltbryggor som kompenserar för den höga energikostnaden för ogynnsam α-till-π spiralövergång som inträffar under kanalöppning.
Reglering genom fosfatidylinositol 4,5-bisfosfat (PIP 2 ) och kalmodulin (CaM)
Inflödet av Ca 2+ inuti cellen utlöser negativa återkopplingsmekanismer för att undertrycka TRPV6-aktivitet och förhindra Ca 2+ överbelastning. TRPV6-kanalaktiviteten regleras av den intracellulära nivån av fosfolipid fosfatidylinositol 4,5-bisfosfat (PIP 2 ) och interaktioner med Ca 2+ - Calmodulin (CaM) komplex. Utarmningen av PIP 2 eller CaM-bindning inaktiverar TRPV6. Inflödet av Ca 2+ i TRPV6-uttryckande celler aktiverar fosfolipas C (PLC) som i sin tur hydrolyserar PIP 2 . Utarmning av PIP 2 -nivåer resulterar i en minskning av kanalaktivitet eftersom de flesta TRP-kanaler kräver denna lipid för aktivering. Lipiden PIP 2 kan åsidosätta Ca 2+ -CaM-medierad hämning av TRPV6. Totalt sett är TRPV6-inaktivering av calmodulin orkestrerad av en balans mellan intracellulär Ca 2+ och PIP 2 -koncentration.
Interagerande proteiner
Bland 20+ TRPV6-interaktörer som hittills identifierats har de funktionella konsekvenserna av Ca 2+ -bindande protein Calmodulin (CaM) och Glucuronidase Klotho karaktäriserats mest omfattande [36, 37, 41, 42]. Funktionella konsekvenser av TRPV6-kanalaktivering sammanfattas i tabellen nedan).
| Interaktör | Följd |
| BSPRY | N/A |
| Calbindin-D 28k | N/A |
| Calmodulin | Hämning |
| Cyclophilin B | Aktivering |
| FYN | PO 4 lyation |
| I-MFA | N/A |
| Klotho | Aktivering, glykosylering (Asn-357) |
| NHERF4 | Aktivering |
| NIPSNAP1 | Hämning |
| STEL | Hämning |
| PTEN | N/A |
| PTP1B | DePO 4- läge (Tyr-161 och Tyr-162) |
| RAB11A | Aktivering, Ökning av plasmamembrannivån |
| RGS2 | N/A |
| RYR1 | N/A |
| S100A10 | Aktivering, Ökning av plasmamembrannivån |
| SRC | PO 4 lyation (Tyr-161, 162) |
| TRPC1 | Behåller i ER, Inhibition |
| TRPML3 | N/A |
| TRPV5 | Tetramerbildning, Skapa ny kanal |
Förkortningar
Protein interaktör
BSPRY: B-Box och Spry Domain som innehåller protein; FYN: Fyn Kinase tillhörande Src Family of Kinas; I-MFA: Myo D Family Inhibitor; NHERF: Na Exchanger Regulatory Factor; NIPSNAP14-nitrofenylfosfatasdomän och icke-neuronal SNAP25-liknande proteinhomolog 1; Numb: Drosophila-mutation som tar bort de flesta sensoriska nervceller i det utvecklande perifera nervsystemet; PTP: Proteintyrosinfosfatas; Rab11a: Medlem RAS Oncogene Family; RGS2: Regulator Of G-Protein Signaling 2; RyR1: Ryanodine-receptor 1; TRPC1: Transient receptorpotential kanonisk 1; TRPML3: Övergående receptorpotential Mucolipin-3.
Fysiologiska funktioner
De Ca 2+ -selektiva kanalproteinerna TRPV6 och TRPV5 samarbetar för att upprätthålla kalciumkoncentrationen i specifika organ. TRPV6 fungerar som apikala Ca 2+ ingångskanaler som förmedlar transcellulär transport av denna jon i tarmen, placentan och möjligen några andra exokrina organ. TRPV6 spelar också viktiga roller i maternell-foster kalciumtransport, keratinocytdifferentiering och Ca 2+ homeostas i det endolymfatiska systemet i det vestibulära systemet och underhåll av manlig fertilitet.
C a 2+ absorption i tarmen
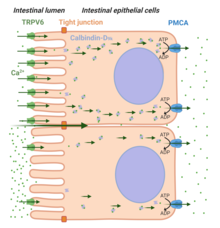
Två vägar för Ca2 + -absorption känns igen: paracellulär transport och transcellulär transport (se figur 4) . En hög-Ca 2+ -diet gynnar paracellulär transport av jonen över tarmens längd och tillåter dem att passera mellan de intercellulära täta förbindelserna som förbinder epitelceller. Däremot under förhållanden när [Ca 2+ ] i tarmens lumen är lägre jämfört med dess koncentration i plasma (t.ex. under låg Ca 2+ ) i kosten, krävs den transcellulära vägen för adekvat Ca 2+ -absorption. Tre viktiga steg i transcellulär Ca 2 + -transport känns igen: cellulär inträde av Ca 2+ -jon på den apikala sidan via TRPV6 (Steg-1), bindningen av Ca 2+ -jon med calbindin -D 9k (Steg-2) och utträde av Ca 2+ från den basolaterala sidan via plasmamembranet Ca 2+ ATPas (PMCA1b). Hormonet Vitamin D 3 (eller 1,25(OH) 2 D 3 ) spelar en viktig roll i TRPV6-medierad Ca 2+ absorption i tarmen).
Ca 2+ reabsorption i njuren
I motsats till tarmen, där TRPV6 är portvakten för Ca 2+ absorption, sker den transcellulära reabsorptionen av denna jon i njuren genom TRPV5. Även om TRPV5 är en erkänd gatekeeper för transcellulär reabsorption av Ca 2+ jon i njuren, kämpar TRPV6 knockout (KO) möss också för att koncentrera sin urin och visa hyperkalciuri. TRPV6 är känt för att samlokaliseras med TRPV5 Calbindin-D 28K i apikala domäner av distala hoprullade tubuli och anslutande tubuli [20]. TRPV5 KO-möss kompenserar för Ca2 + -förlust genom att öka TRPV6-uttrycket i duodenum. Dessutom antydde en nyligen genomförd studie som analyserade vitamin D-känsliga gener i får- , hund- och hästnjure att TRPV6, calD 9k /calD 28k och PMCA kan vara de huvudsakliga vägarna för transcellulär Ca 2+ -transport i njurarna hos får, hundar och hästar.
Maternal-foster Ca 2+ transport
TRPV6 spelar en oumbärlig roll i placenta Ca 2+ transport. Fostrets benmineralisering toppar under sen graviditet. I detta skede har fosterblod en högre koncentration av Ca 2+ jämfört med moderns blod och skapar därmed tillstånd som kräver aktiv transcellulär transport av Ca 2+ från mamma till fostret. Denna process är mycket viktig eftersom defekter i placenta transport av kalcium kan vara prekursorer för Ca 2+ -bristsyndrom och intrauterina tillväxtrestriktioner . Uttrycket av TRPV6 ökar 14-faldigt under de sista 4 dagarna av den murina graviditetsperioden och sammanfaller med toppfasen av fostrets benmineralisering. Proteinet TRPV6 uttrycks rikligt i placentavävnader hos däggdjur. TRPV6-uttrycket är faktiskt ~1000 gånger högre jämfört med TRPV5. I moderkakan uttrycks TRPV6 i trofoblaster och syncytiotrofoblaster . Hos möss uttrycks TRPV6 mRNA och protein i den intraplacentala gulesäcken och det viscerala lagret av den extraplacentala gulesäcken. Viktigast är att TRPV6 KO-foster uppvisar en 40 % minskning av 45 Ca 2+ transportaktivitet och en dramatisk minskning av askvikten (ett mått på fostrets benhälsa). Hos människor är trofoblaster fluid shear stress (FSS) känd för att inducera ett TRPV6-medierat Ca 2+ inflöde och främja bildning av mikrovilli genom en mekanism som involverar Ezrin och Akt-fosforylering.
Epididymal Ca 2+ reglering och implikationer på manlig fertilitet
Regleringen av kalciumkoncentrationen i epididymalumen är avgörande för spermiers rörlighet . TRPV6-medierad minskning av luminal Ca 2+ koncentration i epididymis är avgörande för manlig fertilitet hos möss. TRPV6 KO-möss eller möss som uttrycker en version av TRPV6-kanalen med förlorad funktion ( Trpv6 D541A homozygota möss) har en allvarligt nedsatt fertilitet . Möss som uttrycker icke-funktionell TRPV6 har en 10 gånger högre koncentration av Ca 2+ i epididymalumen och Ca 2+ -upptaget i detta utrymme minskas med 7-till-8 gånger. De ökade Ca 2+ -jonerna i epididymal lumen-koncentration leder till signifikanta defekter i rörlighet, befruktningskapacitet och livsduglighet hos spermier i TRPV6 D541A -möss. Det verkar som att TRPV6 och kloridkanal transmembrana sätt 16A ( TMEM16A ) samverkar för att minska den luminala koncentrationen av Ca 2+ i epididymalumen.
Benhälsa
Under förhållanden med suboptimal dietär Ca2 + upprätthålls normala serumkalciumnivåer i TRPV6 KO-möss på bekostnad av ben. TRPV6 spelar en viktig roll i osteoklaster men inte i osteoblaster. Hos möss resulterar TRPV6-utarmning i ökad osteoklastdifferentiering medan TRPV5 är avgörande för korrekt osteoklastisk benresorption.
Keratinocytdifferentiering
Keratinocytdifferentiering orkestreras av kalciumväxling, en process som medför ett inflöde av Ca 2+ i keratinocyter som inducerar breda transkriptionsförändringar som är nödvändiga för desmosombildning , stratifiering och förhorning. TRPV6 KO-möss visar tunnare lager av stratum corneum och 20% av mössen visar också alopeci och dermatit . Tystnaden av TRPV6 försämrar Ca2 + -medierad differentiering av humana primära keratinocyter och nedreglerar differentieringsmarkörer såsom involukrin , transglutaminas-1 och cytokeratin-10 . Hormonet 1,25-dihydroxyvitamin-D3 uppreglerar TRPV6 i keratinocyter och utlöser ett Ca 2+ inflöde. Detta inducerar i sin tur uttrycket av keratinocytdifferentieringsspecifika vägar.
Roll i innerörat
Proteinerna TRPV5 och TRPV6 uttrycks i flera regioner av innerörat såväl som i primära kulturer av halvcirkulär kanalkanal (SCCD) epitel. Vissa studier har visat att TRPV5 och TRPV6 behövs för att sänka Ca2 + -koncentrationen i lumen hos däggdjursendolymfa, ett krav som är väsentligt för normal hörsel och balans.
Uterin och placenta uttryck av TRPV6 och implikationer vid graviditet
Endometrial och livmoderexpression av TRPV6 har rapporterats hos däggdjur. Uttrycket av TRPV6 i livmodern tros vara hormonellt reglerat av 17β-östradiol och progesteron hos gnagare. Hos gnagare uttrycks TRPV6-mRNA i labyrinten och den svampiga zonen såväl som placenta-obundna områden i livmodern. Graviditetsstadiet är en viktig regulator av TRPV6-uttryck. Nedregleringen av TRPV5/6-uttryck och en resulterande minskning av Ca2 + -transport tros förändra den proliferativa profilen hos humana trofoblaster; en process som i sin tur är kopplad till utvecklingen av havandeskapsförgiftning . Denna sammanställning av TRPV6-uttryck och dess strikta reglering av könshormoner under graviditeten tyder på att proteinet kan vara viktigt för embryoimplantation , men avgörande bevis för detta samband finns inte.
Implikationer i mänskliga sjukdomar
Övergående neonatal hyperparatyreos
Förlust av TRPV6 i murin placenta försämrar allvarligt Ca2 + -transport över trofoblast och minskar embryotillväxt, inducerar benförkalkning och försämrar benutveckling. Hos människor tros den otillräckliga transporten mellan modern och foster orsakad av patogena genomiska varianter av TRPV6 vara en orsak till skelettdefekter som observerats i utvalda fallrapporter av övergående neonatal hyperparatyreoidism (TNHP). Dessa varianter tros äventyra plasmamembranlokaliseringen av proteinet. Exomsekvensering av ett spädbarn med allvarlig insufficiens i bröstkorg före födseln med åtföljande fosterskelettavvikelser indikerar TRPV6s kritiska roll i maternell-fostertransport. Studien visade att sammansatta heterozygota varianter av TRPV6 resulterar i allvarlig undermineralisering och svår dysplasi i fostrets skelett.
Kronisk pankreatit
Nya bevis tyder på att naturligt förekommande TRPV6-förlust av funktionsvarianter predisponerar viss demografi för kronisk pankreatit (CP) genom att dysregulera kalciumhomeostas i pankreascellerna. Sekvensstudier bland patienter med kronisk pankreatit avslöjade närvaron av 33 missense och 2 nonsensvarianter som predisponerade japanska , tyska och franska patienter för en högre risk för CP. Sammantaget har dessa studier visat att sjukdomsinducerande genomiska varianter av TRPV6-funktionsförlust är överrepresenterade hos tyska, franska, kinesiska och japanska CP-patienter i jämförelse med kontroller i sina respektive grupper. Varianterna med förlust av funktion tros äventyra kalciumtransporten i bukspottkörteln genom att antingen sänka den totala proteinnivån och/eller äventyra Ca 2+ -upptagsaktiviteten i kanalen.
Bildning av njursten
Rollen för TRPV6 vid bildning av njursten har föreslagits genom sekvenseringsstudier utförda på en kohort av 170 patienter i Schweiz . Studierna visade att frekvensen av TRPV6 gain-of-function haplotyp är signifikant högre i Ca 2 + - stenbildare ( nefrolitiasis ) jämfört med icke-bildare. De observerade hyperkalciuri- fenotyperna från djurstudier och studier på TRPV6 singelnukleotidpolymorfismer (SNP) tyder på att TRPV6-haplotyp kan vara en viktig riskfaktor för absorptiv och renal hyperkalciuri (njursten på grund av nedsatt intestinal absorption respektive njurreabsorption). Den lägre förekomsten av njurstenssjukdomar hos afroamerikaner och en relativt högre förekomst av förfäders haplotyp antyder teori enligt vilken denna haplotyp ger en fördel med ökad Ca 2+ reabsorption i denna demografi och minskar förekomsten av njursten.
Benresorptiva sjukdomar
TRPV6 KO-möss uppvisar osteoporosliknande symtom som minskad bentäthet och hyperkalciuri. Hormonet östrogen , vars brist är kopplad till postmenopausal osteoporos , reglerar också uttrycket av TRPV6 hos människor. Faktum är att en lägre kalciumabsorption som ses hos äldre postmenopausala kvinnor tillskrivs minskad TRPV6. Den C-terminala delen av Soricidin är ett läkemedel som hämmar Ca 2+ -upptagsaktivitet genom att binda till TRPV6. Prekliniska studier av detta läkemedel har visat stort lovande vid behandling av benresorptiva sjukdomar.
Den höga graden av likhet mellan ärftliga vitamin D-resistent rakitis (HVDRR) sjukdomssymptom och observerade fenotyper i TRPV6 KO-möss har fått vissa experter att postulera patologiska samband mellan sjukdomen och TRPV6-dysfunktion. TRPV6 spelar en viktig kondroskyddande roll genom att reglera flera aspekter av kondrocytfunktion , såsom extracellulär matrixsekretion , frisättning av matrisnedbrytande enzymer, cellproliferation och apoptos . Dessutom uppvisar TRPV6 knockout-möss flera artrosfenotyper (OA) som broskflimmer , utbränning och förlust av proteoglykaner .
Pendred syndrom
Dysfunktionsgenen Slc26a4 har kopplats till Pendred syndrom – en genetisk störning som resulterar i syndromisk dövhet hos barn. Sjukdomen orsakas av mutationer som äventyrar funktionen hos det kodade proteinet pendrin - en anjon Cl - /HCO3 - utbytare uttryckt i innerörat. Förlusten av funktion i denna gen tros minska pH -värdet hos däggdjursendolymfa och försämra absorptionen av Ca 2+ via TRPV5 och TRPV6. Detta skulle i sin tur kunna förhindra upptaget av Ca 2+ och försämra den luminala minskningen av Ca 2+ -koncentrationen i örats endolymfatiska system.
Cancer
Överuttrycket av TRPV6 har validerats i tjocktarms-, bisköldkörtel- , bukspottkörtel- och sköldkörtelcancer medan dess uttryck rapporteras nedregleras i matstrupscancer , icke-småcellig lungcancer och njurcancer . TRPV6 anses vara en oncochannel som antas förmedla cancerprogression genom att trigga Ca 2+ -inträde inducerade avvikelser i molekylära drivkrafter som reglerar processer såsom cellcykel , apoptos och migration ; därigenom ger cancerceller proliferativa och överlevnadsfördelar. Överuttryck av TRPV6 korrelerar starkt med patologiskt stadium , tumörgrad , extraprostatisk invasion, lymfkörtelmetastaser och resistens mot androgeninriktade terapier vid prostatacancer . Uttrycket TRPV6 har pekats ut som en prognostisk markör för avancerad prostatacancer eftersom dess uttryck är starkt beroende av tumörens grad. Uttrycket av TRPV6 är signifikant förhöjt i bröstadenokarcinomvävnad jämfört med normal bröstvävnad. TRPV6-uttryck har rapporterats flera bröstcancercellinjer och prostatacancercellinjer. Prostatacancercellinjerna PC-3 och LnCAP överuttrycker TRPV6 i förhållande till benigna epitelceller PrEC och BPH-1. Tystnad av TRPV6 i prostatacancerceller minskar proliferationshastigheten, S-fasackumulering och uttryck av tumörmarkörprolifererande cellkärnantigen (PCNA) uttryck. TRPV6-överuttryck tros inducera avvikande Ca2 + -upptag i prostatacancerlinje och aktivera transkriptionsfaktor Nuclear Factor of Activated T-cells (NFAT).
Uttryck av TRPV6 uppregleras av östrogen, progesteron och östradiol i bröstcancercellinjen T47D . I överensstämmelse med dessa observationer östrogenreceptorantagonisten Tamoxifen TRPV6-expression i T47D-celler och undertrycker Ca 2+ -upptag av kanalen i både ER-positiva och ER - negativa bröstcancercellinjer. Överuttrycket av TRPV6 är associerat med tjocktarmscancer i tidigt stadium och dess tystnad i tjocktarmscancer inducerar apoptos och hämmar cancercellsproliferation. När det gäller mekanismer ger mutationer inom de kalmodulinbindande domänerna av TRPV6-kanaler invasiva egenskaper till kolonadenokarcinomceller. Proteinerna p38α och GADD45α tros uppreglera TRPV6-expressionssignalering i SW480-tjocktarmscancerceller genom att förbättra vitamin D-signalering. TRPV6 har rapporterats förstärka insulinliknande tillväxtfaktorer (IGF)-inducerad PI3K - PDK1 - Akt -signalering i human koloncancer och främja koloncancer.
TRPV6 är uppreglerad i primära cancervävnader från pankreascancerpatienter och främjar spridningen av pankreatiska neuroendokrina tumörer NFAT-beroende mekanismer. Tystnad av TRPV6 inducerar apoptos och cellcykelstopp i pankreascancerceller och hämmar deras invasion, proliferation och migration. Påtvingat uttryck av TRPV6 i magcancerceller ökar deras känslighet för capsaicin -inducerad apoptos medan siRNA -medierad tystnad av kanalen undertrycker denna känslighet. TRPV6-nedreglering i matstrupscancer har föreslagits vara en prognostisk markör för sjukdomsspecifik överlevnad hos patienter som lider av matstrupscancer . Lågt TRPV5- och TRPV6-samuttryck har föreslagit som prediktiva markörer för dålig överlevnad utan återfall vid icke-småcellig lungcancer .
Farmakologisk inriktning
Flera kemiska hämmare är kända för att hämma TRPV6. Några föreningar som har visat hämmande aktivitet mot TRPV6 inkluderar TH-1177, 2-Aminoetoxidifenylborat (2-APB), 2-APB-derivat 22b, Econazole , Miconazole , Piperazinderivat Cis -22a, Capsaicin , Δcannabi- tetravarigin , Cannabi- tetraponn , C Lidokain , guldburen nanopartikel (PTX-PP@Au NPs) och Sorcidin C-13 (SOR-C13) syntetisk peptid. Bland olika hämningsstrategier som testats hittills har den 13-aminosyror långa peptiden SOR-C13 visat sig mest lovande. Denna peptid med 13 aminosyror härledd från peptid med 54 aminosyror som finns i det paralytiska giftet från den nordliga kortsvansmuskakan ( Blarina brevicauda ) minskar cancertillväxt i cell- och djurmodeller. Detta anticancermedel har nyligen avslutat en klinisk säkerhetsprövning i fas I som hade inkluderat 23 patienter med avancerade solida tumörer av epitelialt ursprung som inte svarade på alla standardbehandlingar .
förordning
Regleringen av TRPV6 kan främst undersökas i samband med dess fysiologiska, hormonella och molekylära faktorer. Den hormonella regleringen av TRPV6 har karakteriserats mest omfattande. I detta avseende har dess reglering av hormonet vitamin D 3 och könshormoner undersökts i stor detalj. Gnagarstudier tyder på att TRPV6-kanalen regleras av ett brett utbud av fysiologiska faktorer som kost, ålder, kön, graviditet, amning, könshormoner, träning, ålder och kön. Vissa biologiska och farmakologiska medel som är kända för att reglera TRPV6 inkluderar glukokortikoider , immunsuppressiva läkemedel och diuretika .
Vitamin D
Flera dos-respons- och tidsförloppsexperiment i gnagare och koloncancercellinjer har definitivt visat att TRPV6-mRNA induceras robust av detta D-vitamin i extremt låga koncentrationer. Minst fem vitamin D-responselement (VDRE) i positionerna -1,2, -2,1, -3,5, -4,3 och -5,5 kb i förhållande till transkriptionsstartstället (TSS) har identifierats på TRPV6-transkript. Bland dessa fem platser är VDREs vid positionerna −1,2, −2,1 och −4,3 1,25-(OH) 2D 3 kb betydligt mer känsliga för jämfört med VDREs belägna vid −3,5 och −5,5 kb som inte verkar vara bidrar väsentligt till vitamin D-medierad transkriptionsreglering i tarmen. Mekanismmässigt initieras TRPV6-transkription som svar på vitamin D-receptor (VDR)-medierad signalering, även om andra icke-direkta mekanismer inte kan uteslutas. Viktiga steg i vitamin D-medierad transkriptionsreglering inkluderar 1) bindning av vitamin D på dess besläktade vitamin D-receptor (VDR), 2) translokation av vitamin D-receptor (VDR)-retinoid X-receptor-heterodimerkomplex i kärnan, 3 ) bindande VDR -RXR-komplex på TRPV6- genpromotorn , 4) rekrytering av steroidreceptorkoaktivator 1 och RNA-polymeras II på promotorn, och 5) transkriptionell aktivering medierad genom histon H4- acetyleringshändelser .
Diet
Nivån av Ca 2+ och vitamin D i kosten är de viktigaste regulatorerna av TRPV6-uttryck. Uttrycket av TRPV6 tros vara starkt modulerat för att finjustera Ca 2+ absorptionen från kosten, särskilt under förhållanden när dietary Ca 2+ tillgänglighet är låg. Hos gnagare inducerar begränsning av Ca 2+ tillgängligheten i kosten dramatisk uppreglering av det duodenala uttrycket av TRPV6. Kalciuminflöde från kosten och dess efterföljande bindning till calbindin-D 9k kan vara det hastighetsbegränsande steget som modulerar vitamin D-beroende reglering TRPV6. När dietary Ca 2+ är otillräcklig, bibehålls normala blodkalciumnivåer i TRPV6 KO-möss på bekostnad av ben. I många gnagarlinjer påverkar genetiska variationer i TRPV6, calbindin-D 9k , PMCA1b-mRNA intestinal Ca-absorption och dess inverkan på benmärgstätheten.
Graviditet och amning
Duodenalt uttryck av TRPV6-transkript är uppreglerat i WT- och VDR KO-möss under graviditet och amning . Hormonet prolaktin uppreglerar TRPV6-transkriptionen och underlättar en ökning av intestinal Ca 2+ -absorption hos lakterande och dräktiga råttor, möjligen som en adaptiv mekanism för att övervinna förlusten av benmineraliseringsinnehåll under laktation.
Åldrande
Det intestinala uttrycket av TRPV6 hos möss varierar dramatiskt beroende på ålder och relativ vävnadsplats. Det duodenala uttrycket av TRPV6 är odetekterbart vid P1 och ökar 6 gånger när möss åldras till P14. På liknande sätt varierar uttrycket också med åldern i jejunum, där TRPV6-nivåerna ökar från P1 till P14, blir svaga vid 1 månads ålder och blir oupptäckbara hos äldre möss. Uttrycket av TRPV6 hos äldre råttor (12 månader) är minst 50 % lägre jämfört med yngre motsvarigheter (2 månader gamla). åtföljs den åldersrelaterade nedgången i tarmabsorptionen av Ca 2+ av en minskning av duodenalt uttryck av TRPV6.
Könshormoner
Könshormoner spelar en viktig roll i regleringen av TRPV6. Jämfört med hanmöss uppvisar honmöss en 2 gånger högre ökning av duodenalt uttryck av TRPV6 mRNA efter D-vitaminbehandling. Könshormonassocierad differentiell reglering av TRPV6 över kön tros vara korrelerad till skillnader i relativ risk för osteoporos hos äldre postmenopausala kvinnor som har rapporterats ha lägre TRPV6- och VDR-uttryck i jämförelse med män.
Östrogenbehandling uppreglerar TRPV6-transkript 8-faldigt i VDR KO-möss och 4-faldigt i ovarieektomiserade möss. Mer än 50 % minskning av TRPV6 mRNA har observerats i östrogenreceptor α KO möss. Man tror att östrogen kan differentiellt reglera Ca2 + -absorption i tolvfingertarmen genom att öka TRPV6-uttrycket genom ERa. Antiprogesteronmedlet RU486 och antiöstrogenmedlet ICI 182 780 undertrycker TRPV6-uttryck hos gnagare genom deras respektive antagonistiska verkan på progesteron- och östrogenreceptorer . Östrogen, progesteron och dexametason är kända för att uppreglera TRPV6-uttryck i hjärnbarken och hypotalamus hos möss, vilket tyder på en potentiell involvering av TRPV6 i kalciumabsorption i hjärnan .
Glukokortikoider
Subkutan administrering av glukokortikoider dexametason inducerar både renalt och intestinalt uttryck av TRPV6 hos möss inom 24 timmar, medan oral applicering av prednisolon minskar TRPV6, vilket också åtföljs av minskad Ca2 + -absorption i duodenum. Tarmreglering av TRPV6 som svar på glukokortikoider verkar vara VDR-beroende. Enzymet serum och glukokortikoidreglerat kinas 1 ( SKG1 ) reglerar TRPV6-uttryck genom att förstärka fosfatidylinositol-3-fosfat-5-kinas PIKfyve (PIP5K3). Detta kinas är avgörande för genereringen av sekundär budbärare PIP2, en känd lipidaktivator av TRPV6.
- TRPV
- TRPV5
- kalciumkanaler
- kalciumabsorption
- transcellulär väg
- grindmekanism
- kalmodulin
- maternell-foster transport
- övergående neonatal hyperparatyreos
- kronisk pankreatit
- njursten
- cancer
Anteckningar
Vidare läsning
- Heiner I, Eisfeld J, Lückhoff A (2004). "Roll och reglering av TRP-kanaler i neutrofila granulocyter". Cellkalcium . 33 (5–6): 533–40. doi : 10.1016/S0143-4160(03)00058-7 . PMID 12765698 .
- Clapham DE, Julius D, Montell C, Schultz G (december 2005). "International Union of Pharmacology. XLIX. Nomenklatur och struktur-funktionsrelationer av transienta receptorpotentialkanaler". Farmakologiska recensioner . 57 (4): 427–50. doi : 10.1124/pr.57.4.6 . PMID 16382100 . S2CID 17936350 .
- Wissenbach U, Niemeyer BA (2007). "TRPV6". Transient Receptor Potential (TRP)-kanaler . Handbok i experimentell farmakologi. Vol. 179. s. 221–34. doi : 10.1007/978-3-540-34891-7_13 . ISBN 978-3-540-34889-4 . PMID 17217060 .
- Schoeber JP, Hoenderop JG, Bindels RJ (februari 2007). "Samordnad verkan av associerade proteiner i regleringen av TRPV5 och TRPV6". Transaktioner i det biokemiska samhället . 35 (Pt 1): 115–9. doi : 10.1042/BST0350115 . PMID 17233615 .
externa länkar
- TRPV+Cation+Channels vid US National Library of Medicine Medical Subject Headings (MeSH)
- TRPV6+protein,+human vid US National Library of Medicine Medical Subject Headings (MeSH)





