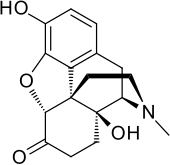
Oxymorfon
 | |
 | |
| Kliniska data | |
|---|---|
| Handelsnamn | Numorphan, Numorphone, Opana, andra |
| Andra namn | 14-hydroxidihydromorfinon |
| AHFS / Drugs.com | Monografi |
| MedlinePlus | a610022 |
| Licensdata |
|
Administreringsvägar _ |
Genom munnen , buckal, sublingual, intranasal, intravenös, epidural, subkutan, intramuskulär |
| ATC-kod | |
| Rättslig status | |
| Rättslig status | |
| Farmakokinetiska data | |
| Biotillgänglighet |
genom munnen: 10% Buccal: 28% Sublingual: 37,5% Intranasal: 43% IV, IM & IT: 100% |
| Proteinbindning | 10 % |
| Ämnesomsättning | Lever ( CYP3A4 , glukuronidering ) |
| Eliminationshalveringstid _ | 7–9 timmar Verkningslängd: 6–8 timmar oralt, 4–6 timmar parenteralt. |
| Exkretion | Urin, avföring |
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard | 100.000.873 |
| Kemiska och fysikaliska data | |
| Formel | C17H19NO4 _ _ _ _ _ _ |
| Molar massa | 301,342 g·mol -1 |
| 3D-modell ( JSmol ) | |
| |
| |
Oxymorphone ( säljs bland annat under varumärkena Numorphan och Opana ) är ett mycket potent opioidanalgetikum indicerat för behandling av svår smärta. Smärtlindring efter injektion börjar efter cirka 5–10 minuter, efter oral administrering börjar den efter cirka 30 minuter och varar cirka 3–4 timmar för tabletter med omedelbar frisättning och 12 timmar för tabletter med förlängd frisättning. Elimineringshalveringstiden för oxymorfon är mycket snabbare intravenöst, och som sådan används läkemedlet oftast oralt. Liksom oxykodon , som metaboliseras till oxymorfon, har oxymorfon stor potential att missbrukas.
Den utvecklades i Tyskland 1914. Den patenterades 1955 och godkändes för medicinsk användning 1959. I juni 2017 bad FDA Endo Pharmaceuticals att ta bort sin produkt från den amerikanska marknaden. Detta berodde delvis på opioidepidemin i USA, och det faktum att en omformulering 2012 misslyckades med att stoppa olaglig injektion av drogen. Endo svarade med att frivilligt ta bort Opana ER från marknaden en månad senare. Generiska versioner av oximorfon med utökad frisättning, som de som tillverkas av Amneal Pharmaceuticals , finns fortfarande tillgängliga i USA.
Medicinsk användning
Oxymorphone Immediate Release är indicerat för lindring av måttlig till svår smärta, såsom behandling av akut postkirurgisk smärta. För all kronisk behandling av smärta bör läkare endast överväga långtidsanvändning om det finns betydande kliniska fördelar för patientens behandling som uppväger alla potentiella risker. De första linjens behandlingsval för kronisk smärta är icke-farmakologiska och icke-opioida medel.
Oxymorphone tabletter med förlängd frisättning är indicerade för behandling av kronisk smärta och endast för personer som redan har ett regelbundet schema med starka opioider under en längre period. Oxymorfontabletter med omedelbar frisättning rekommenderas för genombrottssmärta för personer på versionen med förlängd frisättning. Jämfört med andra opioider har oxymorfon liknande smärtlindrande effekt.
I USA är det ett schema II-kontrollerat ämne med ett ACSCN på 9652.
Oxymorphone ER Tabletter ska tas på fastande mage.
Tillgänglighet
Varumärken och former
Oxymorphone marknadsförs av en enda varumärkestillverkare, Endo Pharmaceuticals, under varumärkena Opana och Opana ER. Opana ER drogs tillbaka av tillverkaren 2017, vilket gjorde den otillgänglig i USA. Men både IR (omedelbar frisättning) och ER (extended release) formuleringar är tillgängliga under det generiska namnet Oxymorphone och Oxymorphone ER, tillhandahållna av en mängd olika laboratorier.
Oxymorfon finns också som en injicerbar för slutenvård, tillgänglig för IV ( intravenös ), IM ( intramuskulär ) och SC ( subkutan ) injektion.
doseringsform med modifierad frisättning med förlängd frisättning (ER) används vanligtvis, vilket modifierar läkemedlets farmakokinetik .
Orala doseringsformer
Oxymorfon kommer i en mängd olika doser.
| IR surfplatta | ER 12 timmars tablett |
|---|---|
| 5 mg | 5 mg |
| 10 mg | 7,5 mg |
| 10 mg | |
| 15 mg | |
| 20 mg | |
| 30 mg | |
| 40 mg |
Särskilda populationer
Patienter som redan lider av invaliditet löper en mycket högre risk för andningsdepression. Nonopioida analgetika bör övervägas i denna population.
Äldre patienter är mycket mer känsliga för biverkningar, såsom fall, kognitiv svikt och förstoppning, och bör övervakas för sådana. Nedsatt njurfunktion i samband med åldrande leder till minskat clearance av läkemedlet, vilket resulterar i smala terapeutiska fönster och ökar risken för överdosering. Om oxymorfon är absolut indicerat, bör mindre initialdoser påbörjas för denna population.
Det finns en risk för neonatala abstinenssymptom hos den nyfödda om gravida kvinnor tar oxymorfon under en längre period. Oxymorfon passerar placentan och innebär risk för fosterskador, dålig fostertillväxt, dödfödsel och för tidig förlossning. Barn till mammor som är fysiskt beroende av oxymorfon har en högre risk för liknande beroende. På grund av dessa allvarliga risker är oxymorfon starkt avskräckt bland denna befolkning. Mängden överföring av oxymorfon till bröstmjölken är inte känd och kvinnor uppmanas att väga riskerna och fördelarna innan de ammar medan de tar denna medicin.
Bieffekter
De huvudsakliga biverkningarna av oxymorfon liknar andra opioider med förstoppning, illamående, kräkningar, yrsel, muntorrhet och dåsighet som de vanligaste biverkningarna. Detta läkemedel är mycket beroendeframkallande som med andra opioider och kan leda till kemiskt beroende och abstinens.
Överdos
svaghet i skelettmuskeln, kall och fuktig hud och ibland långsam hjärtfrekvens och lågt blodtryck . I ett allvarligt fall av överdosering apné , cirkulationskollaps , hjärtstillestånd och dödsfall inträffa.
Farmakologi
Farmakodynamik
Oxymorfon framkallar dess effekter genom att binda till och aktivera μ-opioidreceptorn (MOR) och, i mycket mindre utsträckning, δ-opioidreceptorn (DOR) och κ-opioidreceptorn (KOR). Dess verksamhet vid DOR kan förstärka dess verksamhet vid MOR. Oxymorfon är 10 gånger mer potent än morfin. Beräkningen av relativ styrka indikerade att 1 mg oximorfonhydroklorid motsvarade 9,85 mg morfinsulfat, eller 1,02 mg oximorfonhydroklorid motsvarade 10 mg morfinsulfat.
| Affiniteter ( K i ) | Förhållande | ||
|---|---|---|---|
| MOR | DOR | KOR | MOR:DOR:KOR |
| 0,78 nM | 50 nM | 137 nM | 1:64:176 |
| Förening | Rutt | Dos |
|---|---|---|
| Kodein | PO | 200 mg |
| Hydrokodon | PO | 20–30 mg |
| Hydromorfon | PO | 7,5 mg |
| Hydromorfon | IV | 1,5 mg |
| Morfin | PO | 30 mg |
| Oxikodon | IV | 20 mg |
| Morfin | IV | 10 mg |
| Oxikodon | PO | 20 mg |
| Oxymorfon | PO | 7–10 mg |
| Oxymorfon | IV | 1 mg |
Farmakokinetik
Kemi
Oxymorfon tillverkas kommersiellt av thebaine , som är en mindre beståndsdel av opiumvallmo ( Papaver somniferum ) men thebaine finns i större överflöd (3 %) i rötter av orientalisk vallmo ( Papaver orientale ). Tyska patent från mitten av 1930-talet indikerar att oximorfon såväl som hydromorfon , hydrokodon , oxikodon och acetylmorfon kan framställas – utan behov av vätgas – från lösningar av kodein , morfin och dionin genom att återloppskoka en sur vattenlösning, eller prekursorläkemedel löst i etanol , i närvaro av vissa metaller, nämligen palladium och platina i fint pulver eller kolloidal form eller platinasvart.
Oxymorfonhydroklorid förekommer som luktfria vita kristaller eller vitt till benvitt pulver. Den mörknar i färgen med långvarig exponering för ljus. Ett gram oximorfonhydroklorid är lösligt i 4 ml vatten och det är svårlösligt i alkohol och eter. Det bryts ned vid kontakt med ljus.
Oxymorfon kan acetyleras som morfin, hydromorfon och vissa andra opioider. Mono-, di-, tri- och tetraestrar av oximorfon utvecklades på 1930-talet men används inte i medicin vid denna tid. Förmodligen kan andra estrar såsom nikotinyl, bensoyl, formyl, cinnimoyl etc. framställas. [ citat behövs ]
2013 års amerikanska DEA :s årliga tillverkningskvoter var 18 375 kg för konvertering (ett antal läkemedel kan tillverkas av oxymorfon, både smärtstillande medel och opioidantagonister som naloxon ) och 6875 kg för direkt tillverkning av slutprodukter. Oxymorfon är också en mindre metabolit av oxikodon , som bildas av CYP2D6 -medierad O-demetylering.
Historia
Oxymorphone utvecklades först i Tyskland 1914 och patenterades i USA av Endo Pharmaceuticals 1955. Den introducerades i USA i januari 1959 och andra länder ungefär samtidigt.
Samhälle och kultur
Märkesnamn
- Numorphan (suppositorium och injicerbar lösning)
- Opana ER (tablet med utökad frisättning): Begäran om borttagning från FDA i juni 2017 på grund av antalet intravenös missbruk.
- Opana IR (tablett med omedelbar frisättning)
- O-Morphon i Bangladesh av Ziska pharmaceutical ltd.
Varunamnet Numorphan är härlett i analogi med Nucodan-namnet för en oxikodonprodukt (eller vice versa) samt Paramorphan/Paramorfan för dihydromorfin och Paracodin ( dihydrokodein ). Det enda kommersiellt tillgängliga saltet av oximorfon i större delen av världen vid denna tidpunkt är hydrokloriden, som har en fri basomvandlingsförhållande på 0,891, och oximorfonhydrokloridmonohydrat har en faktor på 0,85.
Generiska pillermärkningar är ATV10/APO; HK10 (10 mg) avlång vit och ATV20/APO; HK20 (20 mg) avlång vit. [ citat behövs ]
Missbruk
År 1924 hade USA:s kongress förbjudit försäljning, import eller tillverkning av heroin , en annan opioid smärtstillande medicin i Anti-Heroin Act från 1924 .
Under de senaste 30 åren [ när? ] , har missbruk av opioiddroger varit ett utbrett folkhälsoproblem. På senare år [ när? ] har detta problem utvecklats till en fullfjädrad epidemi och leder till flera andra folkhälsoproblem, inklusive spridningen av sjukdomar som hepatit C och humant immunbristvirus (HIV).
I USA, från och med 2013, missbrukade mer än 12 miljoner människor opioiddroger minst en gång om året. Under 2010 var 16 652 dödsfall relaterade till opiatöverdos, 2015 ökade detta antal till 33 091. I september 2013 krävde nya FDA-märkningsriktlinjer för långverkande opioider och opioider med förlängd frisättning att tillverkarna skulle ta bort måttlig smärta som användningsindikation, och reservera läkemedlet för "smärta som är tillräckligt allvarlig för att kräva daglig, dygnet runt, långvarig opioidbehandling Men det hindrade inte läkare från att förskriva opioider för måttlig, "efter behov" användning.
I januari 2013 rapporterade Centers for Disease Control and Prevention (CDC) en sjukdom associerad med intravenös (IV) missbruk av oral Opana ER (oxymorfon) i Tennessee. Syndromet liknade det för trombotisk trombocytopen purpura (TTP). Initial terapi inkluderade terapeutiskt plasmautbyte , som för TTP. Till skillnad från TTP hittades ingen bristfällig ADAMTS13- aktivitet eller anti-ADAMTS13-antikropp, vilket tyder på en trombotisk mikroangiopati av olika bakomliggande orsaker. Om IV Opana-missbruk erkänns kan stödbehandling istället för terapeutiskt plasmautbyte övervägas.
I januari 2015 identifierades det första hiv-utbrottet kopplat till missbruk av receptbelagda opioider av Indiana State Department of Health (ISDH), i det lilla lantliga samhället Scott County i sydöstra Indiana. ISDH startade en undersökning av detta hiv-utbrott när 11 individer bekräftades positiva för hiv med band som spårade tillbaka till samma samhälle. Tre månader in i denna undersökning diagnostiserade ISDH totalt 135 personer med hiv, och antalet ökar fortfarande. Orsaken till detta utbrott har kopplats till delning av nålar mellan opioidmissbrukare, vilket i vissa fall innebär att de delar nålar med upp till nio olika partners.
I slutet av mars 2015 indikerade rapporter att Austin, Indiana , var centrum för ett utbrott av HIV orsakat av oxymorfonanvändning som en injicerbar rekreationsdrog. Utbrottet krävde akuta åtgärder från statliga tjänstemän. NPR-podden "inbäddade" avsnitt av den 31 mars 2016 var en djupgående redogörelse för ett besök hos oxymorfonmissbrukare i Austin, Indiana. Under 2016 rapporterades gatupriset för oxymorfon vara 140 $.
Den vanliga opioiden för missbruk i detta utbrott har identifierats som Opana ER, en tidsutgiven smärtstillande oxymorfon som är formulerad för att vara resistent mot krossning, tillverkad av Endo Pharmaceuticals. Denna svårare att krossa formulering sattes i produktion 2012 i ett försök att minska risken för missbruk från att frusta det krossade pillret. Men opioidmissbrukare kringgick detta problem genom att hitta ett sätt att lösa upp och injicera drogen.
Omfattningen av detta utbrott har fått uppmärksamhet från både CDC och FDA. CDC inledde en större utredning av alla sjukdomsutbrott som involverar Opana ER, med fokus på förekomsten av trombotisk trombocytopenisk purpura (TTP)-liknande sjukdom i Tennessee-utbrottet 2012, såväl som 2015 års HIV-utbrott i Indiana. FDA lanserade en säkerhetsstudie efter marknadsföring angående omformuleringen av Opana ER 2012 och staten Indiana hjälpte till att finansiera ytterligare en studie som undersökte sambandet mellan HIV-infektion och injektionsanvändning av oxymorfon i Indiana från 2014 till 2015.
Resultaten av dessa studier visade att omformuleringen av Opana till en svår att krossa tablett oavsiktligt ökade risken för överföring av förvärvade blodburna infektioner eftersom opioidmissbrukare bytte från att använda läkemedlet via näsan till injektion. Denna epidemi gjorde att risken för att få en blodburen infektion vid användning av injicerbara opioider ökade jämfört med risken för att få en infektion vid användning av injicerbart heroin eller kokain.
I juni 2017, inför folkhälsokrisen, opioidepidemin, bad FDA Endo Pharmaceuticals att "ta bort sin opioidsmärtmedicin, omformulerad Opana ER (oxymorfonhydroklorid), från marknaden". I sitt pressmeddelande den 8 juni 2017 noterade de också att detta var första gången som FDA hade vidtagit åtgärder för att "ta bort en för närvarande marknadsförd opioidsmärtmedicin från försäljning på grund av folkhälsokonsekvenserna av missbruk." Senast den 6 juli 2017 efterkom Endo International frivilligt FDA:s begäran om borttagning.
Se även
![]() Media relaterade till Oxymorphone på Wikimedia Commons
Media relaterade till Oxymorphone på Wikimedia Commons