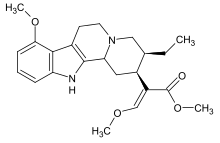
Mitragynin
 | |
 | |
| Rättslig status | |
|---|---|
| Rättslig status |
|
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Kemiska och fysikaliska data | |
| Formel | C23H30N2O4 _ _ _ _ _ _ _ |
| Molar massa | 398,503 g·mol -1 |
| 3D-modell ( JSmol ) | |
| Smältpunkt | 102–106 °C |
| |
| |
Mitragynin är en indolbaserad alkaloid och den vanligaste aktiva alkaloiden i den sydostasiatiska växten Mitragyna speciosa , allmänt känd som kratom . Den totala alkaloidkoncentrationen i torkade löv varierar från 0,5 till 1,5%. I thailändska varianter är mitragynin den vanligaste komponenten (upp till 66 % av det totala antalet alkaloider) medan 7-hydroximitragynin är en mindre beståndsdel (upp till 2 % av det totala alkaloidinnehållet). I malaysiska kratomvarianter finns mitragynin i lägre koncentration (12% av totala alkaloider). Sådana preparat konsumeras oralt och involverar vanligtvis torkade kratomblad som bryggs till te eller mals och placeras i kapslar. Mitragyninkonsumtion för medicinska och rekreationsändamål går tillbaka århundraden, även om tidig användning främst var begränsad till sydostasiatiska länder som Indonesien och Thailand där växten växer inhemskt. Nyligen har användningen av mitragynin spridit sig över hela Europa och Amerika som både en rekreations- och medicinsk drog. Medan forskning om effekterna av kratom har börjat dyka upp, är undersökningar av den aktiva substansen mitragynin mindre vanliga.
Används
Medicinsk
I april 2019 hade United States Food and Drug Administration (FDA) uttalat att det inte fanns några godkända kliniska användningsområden för kratom, och att det inte fanns några bevis för att kratom var säkert eller effektivt för att behandla något tillstånd. Detta upprepade slutsatsen från en tidigare rapport från European Monitoring Centre for Drugs and Drug Addiction (ECNN): Från och med 2015 hade kratom inte godkänts för någon medicinsk användning. Från och med 2018 hade FDA särskilt noterat att det inte hade gjorts några kliniska prövningar för att studera säkerhet och effekt av kratom vid behandling av opioidberoende. Från och med 2013 hade USA:s Drug Enforcement Administration också uttalat: "Det finns ingen legitim medicinsk användning av kratom".
Etnofarmakologi
Antinociception
Mitragynin-innehållande kratomextrakt, med deras åtföljande mängd alkaloider och andra naturliga produkter , har använts för deras upplevda smärtlindrande (dvs antinociception) egenskaper i minst ett sekel. I Sydostasien är konsumtionen av mitragynin från hela löv kratompreparat vanligt bland arbetare som rapporterar att de använder kratoms milda stimulerande och upplevda antinociceptiva egenskaper för att öka uthålligheten och lindra smärta under arbetet. I en laboratoriestudie i en råttmodell 2016, gav alkaloidinnehållande extrakt av kratom bevis för att inducera naloxon -reversibla antinociceptiva effekter i kokplatta och svanssnärtningstest till en nivå som är jämförbar med oxikodon .
Kronisk smärta
Kratom används ofta i USA som självbehandling för smärta och abstinens av opioid. En genomgång av befintlig litteratur från 2019 antydde potentialen hos kratom som substitutionsterapi för kronisk smärta.
Opioidabstinens
Redan på 1800-talet användes mitragynin som intagits via kratomblad för behandling av opiumberoende och abstinens. Från och med 2018, genomgång av psykiska hälsoaspekter av kratomanvändning nämner opioidersättning och abstinens som en primär motivation för kratomanvändning: nästan 50 % av de cirka 8 000 kratomanvändarna som undersöktes i en studie indikerade kratomanvändning som resulterade i minskad eller avbruten användning av opioider . Vissa djurmodeller av opioidabstinenser tyder på att mitragynin kan undertrycka och förbättra abstinens från andra opioidagonister, t.ex. efter kronisk administrering av morfin i zebrafiskar .
Rekreation
Mitragynin och dess metabolit 7-hydroxymitragynin tros ligga bakom effekterna av kratom. Konsumtion av torkade kratomblad ger olika svar beroende på den konsumerade dosen. Vid låga doser rapporteras växten inducera en mild stimulerande effekt, medan större doser rapporteras ge sedering och antinociception typiska för opioider. Koncentrationen av mitragynin och andra alkaloider i kratom har visat sig variera mellan olika stammar av växten, vilket också indikerar stamspecifika effekter från konsumtion. Kratomextrakt blandas ofta med andra lättillgängliga psykoaktiva föreningar – sådana som finns i receptfria hostmediciner – för att förstärka effekterna av de koncentrerade nivåerna av mitragynin. Skadliga effekter förknippade med konsumtion av preparat som innehåller mitragynin från M. speciosa inkluderar en negativ inverkan på kognition; dessutom har risken för missbruk av mitragynin och relaterade alkaloider dokumenterats i djurstudier, inklusive genom användningen av testet för betingad platspreferens (CPP), som indikerade en distinkt belöningseffekt för 7-hydroximitragynin.
Beroende och uttag
På grund av dess aktivitet på opioidreceptorer kan mitragynin i sig leda till beroende och leda till abstinenssymtom när behandlingen avbryts. Regelbundna användare rapporterar abstinenssymtom som är jämförbara med andra opioider efter utsättningen av kratom. En studie . från 2014 som inkluderade 1118 manliga kratomanvändare visade att mer än hälften av de vanliga användarna (67% av det totala antalet försökspersoner) upplevde abstinens när de försökte avbryta kratom med symtom som inkluderade smärta, muskelspasmer och sömnlöshet I en studie som följde 239 manliga kratomanvändare i Malaysia som konsumerade mellan 40 och 240 mg mitragynin per dag, angav 89 % ett tidigare försök att avbryta kratomkonsumtionen vilket resulterade i abstinenssymtom som sträckte sig från milda (65 % av försökspersonerna) till måttliga/svåra ( 35 % av försökspersonerna). I samma studie varierade abstinenssymptom från fysiska symtom som illamående, diarré och muskelspasmer till psykologiska symtom som rastlöshet, ångest och ilska men varade mindre än 3 dagar för de flesta försökspersoner. Resultaten från denna studie kan dock fördunklas av enstaka tillsatser av andra substanser i mitragyninpreparatet såsom dextrometorfan och bensodiazepiner , vilket kan bidra till abstinenssymptomen. I en djurstudie observerades mitragyninabstinenssymtom efter 14 dagars mitragynin ip-injektioner på möss och inkluderade uppvisningar av ångest, tandklappning och piloerektion , vilka alla är karakteristiska tecken på opioidabstinenser hos möss och är jämförbara med morfinabstinenssymtom.
Farmakologi
Farmakodynamik
Mitragynin verkar på en mängd olika receptorer i CNS , framför allt mu- , delta- och kappa -opioidreceptorerna . Naturen av mitragynines interaktion med opioidreceptorer har ännu inte klassificerats fullständigt med vissa rapporter som tyder på partiell agonistaktivitet vid mu-opioidreceptorn och andra tyder på full agonistaktivitet . Dessutom är mitragynin känt för att interagera med delta- och kappa- opioidreceptorer också, men dessa interaktioner förblir tvetydiga med vissa rapporter som indikerar mitragynin som en delta- och kappa- konkurrerande antagonist och andra som en fullständig agonist av dessa receptorer. I båda fallen rapporteras mitragynin ha lägre affinitet till delta- och kappa-receptorer jämfört med mu-receptorer. Mitragynin är också känt för att interagera med dopamin D2 , adenosin , serotonin och alfa-2 adrenerga receptorer, även om betydelsen av dessa interaktioner inte är helt klarlagd. Dessutom indikerar flera rapporter om mitragynin-farmakologi potentiell partisk agonismaktivitet som gynnar signalvägar för G-protein oberoende av beta-arrestin- rekrytering, vilket ursprungligen ansågs vara en primär komponent för att minska opioidinducerad andningsdepression . Emellertid tyder nya bevis på att låg inneboende effekt vid mu-opioidreceptorn är ansvarig för den förbättrade biverkningsprofilen för mitragynin, i motsats till G-proteinbias.
Farmakokinetik

Farmakokinetisk analys har till stor del skett i levande gnagare samt gnagare och mänskliga mikrosomer . På grund av heterogeniteten i analys och bristen på mänskliga experiment som hittills genomförts är den farmakokinetiska profilen för mitragynin inte fullständig. Inledande farmakokinetiska studier på människor har emellertid gett preliminär information. I en studie av 10 friska frivilliga som tog oralt administrerat mitragynin från helbladspreparat, verkade mitragynin ha en mycket längre halveringstid än typiska opioidagonister (7–39 timmar) och nådde maximal plasmakoncentration inom 1 timme efter administrering.
Ämnesomsättning

| CYP | 1A2 | 3A4 | 2D6 |
|---|---|---|---|
| IC 50 (ug/ml) | 39 (6) | 0,78 (6) | 3,6 (3) , 0,636 (6) |
Mitragynin metaboliseras primärt i levern och producerar många metaboliter under både fas I och fas II.
Fas I
Under fas I-metabolism genomgår mitragynin hydrolys av metylestergruppen på C16 såväl som o-demetylering av båda metoxigrupperna på positionerna 9 och 17. Efter detta steg omvandlar oxidations- och reduktionsreaktioner aldehydintermediärer till alkoholer och karboxylsyror . P450-metaboliska enzymer är kända för att underlätta fas I-metabolismen av mitragynin, vilket enligt uppgift har en hämmande effekt på flera P450-enzymer, vilket ökar risken för ogynnsamma läkemedelsinteraktioner.
Fas II
Under fas II-metabolism genomgår fas I-metaboliter glukuronidering och sulfatering för att bilda multipla glukuronid- och sulfatkonjugat, som sedan utsöndras via urin.
Toxikologi
Mitragynintoxicitet hos människor är i stort sett okänd eftersom studier som undersöker mitragynintoxicitet hittills har använt djur som verkar ha signifikanta artspecifika skillnader i mitragynintolerans. Mitragynintoxicitet hos människor rapporteras dock sällan även om specifika exempel på kramper och levertoxicitet hos kratomkonsumenter har rapporterats. På grund av P450- enzymhämning utgör kombinationen av mitragynin med andra läkemedel ett stort problem när det gäller biverkningar av mitragynin. Som sådan tenderar dödsfall som involverar mitragynin att involvera ytterligare läkemedel inklusive andra opioider och hostdämpande medel. Post mortem toxikologiska skärmar indikerar ett brett spektrum av mitragynin blodkoncentrationer från 10mcg/L till 4800mcg/L, vilket gör det svårt att beräkna vad som utgör en toxisk dos. Sådana variationer i blodkoncentrationer föreslås bero på skillnader i de toxikologiska analyser som används och hur lång tid efter överdosering analyserna utfördes.
Laglighet
I USA är kratom och dess aktiva ingredienser inte schemalagda enligt DEA:s riktlinjer . Trots den nuvarande juridiska statusen för anläggningen och dess beståndsdelar har kratoms laglighet varit turbulent de senaste åren. I augusti 2016 utfärdade DEA en avsiktsrapport om att mitragynin och 7-hydroximitragynin skulle genomgå nödschemaläggning och placeras under schema 1 -klassificering tills vidare, vilket gör kratom strikt olagligt och därmed hindrar forskning om dess aktiva beståndsdelar. Efter denna rapport mötte DEA betydande offentligt och administrativt motstånd i form av en från Vita huset undertecknad av 140 000 medborgare och ett brev till DEA:s administratör med stöd av 51 ledamöter av representanthuset som motsatte sig den föreslagna schemaläggningen. Denna opposition ledde till att DEA drog tillbaka sin avsiktsrapport i oktober 2016, vilket möjliggjorde obehindrad forskning om de potentiella fördelarna och hälsoriskerna förknippade med mitragynin och andra alkaloider i kratomväxten. Kratom och dess aktiva beståndsdelar är oplanerade och säljs lagligt i butiker och online i USA med undantag för ett litet antal delstater. Från och med juni 2019 FDA att varna konsumenter för att inte använda Kratom , samtidigt som de förespråkar mer forskning för en bättre förståelse av Kratoms säkerhetsprofil.
Forskningsbegränsningar
Inkonsekvenser i dosering, renhet och samtidig droganvändning gör det svårt att utvärdera effekterna av mitragynin hos människor. Omvänt kontrollerar djurstudier för sådan variation men erbjuder begränsad översättbar information som är relevant för människor. Bortsett från experimentella begränsningar har mitragynin visat sig interagera med en mängd olika receptorer, även om naturen och omfattningen av receptorinteraktioner ännu inte helt har karakteriserats. Dessutom har toxiciteten av mitragynin och associerade kratomalkaloider ännu inte helt fastställts hos människor, och inte heller risken för överdosering. Fler studier är nödvändiga för att bedöma säkerhet och potentiell terapeutisk användbarhet.
