Valdecoxib
 | |
 | |
| Kliniska data | |
|---|---|
| Handelsnamn | Bextra |
Graviditetskategori _ |
|
Administreringsvägar _ |
Oral |
| ATC-kod | |
| Rättslig status | |
| Rättslig status | |
| Farmakokinetiska data | |
| Biotillgänglighet | 83 % |
| Proteinbindning | 98 % |
| Ämnesomsättning | Lever ( CYP3A4 och 2C9 involverade) |
| Eliminationshalveringstid _ | 8 till 11 timmar |
| Exkretion | Njur |
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard | 100.229.918 |
| Kemiska och fysikaliska data | |
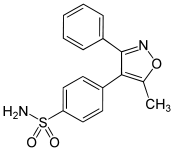
| Formel | C16H14N2O3S _ _ _ _ _ _ _ _ |
| Molar massa | 314,36 g·mol -1 |
| 3D-modell ( JSmol ) | |
| |
| |
|
| |
Valdecoxib är ett icke-steroidalt antiinflammatoriskt läkemedel (NSAID) som används vid behandling av artros , reumatoid artrit och smärtsamma menstruationer och menstruationssymtom. Det är en selektiv cyklooxygenas-2-hämmare . Den patenterades 1995.
Valdecoxib tillverkades och marknadsfördes under varumärket Bextra av GD Searle & Company som ett antiinflammatoriskt läkemedel mot artrit. Det godkändes av United States Food and Drug Administration den 20 november 2001 för att behandla artrit och mensvärk. och fanns tillgängligt på recept i tablettform fram till 2005 då FDA begärde att Pfizer skulle dra tillbaka Bextra från den amerikanska marknaden. FDA citerade "potentiell ökad risk för allvarliga kardiovaskulära (CV) biverkningar", en "ökad risk för allvarliga hudreaktioner" och "det faktum att Bextra inte har visat sig erbjuda några unika fördelar jämfört med andra tillgängliga NSAID."
2009 stod Bextra i centrum för den "största uppgörelsen om bedrägeri inom hälsovården och den största straffrättsliga böterna av något slag någonsin." Pfizer betalade 2,3 miljarder $ civila och straffrättsliga böter. Pharmacia & Upjohn , ett Pfizer-dotterbolag, bröt mot USA:s Food, Drug and Cosmetic Act för att ha missmärkt Bextra "med avsikt att lura eller vilseleda."
En vattenlöslig och injicerbar prodrug av valdecoxib, parecoxib, marknadsförs i Europeiska unionen under varumärket Dynastat.
Används till 2005
I USA godkände Food and Drug Administration (FDA) valdecoxib för behandling av artros , reumatoid artrit hos vuxna och primär dysmenorré .
Valdecoxib användes även off-label för att kontrollera akut smärta och olika typer av kirurgisk smärta.
Biverkningar och tillbakadragande från marknaden
Den 7 april 2005 drog Pfizer tillbaka Bextra från den amerikanska marknaden på rekommendation av FDA, med hänvisning till en ökad risk för hjärtinfarkt och stroke och även risken för en allvarlig, ibland dödlig, hudreaktion. Detta var ett resultat av den senaste tidens uppmärksamhet på receptbelagda NSAIDs , såsom Mercks Vioxx . Andra rapporterade biverkningar var angina och Stevens-Johnsons syndrom .
Pfizer erkände första gången kardiovaskulära risker förknippade med Bextra i oktober 2004. American Heart Association presenterades kort därefter för en rapport som visar att patienter som använder Bextra när de återhämtade sig från hjärtoperationer löpte 2,19 gånger större risk att drabbas av stroke eller hjärtinfarkt än de som fick placebo .
I en stor studie publicerad i The Journal of the American Medical Association 2006, verkade valdecoxib mindre negativt för njursjukdom och hjärtarytmi jämfört med Vioxx, men förhöjda njurrisker antyddes något.
2009 års uppgörelse för kampanjer för off-label användningar
Den 2 september 2009 bötfällde det amerikanska justitiedepartementet Pfizer med 2,3 miljarder dollar efter att ett av dess dotterbolag , Pharmacia & Upjohn Company, erkänt sig skyldiga till att ha marknadsfört fyra läkemedel inklusive Bextra "i avsikt att lura eller vilseleda". Pharmacia & Upjohn erkände brottsligt beteende i marknadsföringen av Bextra och gick med på att betala de största straffrättsliga böterna som någonsin utdömts i USA oavsett ärende, 1,195 miljarder dollar. En före detta försäljningschef i Pfizer-distriktet åtalades och dömdes till hemvist för att ha förstört dokument angående den illegala marknadsföringen av Bextra. Dessutom erkände en regionchef sig skyldig till distribution av en felmärkt produkt och bötfälldes 75 000 USD och 24 månader på villkorlig dom.
De återstående 1 miljard dollar av böterna betalades för att lösa anklagelser enligt det civila fallet False Claims Act och är den största civila bedrägeriuppgörelsen mot ett läkemedelsföretag. Sex whistle-blowers tilldelades mer än 102 miljoner dollar för sin roll i utredningen. Tidigare Pfizer-försäljare John Kopchinski agerade som en qui tam- relator och lämnade in ett klagomål 2004 som beskriver det olagliga beteendet vid marknadsföringen av Bextra. Kopchinski tilldelades 51,5 miljoner dollar för sin roll i fallet eftersom den felaktiga marknadsföringen av Bextra var den största delen av uppgörelsen på 1,8 miljarder dollar.
Analys av valdecoxib
Flera HPLC-UV-metoder har rapporterats för uppskattning av valdecoxib i biologiska prover som mänsklig urin. Valdecoxib har analytiska metoder för bioekvivalensstudier, metabolitbestämning, uppskattning av formulering och en HPTLC-metod för samtidig uppskattning i tablettdosform.