NMDA-receptor

N - metyl- D - aspartatreceptorn (även känd som NMDA-receptorn eller NMDAR ), är en glutamatreceptor och jonkanal som finns i neuroner . NMDA-receptorn är en av tre typer av jonotropa glutamatreceptorer , de andra två är AMPA- och kainatreceptorer . Beroende på dess underenhetssammansättning är dess ligander glutamat och glycin (eller D -serin ). Bindningen av liganderna är dock vanligtvis inte tillräcklig för att öppna kanalen eftersom den kan blockeras av Mg2 + -joner som endast tas bort när neuronen är tillräckligt depolariserad. Således fungerar kanalen som en "slumpdetektor" och bara när båda dessa villkor är uppfyllda öppnas kanalen och den tillåter positivt laddade joner (katjoner) att flöda genom cellmembranet . NMDA-receptorn anses vara mycket viktig för att kontrollera synaptisk plasticitet och förmedla inlärnings- och minnesfunktioner .
NMDA-receptorn är jonotrop , vilket betyder att det är ett protein som tillåter passage av joner genom cellmembranet. NMDA-receptorn heter så eftersom agonistmolekylen N -metyl- D -aspartat (NMDA) binder selektivt till den, och inte till andra glutamatreceptorer . Aktivering av NMDA-receptorer resulterar i öppnandet av jonkanalen som är icke-selektiv för katjoner , med en kombinerad reverseringspotential nära 0 mV. Medan öppningen och stängningen av jonkanalen primärt styrs av ligandbindning, är strömflödet genom jonkanalen spänningsberoende. Specifikt placerade på receptorn kan extracellulära magnesium (Mg2+) och zink (Zn2+) joner binda och hindra andra katjoner från att strömma genom den öppna jonkanalen. Ett spänningsberoende flöde av natrium (Na+), kalcium (Ca2+) och kalium (K+) joner in i och ut ur cellen möjliggörs genom depolarisering av cellen, som förskjuter och stöter bort Mg2+ och Zn2+ joner från poren . Ca 2+ flöde genom NMDA-receptorer i synnerhet tros vara avgörande för synaptisk plasticitet, en cellulär mekanism för inlärning och minne, på grund av proteiner som binder till och aktiveras av Ca 2+ -joner .
Aktiviteten hos NMDA-receptorn blockeras av många psykoaktiva läkemedel såsom fencyklidin (PCP), alkohol ( etanol ) och dextrometorfan (DXM). De anestetiska och analgetiska effekterna av läkemedlen ketamin och dikväveoxid beror också delvis på deras effekter på att blockera NMDA-receptoraktivitet. Däremot ökar överaktivering av NMDAR av NMDA-agonister de cytosoliska koncentrationerna av kalcium och zink , vilket signifikant bidrar till neural död , en effekt som är känd för att förhindras av cannabinoider , medierad av aktivering av CB1-receptorn , vilket leder till att HINT1 -proteinet motverkar det giftiga effekter av NMDAR-medierad NO- produktion och zinkfrisättning. Förutom att förhindra metamfetamininducerad neurotoxicitet via hämning av uttryck av kväveoxidsyntas (nNOS) och astrocytaktivering , ses det minska metamfetamininducerad hjärnskada genom en CB1-beroende respektive oberoende mekanism, och hämning av metamfetamininducerad astroglios är sannolikt uppstår genom en CB2-receptorberoende mekanism för THC . Sedan 1989 memantin ansetts vara en icke-kompetitiv antagonist av NMDA-receptorn, som går in i receptorns kanal efter att den har aktiverats och blockerar därigenom jonflödet.
Överaktivering av receptorn, vilket orsakar överdrivet inflöde av Ca 2+ kan leda till excitotoxicitet som antyds vara involverad i vissa neurodegenerativa störningar. Blockering av NMDA-receptorer skulle därför teoretiskt kunna vara användbar vid behandling av sådana sjukdomar. Emellertid kan hypofunktion av NMDA-receptorer (på grund av glutationbrist eller andra orsaker) vara involverad i försämring av synaptisk plasticitet och kan ha andra negativa återverkningar. Huvudproblemet med användningen av NMDA-receptorantagonister för neuroskydd är att de fysiologiska verkningarna av NMDA-receptorn är väsentliga för normal neuronal funktion. För att vara kliniskt användbara måste NMDA-antagonister blockera överdriven aktivering utan att störa normala funktioner. Memantine har denna egenskap.
Historia
Upptäckten av NMDA-receptorer följdes av syntes och studie av N -metyl- D -asparaginsyra (NMDA) på 1960-talet av Jeff Watkins och kollegor. I början av 1980-talet visade sig NMDA-receptorer vara involverade i flera centrala synaptiska vägar. Receptorsubenhetselektivitet upptäcktes i början av 1990-talet, vilket ledde till erkännande av en ny klass av föreningar som selektivt hämmar NR2B- subenheten . Dessa fynd ledde till en kraftfull kampanj inom läkemedelsindustrin. Av detta ansågs att NMDA-receptorer var associerade med en mängd olika neurologiska störningar såsom epilepsi , Parkinsons , Alzheimers , Huntingtons och andra CNS-störningar.
År 2002 upptäcktes det av Hilmar Bading och medarbetare att de cellulära konsekvenserna av NMDA-receptorstimulering beror på receptorns placering på neuroncellytan. Synaptiska NMDA-receptorer främjar genuttryck, plasticitetsrelaterade händelser och förvärvat neuroskydd . Extrasynaptiska NMDA-receptorer främjar dödssignalering; de orsakar transkriptionell avstängning, mitokondriell dysfunktion och strukturell sönderdelning. Denna patologiska triad av extrasynaptisk NMDA-receptorsignalering representerar en vanlig omvandlingspunkt i etiologin för flera akuta och kroniska neurodegenerativa tillstånd. Den molekylära grunden för giftig extrasynaptisk NMDA-receptorsignalering upptäcktes av Hilmar Bading och medarbetare 2020. Extrasynaptiska NMDA-receptorer bildar ett dödssignalkomplex med TRPM4. NMDAR/TRPM4 interaktionsgränssnittshämmare (även kända som gränssnittshämmare) stör NMDAR/TRPM4-komplexet och avgiftar extrasynaptiska NMDA-receptorer.
Ett slumpmässigt fynd gjordes 1968 när en kvinna tog amantadin som influensamedicin och upplevde en anmärkningsvärd remission av sina Parkinsonsymtom. Detta fynd, rapporterat av Scawab et al., var början på medicinsk kemi av adamantanderivat i samband med sjukdomar som påverkar CNS. Innan detta fynd hade memantin, ett annat adamantanderivat, syntetiserats av Eli Lilly and Company 1963. Syftet var att utveckla ett hypoglykemiskt läkemedel, men det visade ingen sådan effekt . Det var inte förrän 1972 som en möjlig terapeutisk betydelse av memantin för behandling av neurodegenerativa sjukdomar upptäcktes. Från 1989 har memantin erkänts vara en icke-kompetitiv antagonist av NMDA-receptorn.
Strukturera
Funktionella NMDA-receptorer är heterotetramerer sammansatta av två GluN1- och typiskt två GluN2-subenheter. Det finns en GluN1-, fyra GluN2- och två GluN3-subenhetskodande gener, och varje gen kan producera mer än en splitsningsvariant.
- GluN1 – GRIN1
- GluN2
- GluN3
Gating
NMDA-receptorn är en glutamat- och jonkanalproteinreceptor som aktiveras när glycin och glutamat binder till den. Receptorn är ett heteromert komplex som interagerar med flera intracellulära proteiner med tre olika subenheter: GluN1, GluN2 och GluN3. GluN1 har åtta olika isoformer på grund av alternativ splitsning av genen GRIN1. Det finns fyra olika GluN2-subenheter (AD) och två olika Glun3-subenheter (A och B). Sex separata gener kodar för GluN2 och GluN3. Alla subenheterna delar en gemensam membrantopologi som domineras av en stor extracellulär N-terminal, en membranregion som består av tre transmembransegment, en återinträdande porslinga, en extracellulär loop mellan transmembransegmenten som inte är strukturellt välkända, och en intracellulär C-terminal, som är olika i storlek beroende på subenheten och ger flera ställen för interaktion med många intracellulära proteiner. Figur 1 visar en grundläggande struktur av GluN1/GluN2-subenheter som bildar bindningsstället för memantin, Mg2 + och ketamin .
Mg2 + blockerar NMDA-receptorkanalen på ett spänningsberoende sätt. Kanalerna är också mycket genomsläppliga för Ca2 + . Aktivering av receptorn beror på glutamatbindning, D -serin eller glycinbindning vid dess GluN1-kopplade bindningsställe och AMPA-receptorförmedlad depolarisering av det postsynaptiska membranet, vilket lindrar det spänningsberoende kanalblocket med Mg 2+ . Aktivering och öppning av receptorkanalen tillåter således flödet av K +- , Na +- och Ca 2+ -joner, och inflödet av Ca 2+ triggar intracellulära signalvägar. Allosteriska receptorbindningsställen för zink, proteiner och polyaminerna spermidin och spermin är också modulatorer för NMDA-receptorkanalerna.
GluN2B-subenheten har varit involverad i att modulera aktivitet såsom inlärning, minne, bearbetning och matningsbeteenden, såväl som att vara inblandad i antalet mänskliga störningar. Den grundläggande strukturen och funktionerna associerade med NMDA-receptorn kan tillskrivas GluN2B-subenheten. bildas glutamatbindningsstället och kontrollen av Mg2 + -blocket av GluN2B-subenheten. Högaffinitetsställena för glycinantagonist visas också exklusivt av GluN1/GluN2B-receptorn.
GluN1/GluN2B transmembransegment anses vara den del av receptorn som bildar bindningsfickorna för icke-kompetitiva NMDA-receptorantagonister, men strukturerna för transmembransegmenten är inte helt kända som nämnts ovan. Det hävdas att tre bindningsställen inom receptorn, A644 på GluNB-subenheten och A645 och N616 på GluN1-subenheten, är viktiga för bindning av memantin och relaterade föreningar som ses i figur 2.
NMDA-receptorn bildar en heterotetramer mellan två GluN1- och två GluN2-subenheter (subenheterna betecknades tidigare som GluN1 och GluN2), två obligatoriska GluN1-subenheter och två regionalt lokaliserade GluN2-subenheter. En besläktad genfamilj av GluN3 A- och B-subenheter har en hämmande effekt på receptoraktivitet. Multipelreceptorisoformer med distinkta hjärnfördelningar och funktionella egenskaper uppstår genom selektiv splitsning av GluN1-transkripten och differentiellt uttryck av GluN2-subenheterna .
Varje receptorsubenhet har modulär design och varje strukturell modul representerar också en funktionell enhet:
- Den extracellulära domänen innehåller två globulära strukturer: en modulerande domän och en ligandbindande domän. GluN1-subenheter binder ko-agonisten glycin och GluN2-subenheter binder signalsubstansen glutamat.
- Den agonistbindande modulen länkar till en membrandomän, som består av tre transmembransegment och en återinträdande slinga som påminner om selektivitetsfiltret för kaliumkanaler .
- Membrandomänen bidrar med rester till kanalporen och är ansvarig för receptorns högenhetliga konduktans , höga kalciumpermeabilitet och spänningsberoende magnesiumblock.
- Varje subenhet har en omfattande cytoplasmatisk domän , som innehåller rester som kan modifieras direkt av en serie av proteinkinaser och proteinfosfataser , såväl som rester som interagerar med ett stort antal strukturella, adaptor- och byggnadsstrukturproteiner.
De glycinbindande modulerna för GluN1- och GluN3-subenheterna och den glutamatbindande modulen i GluN2A-subenheten har uttryckts som lösliga proteiner, och deras tredimensionella struktur har lösts vid atomupplösning genom röntgenkristallografi . Detta har avslöjat en gemensam veckning med aminosyrabindande bakterieproteiner och med den glutamatbindande modulen av AMPA-receptorer och kainat-receptorer.
Handlingsmekanism
NMDA-receptorer är en avgörande del av utvecklingen av det centrala nervsystemet. Processerna för inlärning, minne och neuroplasticitet är beroende av mekanismen hos NMDA-receptorer. NMDA-receptorer är glutamatstyrda katjonkanaler som möjliggör en ökning av kalciumpermeabiliteten . Kanalaktivering av NMDA-receptorer är ett resultat av bindningen av två co-agonister, glycin och glutamat .
Överaktivering av NMDA-receptorer, vilket orsakar överdrivet inflöde av Ca 2+ kan leda till excitotoxicitet. Excitotoxicitet antyds vara involverad i vissa neurodegenerativa sjukdomar såsom Alzheimers sjukdom, Parkinsons sjukdom och Huntingtons sjukdom. Blockering av NMDA-receptorer skulle därför teoretiskt kunna vara användbar vid behandling av sådana sjukdomar. Det är emellertid viktigt att bevara fysiologisk NMDA-receptoraktivitet samtidigt som man försöker blockera dess överdrivna excitotoxiska aktivitet. Detta kan möjligen uppnås genom icke-kompetitiva antagonister, som blockerar receptorernas jonkanal när de är alltför öppna.
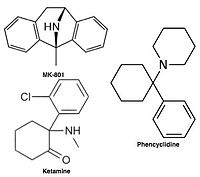
Icke-kompetitiva NMDA-receptorantagonister, eller kanalblockerare, går in i NMDA-receptorns kanal efter att den har aktiverats och blockerar därigenom jonflödet. MK-801 , ketamin , amantadin och memantin är exempel på sådana antagonister, se figur 1. Off-rate för en antagonist från receptorkanalen är en viktig faktor eftersom för långsam off-rate kan störa receptorns normala funktion och även snabb off-rate kan ge ineffektiv blockad av en alltför öppen receptor.
Memantin är ett exempel på en icke-kompetitiv kanalblockerare av NMDA-receptorn, med en relativt snabb off-rate och låg affinitet. Vid fysiologiskt pH är dess amingrupp positivt laddad och dess receptorantagonism är spänningsberoende. Det härmar därigenom den fysiologiska funktionen hos Mg 2+ som kanalblockerare. Memantin blockerar endast NMDA-receptorassocierade kanaler under långvarig aktivering av receptorn, eftersom det sker under excitotoxiska förhållanden, genom att ersätta magnesium vid bindningsstället. Under normal receptoraktivitet förblir kanalerna bara öppna i flera millisekunder och under dessa omständigheter kan memantin inte binda i kanalerna och stör därför inte normal synaptisk aktivitet.
Varianter
GluN1
Det finns åtta varianter av GluN1 -subenheten som produceras genom alternativ splitsning av GRIN1 :
- GluNl-la, GluNl-lb; GluN1-1a är den form som uttrycks mest.
- GluNl-2a, GluNl-2b;
- GluNl-3a, GluNl-3b;
- GluNl-4a, GluNl-4b;
GluN2
Medan en enda GluN2-subenhet finns i ryggradslösa organismer , uttrycks fyra distinkta isoformer av GluN2-subenheten i ryggradsdjur och hänvisas till med nomenklaturen GluN2A till GluN2D (kodad av GRIN2A , GRIN2B , GRIN2C , GRIN2D ). Starka bevis visar att generna som kodar för GluN2-subenheterna hos ryggradsdjur har genomgått minst två omgångar av genduplicering . De innehåller bindningsstället för glutamat . Ännu viktigare är att varje GluN2-subenhet har en annan intracellulär C-terminal domän som kan interagera med olika uppsättningar av signalmolekyler. Till skillnad från GluN1-subenheter uttrycks GluN2-subenheter differentiellt över olika celltyper och utvecklingstidpunkter och styr de elektrofysiologiska egenskaperna hos NMDA-receptorn. I klassiska kretsar finns GluN2B huvudsakligen i omogna neuroner och på extrasynaptiska platser såsom tillväxtkoner , och innehåller bindningsstället för den selektiva hämmaren ifenprodil . Men i pyramidala cellsynapser i den nyligen utvecklade primatens dorsolaterala prefrontala cortex , är GluN2B uteslutande inom den postsynaptiska tätheten och förmedlar högre kognitiva operationer såsom arbetsminne . Detta överensstämmer med expansionen av GluN2Bs handlingar och uttryck över den kortikala hierarkin hos apor och människor och över primats cortex evolution .
GluN2B till GluN2A switch
Medan GluN2B är dominerande i den tidiga postnatala hjärnan, ökar antalet GluN2A-subenheter under tidig utveckling; så småningom GluN2A- subenheter fler än GluN2B. Detta kallas GluN2B-GluN2A utvecklingsväxel, och är anmärkningsvärt på grund av den olika kinetiken som varje GluN2-subenhet bidrar till receptorfunktionen. Till exempel leder större andelar av GluN2B-subenheten till NMDA-receptorer som förblir öppna längre jämfört med de med mer GluN2A. Detta kan delvis förklara bättre minnesförmåga under den omedelbara postnatala perioden jämfört med sent i livet, vilket är principen bakom genetiskt förändrade " doogiemöss" . Det detaljerade tidsförloppet för denna switch i den mänskliga lillhjärnan har uppskattats med hjälp av expressionsmikroarray och RNA-seq och visas i figuren till höger.
Det finns tre hypotetiska modeller för att beskriva denna omkopplingsmekanism:
- Ökning av synaptisk GluN2A tillsammans med minskning av GluN2B
- Extrasynaptisk förskjutning av GluN2B bort från synapsen med ökning av GluN2A
- Ökning av GluN2A späder ut antalet GluN2B utan minskning av det senare.
GluN2B- och GluN2A-subenheterna har också olika roller i att förmedla excitotoxisk neuronal död. Utvecklingsväxlingen i subenhetssammansättningen tros förklara utvecklingsförändringarna i NMDA-neurotoxicitet. Homozygot störning av genen för GluN2B hos möss orsakar perinatal dödlighet , medan störning av GluN2A-genen producerar livsdugliga möss, men med nedsatt hippocampus plasticitet. En studie tyder på att reelin kan spela en roll i NMDA-receptormognaden genom att öka rörligheten för GluN2B-subenheten.
GluN2B till GluN2C switch
Granulcellsprekursorer (GCP) i lillhjärnan, efter att ha genomgått symmetrisk celldelning i det externa granulcelllagret (EGL), migrerar in i det interna granulcelllagret (IGL) där de nedreglerar GluN2B och aktiverar GluN2C, en process som är oberoende av neuregulin beta-signalering genom ErbB2- och ErbB4-receptorer.
Roll i excitotoxicitet
NMDA-receptorer har i ett antal studier ansetts vara starkt involverade i excitotoxicitet . Eftersom NMDA-receptorer spelar en viktig roll i neuronernas hälsa och funktion, har det diskuterats mycket om hur dessa receptorer kan påverka både cellöverlevnad och celldöd. Nya bevis stöder hypotesen att överstimulering av extrasynaptiska NMDA-receptorer har mer att göra med excitotoxicitet än stimulering av deras synaptiska motsvarigheter. Dessutom, även om stimulering av extrasynaptiska NMDA-receptorer verkar bidra till celldöd, finns det bevis som tyder på att stimulering av synaptiska NMDA-receptorer bidrar till cellens hälsa och livslängd. Det finns gott om bevis för att stödja den dubbla naturen hos NMDA-receptorer baserat på lokalisering, och hypotesen som förklarar de två olika mekanismerna är känd som "lokaliseringshypotesen".
Olika kaskadvägar
För att stödja lokaliseringshypotesen skulle det vara nödvändigt att visa att olika cellulära signalvägar aktiveras av NMDA-receptorer baserat på dess placering i cellmembranet. Experiment har utformats för att uteslutande stimulera antingen synaptiska eller icke-synaptiska NMDA-receptorer. Dessa typer av experiment har visat att olika vägar aktiveras eller regleras beroende på platsen för signalursprunget. Många av dessa vägar använder samma proteinsignaler , men regleras motsatt av NMDAR beroende på dess plats. Till exempel orsakade synaptisk NMDA-excitation en minskning av den intracellulära koncentrationen av p38-mitogenaktiverat proteinkinas ( p38MAPK ). Extrasynaptisk stimulering NMDARs reglerade p38MAPK på motsatt sätt, vilket orsakade en ökning av intracellulär koncentration. Experiment av denna typ har sedan dess upprepats med resultat som indikerar att dessa skillnader sträcker sig över många vägar kopplade till cellöverlevnad och excitotoxicitet.
Två specifika proteiner har identifierats som en huvudväg som är ansvarig för dessa olika cellulära svar ERK1/2 och Jacob. ERK1/2 är ansvarig för fosforylering av Jacob när den exciteras av synaptiska NMDAR. Denna information transporteras sedan till kärnan . Fosforylering av Jacob sker inte med extrasynaptisk NMDA-stimulering. Detta gör att transkriptionsfaktorerna i kärnan kan svara olika baserat på fosforyleringstillståndet hos Jacob.
Neural plasticitet
NMDA-receptorer (NMDAR) påverkar kritiskt induktionen av synaptisk plasticitet. NMDAR utlöser både långvarig potentiering (LTP) och långtidsdepression (LTD) via snabb synaptisk överföring. Experimentella data tyder på att extrasynaptiska NMDA-receptorer hämmar LTP medan de producerar LTD. Hämning av LTP kan förhindras med införandet av en NMDA-antagonist . En theta-burst-stimulering som vanligtvis inducerar LTP med synaptiska NMDAR, när den appliceras selektivt på extrasynaptiska NMDAR producerar en LTD. Experiment indikerar också att extrasynaptisk aktivitet inte krävs för bildandet av LTP. Dessutom är både synaptisk och extrasynaptisk aktivitet involverade i att uttrycka en fullständig LTD.
Olika underenheters roll
En annan faktor som verkar påverka NMDAR-inducerad toxicitet är den observerade variationen i subenhetsuppsättning . NMDA-receptorer är heterotetramerer med två GluN1-subenheter och två variabla subenheter. Två av dessa variabla subenheter, GluN2A och GluN2B, har visats leda till cellöverlevnad respektive celldödskaskader. Även om båda subenheterna finns i synaptiska och extrasynaptiska NMDAR finns det vissa bevis som tyder på att GluN2B-subenheten förekommer oftare i extrasynaptiska receptorer. Denna observation kan hjälpa till att förklara den dualistiska roll som NMDA-receptorer spelar i excitotoxicitet.
Trots de övertygande bevisen och den relativa enkelheten i dessa två teorier som arbetar tillsammans, finns det fortfarande oenighet om betydelsen av dessa påståenden. Vissa problem med att bevisa dessa teorier uppstår med svårigheten att använda farmakologiska metoder för att bestämma undertyperna av specifika NMDAR. Dessutom förklarar teorin om subenhetsvariation inte hur denna effekt kan dominera, eftersom det är allmänt hållet att den vanligaste tetrameren, gjord av två GluN1-subenheter och en av varje subenhet GluN2A och GluN2B, utgör en hög andel av NMDARs. .
Excitotoxicitet i en klinisk miljö
Excitotoxicitet har ansetts spela en roll i de degenerativa egenskaperna hos neurodegenerativa tillstånd sedan slutet av 1950-talet. NMDA-receptorer verkar spela en viktig roll i många av dessa degenerativa sjukdomar som påverkar hjärnan. Mest anmärkningsvärt är att excitotoxiska händelser som involverar NMDA-receptorer har kopplats till Alzheimers sjukdom och Huntingtons sjukdom, såväl som med andra medicinska tillstånd som stroke och epilepsi. Att behandla dessa tillstånd med en av de många kända NMDA-receptorantagonisterna leder emellertid till en mängd oönskade biverkningar, av vilka några kan vara allvarliga. Dessa biverkningar observeras delvis eftersom NMDA-receptorerna inte bara signalerar för celldöd utan också spelar en viktig roll i dess vitalitet. Behandling för dessa tillstånd kan hittas i att blockera NMDA-receptorer som inte finns vid synapsen. En klass av excitotoxicitet vid sjukdom inkluderar gain-of-function mutationer i GRIN2B och GRIN1 associerade med kortikala missbildningar, såsom polymikrogyri .
Ligander
Agonister


Aktivering av NMDA-receptorer kräver bindning av glutamat eller aspartat (aspartat stimulerar inte receptorerna lika starkt). Dessutom kräver NMDAR också bindningen av ko-agonisten glycin för effektiv öppning av jonkanalen, som är en del av denna receptor.
D -serin har också visat sig co-agonisera NMDA-receptorn med ännu större styrka än glycin. Det produceras av serin racemase och är berikat i samma områden som NMDA-receptorer. Avlägsnande av D -serin kan blockera NMDA-medierad excitatorisk neurotransmission i många områden. Nyligen har det visat sig att D -serin kan frisättas både av neuroner och astrocyter för att reglera NMDA-receptorer.
NMDA-receptor (NMDAR)-medierade strömmar är direkt relaterade till membrandepolarisering. NMDA-agonister uppvisar därför snabb Mg 2+ obindande kinetik, vilket ökar sannolikheten för öppen kanal med depolarisering. Denna egenskap är grundläggande för NMDA-receptorns roll i minne och inlärning , och det har föreslagits att denna kanal är ett biokemiskt substrat för hebbisk inlärning, där den kan fungera som en tillfällighetsdetektor för membrandepolarisering och synaptisk överföring.
Exempel
Några kända NMDA-receptoragonister inkluderar:
-
Aminosyror och aminosyraderivat
- Asparaginsyra (aspartat) ( D -asparaginsyra , L -asparaginsyra ) – endogen glutamatplatsagonist. Ordet N -metyl- D -aspartat (NMDA) kommer delvis från D-aspartat.
-
Glutaminsyra (glutamat) – endogen glutamatplatsagonist
- Tetrazolylglycin – syntetisk glutamatplatsagonist
- Homocysteinsyra – endogen glutamatplatsagonist
- Ibotensyra – naturligt förekommande glutamatplatsagonist som finns i Amanita muscaria
- Kinolinsyra (kinolinat) – agonist för endogen glutamatställe
- Glycin – endogen glycinplatsagonist
-
Positiva allosteriska modulatorer
- Cerebrosterol – endogen svag positiv allosterisk modulator
- Kolesterol – endogen svag positiv allosterisk modulator
- Dehydroepiandrosteron (DHEA) – endogen svag positiv allosterisk modulator
- Dehydroepiandrosteronsulfat (DHEA-S) – endogen svag positiv allosterisk modulator
- Nebostinel (neboglamin) – syntetisk positiv allosterisk modulator av glycinstället
- Pregnenolonsulfat – endogen svag positiv allosterisk modulator
- Polyaminer
Neramexan
Ett exempel på memantinderivat är neramexan som upptäcktes genom att studera antalet aminoalkylcyklohexaner, med memantin som mall, som NMDA-receptorantagonister. Neramexane binder till samma ställe som memantin inom den NMDA-receptorassocierade kanalen och med jämförbar affinitet. Det visar också mycket liknande biotillgänglighet och blockerande kinetik in vivo som memantin. Neramexane gick till kliniska prövningar för fyra indikationer, inklusive Alzheimers sjukdom.
Partiella agonister

N -Metyl- D -asparaginsyra (NMDA), som NMDA-receptorn har fått sitt namn efter, är en partiell agonist för det aktiva eller glutamatigenkänningsstället.
3,5-Dibromo -L -fenylalanin, ett naturligt förekommande halogenerat derivat av L -fenylalanin , är en svag partiell NMDA-receptoragonist som verkar på glycinstället. 3,5-Dibromo -L -fenylalanin har föreslagits som en ny terapeutisk läkemedelskandidat för behandling av neuropsykiatriska störningar och sjukdomar som schizofreni och neurologiska störningar som ischemisk stroke och epileptiska anfall .
Andra partiella agonister av NMDA-receptorn som verkar på nya platser såsom rapastinel (GLYX-13) och apimostinel (NRX-1074) ses nu för utveckling av nya läkemedel med antidepressiva och smärtstillande effekter utan uppenbara psykotomimetiska aktiviteter.
Exempel
- Aminocyklopropankarboxylsyra (ACC) – syntetisk glycinplats partiell agonist
- Cykloserin ( D -cykloserin ) – naturligt förekommande glycinställe partiell agonist som finns i Streptomyces orchidaceus
- HA-966 – svag partiell agonist för syntetiskt glycinställe
- Homokinolinsyra – syntetisk glutamatplats partiell agonist
- N -metyl- D -asparaginsyra (NMDA) – syntetisk glutamatställe-partiell agonist
Positiva allosteriska modulatorer inkluderar:
- Zelquistinel (AGN-241751) - syntetisk ny sida partiell agonist
- Apimostinel (NRX-1074) – syntetisk ny sida partiell agonist
- Rapastinel (GLYX-13) – syntetisk ny partiell agonist
Antagonister

Antagonister av NMDA-receptorn används som bedövningsmedel för djur och ibland människor, och används ofta som rekreationsdroger på grund av deras hallucinogena egenskaper, förutom deras unika effekter vid förhöjda doser såsom dissociation . När vissa NMDA-receptorantagonister ges till gnagare i stora doser, kan de orsaka en form av hjärnskada som kallas Olneys lesioner . NMDA-receptorantagonister som har visat sig inducera Olneys lesioner inkluderar ketamin , fencyklidin och dextrorfan (en metabolit av dextrometorfan ), såväl som vissa NMDA-receptorantagonister som endast används i forskningsmiljöer. Hittills är den publicerade forskningen om Olneys lesioner ofullständig i sin förekomst på hjärnvävnader hos människa eller apa med avseende på en ökning av närvaron av NMDA-receptorantagonister.
De flesta NMDAR-antagonister är icke-kompetitiva eller icke-kompetitiva blockerare av kanalporen eller är antagonister till det samreglerande glycinstället snarare än antagonister till det aktiva/glutamatstället.
Exempel
Vanliga medel där NMDA-receptorantagonism är den primära eller en huvudsakliga verkningsmekanismen:
- 4-klorokynurenin (AV-101) – glycinplatsantagonist; prodrug av 7-klorokynurensyra
- 7-klorokynurensyra – glycinplatsantagonist
- Agmatin – endogen polyaminplatsantagonist
- Argiotoxin-636 – naturligt förekommande dizocilpin eller besläktad platsantagonist som finns i Argiope- gift
- AP5 – glutamatplatsantagonist
- AP7 – glutamatplatsantagonist
- CGP-37849 – glutamatställeantagonist
- Delucemin (NPS-1506) – dizocilpin eller besläktad platsantagonist; härledd från argiotoxin-636
- Dextrometorfan (DXM) – antagonist för dizocilpinstället; prodrug av dextrorfan
- Dextrorphan (DXO) – antagonist för dizocilpinstället
- Dexanabinol – dizocilpinrelaterad platsantagonist
- Dietyleter – okänd platsantagonist
- Difenidin – antagonist för dizocilpinstället
- Dizocilpin (MK-801) – antagonist för dizocilpinstället
- Eliprodil – antagonist för ifenprodilstället
- Esketamin – antagonist för dizocilpinstället
- Hodgkinsine – odefinierad platsantagonist
- Ifenprodil – antagonist för ifenprodilstället
- Kaitocephalin – naturligt förekommande glutamatplatsantagonist som finns i Eupenicillium shearii
- Ketamin – antagonist för dizocilpinstället
- Kynurensyra – endogen glycinplatsantagonist
- Lanicemin – lågfångande dizocilpinställeantagonist
- LY-235959 – glutamatplatsantagonist
- Memantin – lågfångande dizocilpinställeantagonist
- Metoxetamin – antagonist för dizocilpinstället
- Midafotel – glutamatplatsantagonist
- Lustgas (N 2 O) – odefinierad platsantagonist
- PEAQX – glutamatplatsantagonist
- Perzinfotel – glutamatplatsantagonist
- Fencyklidin (PCP) – antagonist för dizocilpinstället
- Fenylalanin - en naturligt förekommande aminosyra, glycinplatsantagonist
- Psykotridin – odefinierad platsantagonist
- Selfotel – glutamatplatsantagonist
- Tiletamin – antagonist för dizocilpinstället
- Traxoprodil – antagonist för ifenprodilstället
- Xenon – okänd platsantagonist
Några vanliga medel där svag NMDA-receptorantagonism är en sekundär eller ytterligare verkan inkluderar:
- Amantadine - ett antiviralt och antiparkinsoniskt läkemedel; lågfångande dizocilpinställeantagonist
- Atomoxetin – en noradrenalinåterupptagshämmare som används för att behandla ADHD
- Dextropropoxifen – ett opioidanalgetikum
- Etanol ( alkohol ) – ett euforiserande , lugnande och ångestdämpande medel som används för rekreation; okänd platsantagonist
- Guaifenesin – ett slemlösande medel
- Huperzine A – en naturligt förekommande acetylkolinesterashämmare och potentiellt antidemensmedel
- Ibogaine – ett naturligt förekommande hallucinogen och antiberoendemedel
- Ketobemidon – ett opioidanalgetikum
- Metadon – ett opioidanalgetikum
- Minocyklin – ett antibiotikum
- Tramadol – ett atypiskt opioidanalgetikum och serotoninfrisättande medel
Nitromemantin
NMDA-receptorn regleras via nitrosylering och aminoadamantan kan användas som en målriktad skyttel för att föra kväveoxid (NO) nära platsen inom NMDA-receptorn där den kan nitrosylera och reglera jonkanalens konduktivitet. En NO-donator som kan användas för att minska NMDA-receptoraktiviteten är alkylnitratnitroglycerin. Till skillnad från många andra NO-donatorer har alkylnitrater inte potentiella NO-associerade neurotoxiska effekter. Alkylnitrater donerar NO i form av en nitrogrupp som ses i figur 7, -NO 2 - som är en säker donator som undviker neurotoxicitet. Nitrogruppen måste riktas mot NMDA-receptorn, annars kan andra effekter av NO såsom dilatation av blodkärl och därav följande hypotoni uppstå. Nitromemantin är ett andra generationens derivat av memantin, det minskar excitotoxicitet medierad av överaktivering av det glutamaterga systemet genom att blockera NMDA-receptorn utan att offra säkerheten. Provisoriska studier i djurmodeller visar att nitromemantiner är mer effektiva än memantin som neuroprotektanter, både in vitro och in vivo. Memantin och nyare derivat kan bli mycket viktiga vapen i kampen mot neuronskador.
Negativa allosteriska modulatorer inkluderar:
- 25-Hydroxycholesterol – endogen svag negativ allosterisk modulator
- Conantokins – naturligt förekommande negativa allosteriska modulatorer av polyaminplatsen som finns i Conus geographus
Modulatorer
Exempel
NMDA-receptorn moduleras av ett antal endogena och exogena föreningar:
- Aminoglykosider har visat sig ha en liknande effekt som polyaminer, och detta kan förklara deras neurotoxiska effekt.
- CDK5 reglerar mängden NR2B -innehållande NMDA-receptorer på det synaptiska membranet, vilket påverkar synaptisk plasticitet .
- Polyaminer aktiverar inte direkt NMDA-receptorer, utan verkar istället för att potentiera eller hämma glutamatmedierade svar.
- Reelin modulerar NMDA-funktion genom Src-familjens kinaser och DAB1 . signifikant förbättring av LTP i hippocampus .
- Src -kinas förstärker NMDA-receptorströmmar.
- Na + , K + och Ca2 + passerar inte bara genom NMDA-receptorkanalen utan modulerar också aktiviteten hos NMDA-receptorer.
- Zn2 + och Cu2 + blockerar i allmänhet NMDA-strömaktivitet på ett icke-konkurrerande och spänningsoberoende sätt. Men zink kan potentiera eller hämma strömmen beroende på neurala aktivitet.
- Pb 2+ är en potent NMDAR-antagonist. Presynaptiska brister till följd av Pb 2+ exponering under synaptogenes förmedlas av störningar av NMDAR-beroende BDNF-signalering.
- Proteiner av det stora histokompatibilitetskomplexet klass I är endogena negativa regulatorer av NMDAR-medierade strömmar i den vuxna hippocampus, och krävs för lämpliga NMDAR-inducerade förändringar i AMPAR -trafik och NMDAR-beroende synaptisk plasticitet och inlärning och minne .
- Aktiviteten hos NMDA-receptorer är också påfallande känslig för förändringarna i pH och delvis hämmad av den omgivande koncentrationen av H + under fysiologiska förhållanden. Nivån av hämning av H + är kraftigt reducerad i receptorer som innehåller NR1a-subtypen, som innehåller den positivt laddade insättningen Exon 5. Effekten av denna insättning kan efterliknas av positivt laddade polyaminer och aminoglykosider, vilket förklarar deras verkningssätt.
- NMDA-receptorfunktionen är också starkt reglerad av kemisk reduktion och oxidation, via den så kallade "redox-modulerande platsen". Genom denna webbplats förbättrar reduktanter dramatiskt NMDA-kanalaktiviteten, medan oxidanter antingen vänder effekterna av reduktanter eller undertrycker inhemska svar. Det anses allmänt att NMDA-receptorer moduleras av endogena redoxmedel som glutation , liponsyra och det essentiella näringsämnet pyrrolokinolinkinon .
Utveckling av NMDA-receptorantagonister
Huvudproblemet med utvecklingen av NMDA-antagonister för neuroskydd är att fysiologisk NMDA-receptoraktivitet är väsentlig för normal neuronal funktion. Fullständig blockad av all NMDA-receptoraktivitet resulterar i biverkningar som hallucinationer , agitation och anestesi . För att vara kliniskt relevant måste en NMDA-receptorantagonist begränsa sin verkan till blockering av överdriven aktivering, utan att begränsa receptorns normala funktion.
Konkurrenskraftiga NMDA-receptorantagonister
Konkurrenskraftiga NMDA-receptorantagonister, som utvecklades först, är inte ett bra alternativ eftersom de konkurrerar och binder till samma plats (NR2-subenhet) på receptorn som agonisten, glutamat, och därför blockerar normal funktion också. De kommer att blockera friska områden i hjärnan innan de påverkar patologiska områden, eftersom friska områden innehåller lägre nivåer av agonister än patologiska områden. Dessa antagonister kan förskjutas från receptorn genom hög koncentration av glutamat som kan existera under excitotoxiska omständigheter.
Icke-kompetitiva NMDA-receptorantagonister
Icke-kompetitiva NMDA-receptorantagonister blockerar i jonkanalen vid Mg2 + -stället (porregionen) och förhindrar överdrivet inflöde av Ca2 + . Icke-kompetitiv antagonism hänvisar till en typ av blockering som en ökad koncentration av glutamat inte kan övervinna, och är beroende av tidigare aktivering av receptorn av agonisten, dvs den kommer bara in i kanalen när den öppnas av agonisten.
På grund av dessa negativa biverkningar av blockerare med hög affinitet fortsatte sökandet efter kliniskt framgångsrika NMDA-receptorantagonister för neurodegenerativa sjukdomar och fokuserade på att utveckla blockerare med låg affinitet. Emellertid kunde affiniteten inte vara för låg och uppehållstiden inte för kort (som ses med Mg2 + ) där membrandepolarisering lindrar blockeringen. Upptäckten var därigenom utveckling av icke-kompetitiv antagonist med längre uppehållstid än Mg 2+ i kanalen men kortare än MK-801. På så sätt skulle det erhållna läkemedlet bara blockera alltför öppna NMDA-receptorassocierade kanaler men inte normal neurotransmission. Memantin är den drogen. Det är ett derivat av amantadin som först var ett medel mot influensa men som senare av en slump upptäcktes ha effekt vid Parkinsons sjukdom. Kemiska strukturer av memantin och amantadin kan ses i figur 5. Föreningen ansågs först vara dopaminerg eller antikolinerg men visade sig senare vara en NMDA-receptorantagonist.
Memantine är det första läkemedlet som godkänts för behandling av svår och mer avancerad Alzheimers sjukdom , som till exempel antikolinerga läkemedel inte gör så mycket nytta för. Det hjälper till att återhämta synaptisk funktion och förbättrar på så sätt nedsatt minne och inlärning. Under 2015 är memantin också i försök för terapeutisk betydelse vid ytterligare neurologiska störningar.
Många andra generationens memantinderivat har varit under utveckling som kan visa ännu bättre neuroprotektiva effekter, där huvudtanken är att använda andra säkra men effektiva modulerande ställen på NMDA-receptorn förutom dess associerade jonkanal.
Strukturaktivitetsrelation (SAR)
Memantin (1-amino-3,5-dimetyladamantan) är ett aminoalkylcyklohexanderivat och en atypisk läkemedelsförening med icke-plan, tredimensionell tricyklisk struktur. Figur 8 visar SAR för aminoalkylcyklohexanderivat. Memantin har flera viktiga egenskaper i sin struktur för dess effektivitet:
- Tre-ringstruktur med en brohuvudsamin, -NH 2
- -NH 2 -gruppen protoneras under kroppens fysiologiska pH för att bära en positiv laddning, -NH 3+
- Två metyl (CH3 ) sidogrupper som tjänar till att förlänga uppehållstiden och öka stabiliteten samt affiniteten för NMDA-receptorkanalen jämfört med amantadin (1-adamantanamin).
Trots den lilla strukturella skillnaden mellan memantin och amantadin, två adamantanderivat, är affiniteten för bindningsstället för NR1/NR2B-subenheten mycket större för memantin. I patch-clamp- mätningar har memantin en IC 50 på (2,3+0,3) μM medan amantadin har en IC 50 på (71,0+11,1) μM. Bindningsstället med högst affinitet kallas det dominanta bindningsstället. Det involverar en koppling mellan amingruppen i memantin och NR1-N161-bindningsfickan i NR1/NR2B-subenheten. Metylsidogrupperna spelar en viktig roll för att öka affiniteten till de öppna NMDA-receptorkanalerna och göra det till ett mycket bättre neuroprotektivt läkemedel än amantadin. Bindningsfickorna för metylgrupperna anses vara vid NR1-A645 och NR2B-A644 i NR1/NR2B. Bindningsfickorna visas i figur 2. Memantin binder vid eller nära Mg2 + -stället inuti den NMDA-receptorassocierade kanalen. -NH2 - gruppen på memantin, som protoneras under kroppens fysiologiska pH, representerar regionen som binder vid eller nära Mg2+ -stället . Att lägga till två metylgrupper till -N på memantinstrukturen har visat sig minska affiniteten, vilket ger ett IC50- värde på (28,4+1,4) μM.
Andra generationens derivat av memantin; nitromemantin
Flera derivat av Nitromemantine, ett andra generationens derivat av memantin, har syntetiserats för att utföra en detaljerad strukturaktivitetsrelation (SAR) för dessa nya läkemedel. En klass, innehållande en nitro (NO 2 ) grupp motsatt brohuvudsaminen (NH 2 ), visade ett lovande resultat. Nitromemantin använder memantinbindningsställe på NMDA-receptorn för att rikta gruppen NO x (X= 1 eller 2) för interaktion med S-nitrosylerings-/redoxstället utanför memantinbindningsstället. Att förlänga sidokedjorna av memantin kompenserar för den sämre läkemedelsaffiniteten i kanalen som är förknippad med tillägget av –ONO 2 - gruppen
Terapeutisk tillämpning
Excitotoxicitet antyds vara involverad i vissa neurodegenerativa störningar såsom Alzheimers sjukdom, Parkinsons sjukdom, Huntingtons sjukdom och amyotrofisk lateralskleros . Blockering av NMDA-receptorer skulle därför teoretiskt kunna vara användbar vid behandling av sådana sjukdomar. Det är emellertid viktigt att bevara fysiologisk NMDA-receptoraktivitet samtidigt som man försöker blockera dess överdrivna excitotoxiska aktivitet. Detta kan möjligen uppnås genom inkompetitiva antagonister som blockerar receptorernas jonkanal när de är alltför öppna
Memantin är ett exempel på icke-kompetitiv NMDA-receptorantagonist som har godkänd indikation för den neurodegenerativa sjukdomen Alzheimers sjukdom. Under 2015 är memantin fortfarande i kliniska prövningar för ytterligare neurologiska sjukdomar.
Receptormodulering
NMDA-receptorn är en ospecifik katjonkanal som kan tillåta passage av Ca 2+ och Na + in i cellen och K + ut ur cellen. Den excitatoriska postsynaptiska potentialen (EPSP) som produceras genom aktivering av en NMDA-receptor ökar koncentrationen av Ca 2+ i cellen. Ca 2+ kan i sin tur fungera som en andra budbärare i olika signalvägar . NMDA-receptorkatjonkanalen blockeras emellertid av Mg2 + vid vilande membranpotential. Magnesiumavblockering sker inte omedelbart, för att avblockera alla tillgängliga kanaler måste den postsynaptiska cellen depolariseras under en tillräckligt lång tidsperiod (i skalan av millisekunder).
Därför fungerar NMDA-receptorn som en "molekylär koincidensdetektor ". Dess jonkanal öppnas endast när följande två villkor är uppfyllda: glutamat binds till receptorn och den postsynaptiska cellen depolariseras (vilket tar bort Mg 2+ som blockerar kanalen). Denna egenskap hos NMDA-receptorn förklarar många aspekter av långsiktig potentiering (LTP) och synaptisk plasticitet .
I en vilomembranpotential öppnas NMDA-receptorporen vilket möjliggör ett inflöde av externa magnesiumjoner som binder för att förhindra ytterligare jonpermeation. Externa magnesiumjoner är i ett millimolärt intervall medan intracellulära magnesiumjoner är i ett mikromolärt intervall för att resultera i negativ membranpotential. NMDA-receptorer moduleras av ett antal endogena och exogena föreningar och spelar en nyckelroll i ett brett spektrum av fysiologiska (t.ex. minne ) och patologiska processer (t.ex. excitotoxicitet ). Magnesium verkar för att potentiera NMDA-inducerade svar vid positiva membranpotentialer samtidigt som det blockerar NMDA-kanalen. Användningen av kalcium, kalium och natrium används för att modulera aktiviteten hos NMDAR som passerar genom NMDA-membranet. Förändringar i H+-koncentration kan delvis hämma aktiviteten av NMDA-receptorer under olika fysiologiska tillstånd.
Klinisk signifikans
NMDAR-antagonister som ketamin , esketamin , tiletamin , fencyklidin , dikväveoxid och xenon används som allmänna anestetika . Dessa och liknande droger som dextrometorfan och metoxetamin ger också dissociativa , hallucinogena och euforiserande effekter och används som rekreationsdroger .
NMDAR-riktade föreningar, inklusive ketamin, esketamin (JNJ-54135419), rapastinel (GLYX-13), apimostinel (NRX-1074), zelquistinel (AGN-241751), 4-klorokynurenin (AV-101) och rislenemdaz (CERC- 301, MK-0657), är under utveckling för behandling av humörstörningar , inklusive egentlig depression och behandlingsresistent depression . Dessutom används ketamin redan för detta ändamål som en off-label terapi på vissa kliniker.
Forskning tyder på att tianeptin ger antidepressiva effekter genom indirekt förändring och hämning av glutamatreceptoraktivitet och frisättning av BDNF , vilket i sin tur påverkar neurala plasticitet . Tianeptin verkar också på NMDA- och AMPA-receptorerna . I djurmodeller hämmar tianeptin de patologiska stressinducerade förändringarna i glutamaterg neurotransmission i amygdala och hippocampus.
Memantine , en lågfångande NMDAR-antagonist, är godkänd i USA och Europa för behandling av måttlig till svår Alzheimers sjukdom och har nu fått en begränsad rekommendation av Storbritanniens National Institute for Health and Care Excellence för patienter som misslyckas andra behandlingsalternativ.
Cochlear NMDAR är målet för intensiv forskning för att hitta farmakologiska lösningar för att behandla tinnitus . NMDAR är associerade med en sällsynt autoimmun sjukdom, anti-NMDA-receptorencefalit (även känd som NMDAR-encefalit), som vanligtvis uppstår på grund av korsreaktivitet av antikroppar som produceras av immunsystemet mot ektopiska hjärnvävnader, såsom de som finns i teratom . Dessa är kända som anti-glutamatreceptorantikroppar .
Jämfört med dopaminerga stimulantia som metamfetamin kan NMDAR-antagonisten fencyklidin producera ett bredare spektrum av symtom som liknar schizofreni hos friska frivilliga, i vad som har lett till glutamathypotesen om schizofreni . Experiment där gnagare behandlas med NMDA-receptorantagonister är idag den vanligaste modellen när det gäller att testa nya schizofreniterapier eller utforska den exakta mekanismen hos läkemedel som redan är godkända för behandling av schizofreni.
NMDAR-antagonister, till exempel eliprodil , gavestinel , licostinel och selfotel har undersökts omfattande för behandling av excitotoxicitetsmedierad neurotoxicitet i situationer som ischemisk stroke och traumatisk hjärnskada , men var misslyckade i kliniska prövningar som användes i små doser för att undvika sedering, men NMDAR-antagonister kan blockera spridningsdepolarisationer hos djur och hos patienter med hjärnskada. Denna användning har ännu inte testats i kliniska prövningar.
Se även
externa länkar
-
 Media relaterade till NMDA-receptor på Wikimedia Commons
Media relaterade till NMDA-receptor på Wikimedia Commons - NMDA-receptorfarmakologi
- Motorisk diskoordination resultat från kombinerad genstörning av NMDA-receptorns NR2A- och NR2C-subenheter, men inte från enstaka störningar av NR2A- eller NR2C-subenheten
- Ett schematiskt diagram sammanfattar tre potentiella modeller för byte av NR2A- och NR2B-subenheter vid utveckling av synapser
- Drosophila NMDA-receptor 1 - Den interaktiva flugan