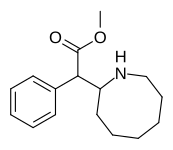
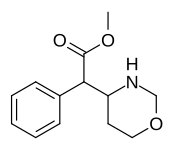
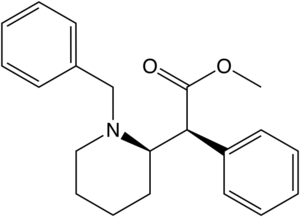
Lista över metylfenidatanaloger

Detta är en lista över metylfenidat (MPH eller MPD) analoger , eller fenidater . Den mest välkända föreningen från denna familj, metylfenidat, är allmänt förskriven runt om i världen för behandling av ADHD och vissa andra indikationer. Flera andra derivat inklusive rimiterol , phacetoperan och pipradrol har också mer begränsad medicinsk tillämpning. Ett ganska större antal av dessa föreningar har sålts under senare år som designerdroger , antingen som quasi-legal substitut för otillåtna stimulantia såsom metamfetamin eller kokain , eller som påstådda "studiedroger" eller nootropics .
Mer strukturellt olika föreningar som Desoxipipradrol (och därmed Pipradrol , inklusive sådana derivat som AL-1095 , Diphemethoxidine , SCH-5472 och D2PM ), och till och med meflokin , 2-bensylpiperidin , rimiterol , enpirolin och DMBMPP -struktur kan också anses vara relaterad, med de förra också funktionellt så, som löst analoga föreningar. Acylgruppen har ibland ersatts med liknande längd ketoner för att öka varaktigheten. Alternativt har metoxikarbonyl i vissa fall ersatts med en alkylgrupp .
Dussintals fenidater och relaterade föreningar är kända från den akademiska litteraturen och patentlitteraturen, och molekylära modellerings- och receptorbindningsstudier har fastställt att aryl- och acylsubstituenterna i fenidatserien är funktionellt identiska med aryl- och acylgrupperna i fenyltropanserien av läkemedel, vilket tyder på att den centrala kärnan i dessa molekyler i första hand endast fungerar som en ställning för att korrekt orientera de bindande grupperna, och för var och en av de hundratals fenyltropanerna som är kända kan det finnas en fenidatekvivalent med en jämförbar aktivitetsprofil. Om än med respektive skillnad i bindningsentropi: kokain är -5,6 kcal/mol & metylfenidat är -25,5 kcal/mol ( Δ s °, mätt med [³H]GBR 1278 @ 25 °C)
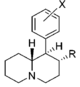
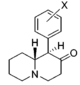
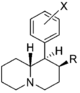
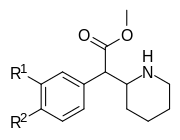
Anmärkningsvärda fenidatderivat
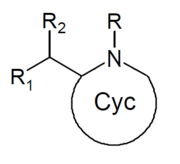
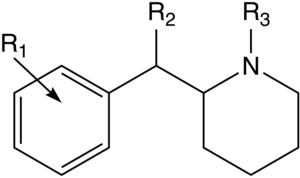
| Strukturera | Vanligt namn | Kemiskt namn | CAS-nummer | R 1 | R 2 |
|---|---|---|---|---|---|
|
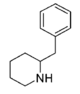
2-BZPD | 2-bensylpiperidin | 32838-55-4 | fenyl | H |

|
Ritalinsyra | Fenyl(piperidin-2-yl)ättiksyra | 19395-41-6 | fenyl | COOH |

|
Ritalinamid | 2-Fenyl-2-(piperidin-2-yl)acetamid | 19395-39-2 | fenyl | KONH 2 |

|
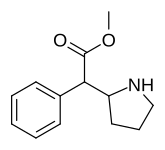
Metylfenidat (MPH) | Metylfenyl(piperidin-2-yl)acetat | 113-45-1 | fenyl | COOMe |
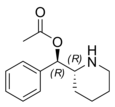
|
Phacetoperane (Lidépran) | [(R)-fenyl-[(2R)-piperidin-2-yl]metyl]acetat | 24558-01-8 | fenyl | OCOMe |
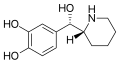
|
Rimiterol | 4-{(S)-hydroxi[(2R)-piperidin-2-yl]metyl}bensen-1,2-diol | 32953-89-2 | 3,4-dihydroxifenyl | hydroxi |

|
Etylfenidat (EPH) | Etylfenyl(piperidin-2-yl)acetat | 57413-43-1 | fenyl | COOEt |
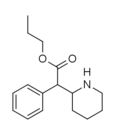
|
Propylfenidat (PPH) | Propylfenyl(piperidin-2-yl)acetat | 1071564-47-0 | fenyl | COOnPr |

|
Isopropylfenidat (IPH) | Propan-2-yl-2-fenyl-2-(piperidin-2-yl)acetat | 93148-46-0 | fenyl | COOiPr |

|
Butylfenidat (BPH) | Butylfenyl(piperidin-2-yl)acetat | fenyl | COOnBu | |

|
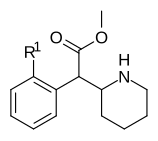
3-klormetylfenidat (3-Cl-MPH) | Metyl-2-(3-klorfenyl)-2-(piperidin-2-yl)acetat | 191790-73-5 | 3-klorfenyl | COOMe |

|
3-brommetylfenidat (3-Br-MPH) | Metyl 2-(3-bromfenyl)-2-(piperidin-2-yl)acetat | 3-bromfenyl | COOMe | |

|
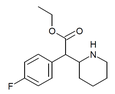
4-fluormetylfenidat (4F-MPH) | Metyl-2-(4-fluorfenyl)-2-(piperidin-2-yl)acetat | 1354631-33-6 | 4-fluorfenyl | COOMe |
|
4-fluoretylfenidat (4F-EPH) | Etyl-2-(4-fluorfenyl)-2-(piperidin-2-yl)acetat | 2160555-59-7 | 4-fluorfenyl | COOEt |

|
4-fluorisopropylfenidat (4F-IPH) | Propan-2-yl 2-(4-fluorfenyl)-2-(piperidin-2-yl)acetat | 4-fluorfenyl | COOiPr | |

|
4-klormetylfenidat (4-Cl-MPH) | Metyl-2-(4-klorfenyl)-2-(piperidin-2-yl)acetat | 680996-44-5 | 4-klorfenyl | COOMe |
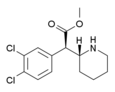
|
3,4-diklormetylfenidat (3,4-DCMP) | Metyl-2-(3,4-diklorfenyl)-2-(piperidin-2-yl)acetat | 1400742-68-8 | 3,4-diklorfenyl | COOMe |
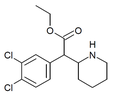
|
3,4-dikloretylfenidat (3,4-DCEP) | Etyl-2-(3,4-diklorfenyl)-2-(piperidin-2-yl)acetat | 3,4-diklorfenyl | COOEt | |
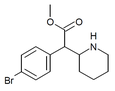
|
4-brommetylfenidat (4-Br-MPH) | Metyl-2-(4-bromfenyl)-2-(piperidin-2-yl)acetat | 203056-13-7 | 4-bromfenyl | COOMe |
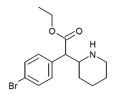
|
4-Brometylfenidat (4-Br-EPH) | Etyl-2-(4-bromfenyl)-2-(piperidin-2-yl)acetat | 1391486-43-3 | 4-bromfenyl | COOEt |

|
4-Metylmetylfenidat (4-Me-MPH) | Metyl-2-(4-metylfenyl)-2-(piperidin-2-yl)acetat | 191790-79-1 | 4-metylfenyl | COOMe |
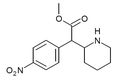
|
4-Nitrometylfenidat (4-NO2-MPH) | Metyl-2-(4-nitrofenyl)-2-(piperidin-2-yl)acetat | 4-nitrofenyl | COOMe | |

|
Metylendioximetylfenidat (MDMPH) | Metyl-(1,3-bensodioxol-5-yl)(piperidin-2-yl)acetat | 3,4-metylendioxifenyl | COOMe | |

|
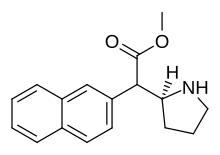
Metylnaftidat (HDMP-28) | Metyl(naftalen-2-yl)(piperidin-2-yl)acetat | 231299-82-4 | naftalen-2-yl | COOMe |
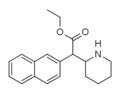
|
Etylnaftidat (HDEP-28) | Etyl (naftalen-2-yl)(piperidin-2-yl)acetat | 2170529-69-6 | naftalen-2-yl | COOEt |

|
MTMP | Metyl(tiofen-2-yl)(piperidin-2-yl)acetat | tiofen-2-yl | COOMe | |
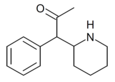
|
a-acetyl-2-bensylpiperidin | 1-Fenyl-1-(piperidin-2-yl)propan-2-on | fenyl | acetyl | |

|
CPMBP | 2-[l-(3-klorfenyl)-3-metylbutyl]piperidin | 3-klorfenyl | isobutyl | |

|
Desoxipipradrol (2-DPMP) | 2-benshydrylpiperidin | 519-74-4 | fenyl | fenyl |

|
Pipradrol (Meratran) | Difenyl(piperidin-2-yl)metanol | 467-60-7 | fenyl | hydroxi, fenyl |
Isomeri

Alternativ tvådimensionell återgivning av "D- treo -metylfenidat"; demonstrerar plasticiteten hos piperidinringen i en "böjd" eller "stol" konformation . (den senare termen kan beteckna en struktur som innehåller en bro i ringen när den kallas, till skillnad från ovanstående). OBS även om cyklohexankonformationen , om man beaktar både vätet på den vanliga bindningen och det implicita kolet på den prickade bindningen inte visas så placerade som skulle vara för det minsta energitillstånd som är inneboende för vilka regler som gäller internt för molekylen i och för sig: möjlighet till rörelse mellan förmodade andra ligandställen på ett sådant sätt, här beträffande vilka omständigheter som tillåter att beskriva den som "böjd" betyder alltså att den har visat tendens till förändring in situ beroende på dess miljö och närliggande platser för potentiell interaktion i förhållande till dess minsta energitillstånd.
Metylfenidat (och dess derivat) har två kirala centra , vilket betyder att det, och var och en av dess analoger, har fyra möjliga enantiomerer , var och en med olika farmakokinetik och receptorbindningsprofiler. I praktiken används metylfenidat mest som par av diastereomerer snarare än isolerade enstaka enantiomerer eller en blandning av alla fyra isomererna. Former inkluderar racematet, enantiopuren ( dextro eller levo ) av dess stereoisomerer; erythro eller threo (antingen + eller -) bland dess diastereoisomerer, den chirala isomerer S,S; S,R/R,S eller R,R och slutligen de isomera konformerarna (som inte är absoluta) av antingen dess anti- eller gaucherotamer . Varianten med optimerad effekt är inte de vanligtvis bestyrkta generiska eller vanliga läkemedelsmärkena (t.ex. Ritalin, Daytrana etc.) utan (R,R)-dextro-(+)- threo - anti (säljs som Focalin ), som har en bindning profil i paritet med eller bättre än kokain . (Notera dock måttet på femfaldig (5×) avvikelse i bindningsentropin vid deras förmodade delade målbindningsställe, vilket kan förklara den högre missbrukspotentialen för kokain jämfört med metylfenidat trots affinitet för associering; dvs. det senare dissocierar lättare när det väl är bundet trots effektiviteten för bindning.) Dessutom involverar energin att byta mellan dess två p Ka rotamerer stabilisering av vätebindningen mellan den protonerade aminen (av en 8,5 ) med esterkarbonyl som resulterar i minskade fall av "gauche-gauche"-interaktioner via dess gynnande för aktivitet av "anti"-konformatorn för förmodade homergisk-psykostimulerande farmakokinetiska egenskaper, vilket postulerar att en inneboende konformationell isomer ("anti") är nödvändig för aktiviteten hos threo -diastereoisomeren.
Det bör också noteras att metylfenidat i demetylerad form är surt; en metabolit (och prekursor) känd som ritalinsyra . Detta ger potential att ge en konjugatsaltform som effektivt protoneras av ett salt nästan kemiskt duplikat/ identiskt med dess egen struktur; skapa ett "metylfenidatritalinat " .
Receptorbindningsprofiler för utvalda metylfenidatanaloger
Arylsubstitutioner _
| Förening |
S. Singhs alfanumeriska tilldelning (namn) |
R 1 | R 2 |
IC 50 (nM) (Hämning av [ 3H ] WIN 35428-bindning) |
IC50 (nM) (hämning av [ 3H ]DA-upptag ) |
Selektivitetsupptagning /bindning |
|---|---|---|---|---|---|---|

|
||||||
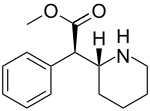
| (D- treo -metylfenidat) | H, H | 33 |
244 ± 142 (171 ± 10) |
7.4 | ||
| (L- treo -metylfenidat) | 540 |
5100 (1468 ± 112) |
9.4 | |||
|
(D/L- treo -metylfenidat) "eudismiskt förhållande" |
6.4 |
20,9 (8,6) |
- | |||
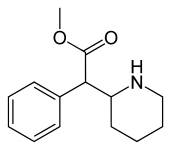
| (DL- treo -metylfenidat) | 83,0 ± 7,9 | 224 ± 19 | 2.7 | |||
 |
( R -bensoyl-metylekgonin) (kokain) |
(H, H) | 173 ± 13 | 404 ± 26 | 2.3 | |

|
||||||
| 351a (4F-MPH) | F |
H y d r o g e n i.e. H |
35,0 ± 3,0 | 142 ± 2,0 | 4.1 | |
| 351b | Cl | 20,6 ± 3,4 | 73,8 ± 8,1 | 3.6 | ||
| 351c | Br | 6,9 ± 0,1 | 26,3 ± 5,8 | 3.8 | ||
| 351d | (d) Br | - | 22,5 ± 2,1 | - | ||
| 351e | (l) Br | - | 408 ± 17 | - | ||
|
351d/e "eudismiskt förhållande" |
(d/l) Br | - | 18.1 | - | ||
| 351f | jag | 14,0 ± 0,1 | 64,5 ± 3,5 | 4.6 | ||
| 351 g | ÅH | 98,0 ± 10 | 340 ± 70 | 3.5 | ||
| 351h | OCH 3 | 83 ± 11 | 293 ± 48 | 3.5 | ||
| 351i | (d) OCH 3 | - | 205 ± 10 | - | ||
| 351j | (l) OCH 3 | - | 3588 ± 310 | - | ||
|
351i/j "eudismiskt förhållande" |
(d/l) OCH 3 | - | 17.5 | - | ||
| 351k (4-me-MPH) | CH 3 | 33,0 ± 1,2 | 126 ± 1 | 3.8 | ||
| 351l | t -Bu | 13500 ± 450 | 9350 ± 950 | 0,7 | ||
| 351m | NH2.HCl _ _ | 34,6 ± 4,0 | 115 ± 10 | 3.3 | ||
| 351n | NO 2 | 494 ± 33 | 1610 ± 210 | 3.3 | ||

|
||||||
| 352a | F | 40,5 ± 4,5 | 160 ± 0,00 | 4.0 | ||
| 352b | Cl | 5,1 ± 1,6 | 23,0 ± 3,0 | 4.5 | ||
| 352c | Br | 4,2 ± 0,2 | 12,8 ± 0,20 | 3.1 | ||
| 352d | ÅH | 321 ± 1,0 | 790 ± 30 | 2.5 | ||
| 352e | OMe | 288 ± 53 | 635 ± 35 | 0,2 | ||
| 352f | Mig | 21,4 ± 1,1 | 100 ± 18 | 4.7 | ||
| 352g | NH2.HCl _ _ | 265 ± 5 | 578 ± 160 | 2.2 | ||
 |
353a | 2′-F | 1420 ± 120 | 2900 ± 300 | 2.1 | |
| 353b | 2'-Cl | 1950 ± 230 | 2660 ± 140 | 1.4 | ||
| 353c | 2'-Br | 1870 ± 135 | 3410 ± 290 | 1.8 | ||
| 353d | 2'-OH | 23100 ± 50 | 35 800 ± 800 | 1.6 | ||
| 353e | 2'-OCH 3 | 101 000 ± 10 000 | 81 000 ± 2 000 | 0,8 | ||
 |
354a (3,4-DCMP) |
Cl, Cl (3',4'- Cl2 ) |
5,3 ± 0,7 | 7,0 ± 0,6 | 1.3 | |
| 354b | jag | ÅH | 42 ± 21 | 195 ± 197 | 4.6 | |
| 354c |
OMe, OMe (3′,4′-OMe 2 ) |
810 ± 10 | 1760 ± 160 | 2.2 | ||
Båda analogerna 374 och 375 visade högre styrka än metylfenidat vid DAT. I ytterligare jämförelse 375 (2-naftylen) dessutom två och en halv gånger mer potent än 374 (1-naftylisomeren).
Aryl bytte analoger
| Förening |
S. Singhs alfanumeriska tilldelning (namn) |
Ringa |
Ki ) (nM) (Hämning av [ 125I ]IPT-bindning |
Ki ) (nM) (hämning av [ 3H ]DA-upptag |
Selektivitetsupptagning /bindning |
|---|---|---|---|---|---|
 |
( D- treo -metylfenidat ) | bensen | 324 | - | - |
 |
(DL- treo -metylfenidat) | 82 ± 77 | 429 ± 88 | 0,7 | |
 |
374 | 1-naftalen | 194 ± 15 | 1981 ± 443 | 10.2 |
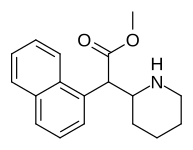
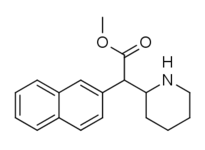 |
375 ( HDMP-28 ) |
2-naftalen | 79,5 | 85,2 ± 25 | 1.0 |
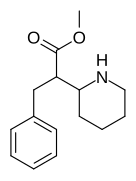 |
376 | bensyl | >5000 | - | - |
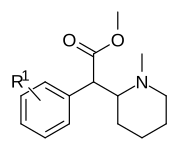
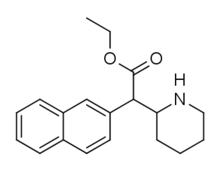
Piperidinkvävemetylerade fenylsubstituerade varianter
Cykloalkanförlängningar , kontraktioner och modifierade derivat
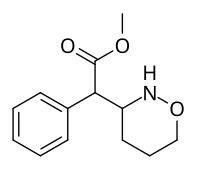 Metyl-2-(1,2-oxazinan-3-yl)-2-fenylacetat |
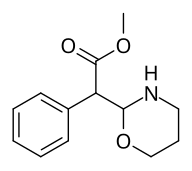 Metyl-2-(1,3-oxazinan-2-yl)-2-fenylacetat |
| ☝ De två andra (utöver förening 383 ) potentiella oxazinanmetylfenidat analoger. |
 Metyl-2-fenyl-2-(morfolin-3-yl)acetat A.KA Metyl-2-morfolin-3-yl-2-fenylacetat |
☜ Metylmorfenat metylfenidat-analog. |
Azido-jod- N -bensylanaloger
Strukturer av Azido-jod- N -bensylanaloger av metylfenidat med affiniteter.
- ɑ p <0,05 mot Ki av (±)— treo -metylfenidat.
- b p <0,05 mot IC50 av (±) —treo -metylfenidat.
- cp < 0,05 mot dess motsvarande Ki .
Alkylsubstituerade karbometoxianaloger
- ɑ H = Ekvivalent överlagring av funktionell grupp med strukturdelning
- b CO 2 CH 3 ( dvs. COOCH 3 ) = Ekvivalent överlagring av struktur som delar funktionell grupp
- c CH 3 = Ekvivalent överlagring av strukturdelande funktionell grupp
- d möjliga typografiska fel i originalkällan; t.ex. 2 100 ± 900 eller 900 ± 210
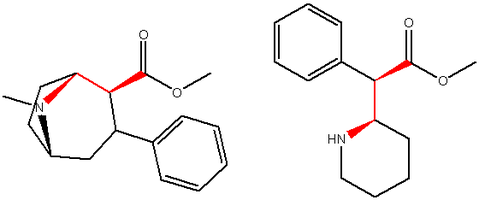
Begränsade rotationsanaloger av metylfenidat (kinolisidiner)
Två av de testade föreningarna, de svagaste två @ DAT och näst efter de två sista i tabellen nedan, utformades för att klargöra nödvändigheten av båda begränsade ringarna i effektiviteten av nedanstående serie av föreningar vid bindning genom att ta bort den ena eller den andra av föreningarna. de två ringarna i sin helhet. Den första av de två behåller den ursprungliga piperidinringen som hade med metylfenidat men har den begränsade B-ringen som är gemensam för de begränsade rotationsanalogerna borttagen. Den nedan saknar piperdinringen som är naturlig för metylfenidat men behåller ringen som hindrade flexibiliteten hos den ursprungliga MPH-konformationen. Även om deras styrka vid bindning är svag i jämförelse med serien, med den delade styrkan är ungefär lika mellan de två; den senare föreningen (den som nästan liknar substratklassen av dopaminerga frisättande medel som liknar fenmetrazin ) är 8,3 gånger mer potent @ DA-upptag.
- ɑ Föreningar testade som hydrokloridsalter (HCl) om inget annat anges.
- b % hämning orsakad av 5 μM
- c % hämning orsakad av 10 μM , analyserad med SRI
- d Testad som fri bas
- e Analyserad med SRI (lämplig korrektionsfaktor tillämpad.)
- f % hämning av 10 μM förening.
- g Värden uttryckta som x ± SEM av 2–5 replikattest. (Om ingen SEM visas är värdet för n av 1.)
- h Ej fastställt
- jag jfr. fenmetrazin och derivat
Olika MPH- kongener affinitetsvärden inklusive noradrenalin och serotonin
Värden för dl - treo -metylfenidatderivat är medelvärdet ( sd ) av 3—6 bestämningar, eller är medelvärdet av dubbla bestämningar. Värdena för andra föreningar är medel-sd för 3-4 bestämningar där så anges, eller är resultat av enstaka experiment som överensstämmer med litteraturen. Alla bindningsexperiment utfördes i tre exemplar.
| Förening | DA | DA Upptag | NE | 5HT |
|---|---|---|---|---|
| Metylfenidat | 84 ± 33 | 153 ± 92 | 514 ± 74 | >50 000 |
| o- Brommetylfenidat | 880 ± 316 | — | 20 000 | — |
| m -Brommetylfenidat | 4 ± 1 | 18 ± 11 | 20 ± 6 | 3 800 |
| p- Brommetylfenidat | 21 ± 3 | 45 ± 19 | 31 ± 7 | 2 600 |
| p- hydroximetylfenidat | 125 | 263 ± 74 | 270 ± 69 | 17 000 |
| p- metyloximetylfenidat | 42 ± 24 | 490 ± 270 | 410 | 11 000 |
| p- Nitrometylfenidat | 180 | — | 360 | 5 900 |
| p- jodmetylfenidat | 26 ± 14 | — | 32 | 1 800 ɑ |
| m -jod- p -hydroximetylfenidat | 42 ± 21 | 195 ± 197 | 370 ± 64 | 5 900 |
| N- metylmetylfenidat | 1 400 | — | 2 800 | 40 000 |
| d - treo -Metylfenidat | 33 | — | 244 ± 142 | >50 000 |
| l - treo -Metylfenidat | 540 | — | 5 100 | >50 000 |
| dl - erytro - o -Brommetylfenidat | 10 000 | — | 50 000 | — |
| Kokain | 120 | 313 ± 160 | 2 100 | 190 |
| VINN 35 428 | 13 | — | 530 | 72 |
| Nomifensin | 29 ± 16 | — | 15 ± 2 | 1 300 ɑ |
| Mazindol | 9 ± 5 | — | 3 ± 2 | 92 |
| Desipramin | 1 400 | — | 3.5 | 200 |
| Fluoxetin | 3 300 | — | 3 400 | 2.4 |
- ɑ Anger att framställning av membran och resultat som extrapolerats därifrån härrörde från frusen vävnad, som är känd för att ändra resultat vid tolkning mot experiment med färsk vävnad.
p- hydroximetylfenidat uppvisar låg hjärnpenetrabilitet, vilket tillskrivs dess fenoliska hydroxylgrupp som genomgår jonisering vid fysiologiskt pH .
Se även


Anteckningar
Vidare läsning
- Gatley SJ, Pan D, Chen R, Chaturvedi G, Ding YS (1996). "Affiniteter av metylfenidatderivat för dopamin, noradrenalin och serotonintransportörer". Livsvetenskap . 58 (12): 231–9. doi : 10.1016/0024-3205(96)00052-5 . PMID 8786705 .
- Lapinsky DJ, Velagaleti R, Yarravarapu N, Liu Y, Huang Y, Surratt CK, et al. (januari 2011). "Azido-jod-N-bensylderivat av treo-metylfenidat (Ritalin, Concerta): Rationell design, syntes, farmakologisk utvärdering och dopamintransportör fotoaffinitetsmärkning" . Bioorganisk och medicinsk kemi . 19 (1): 504–12. doi : 10.1016/j.bmc.2010.11.002 . PMC 3023924 . PMID 21129986 .
- Froimowitz M, Gu Y, Dakin LA, Nagafuji PM, Kelley CJ, Parrish D, et al. (januari 2007). "Långsamt insättande, långvariga, alkylanaloger av metylfenidat med ökad selektivitet för dopamintransportören". Journal of Medicinal Chemistry . 50 (2): 219–32. doi : 10.1021/jm0608614 . PMID 17228864 .
- Davies HM, Hopper DW, Hansen T, Liu Q, Childers SR (april 2004). "Syntes av metylfenidatanaloger och deras bindningsaffiniteter vid dopamin- och serotonintransportställen". Bokstäver inom bioorganisk och medicinsk kemi . 14 (7): 1799–802. doi : 10.1016/j.bmcl.2003.12.097 . PMID 15026075 .
- Froimowitz M, Gu Y, Dakin LA, Kelley CJ, Parrish D, Deschamps JR (juni 2005). "Vinyloga amidanaloger av metylfenidat". Bokstäver inom bioorganisk och medicinsk kemi . 15 (12): 3044–7. doi : 10.1016/j.bmcl.2005.04.034 . PMID 15908207 .
- Schweri MM, Deutsch HM, Massey AT, Holtzman SG (maj 2002). "Biokemisk och beteendemässig karakterisering av nya metylfenidatanaloger" . Journal of Pharmacology and Experimental Therapeutics . 301 (2): 527–35. doi : 10.1124/jpet.301.2.527 . PMID 11961053 . S2CID 314970 .
- Volz TJ, Bjorklund NL, Schenk JO (september 2005). "Metylfenidatanaloger med beteendeskillnader interagerar annorlunda med argininrester på dopamintransportören i råttstriatum". Synaps . 57 (3): 175–8. doi : 10.1002/syn.20161 . PMID 15945061 . S2CID 24352613 .
- Lapinsky DJ, Yarravarapu N, Nolan TL, Surratt CK, Lever JR, Tomlinson M, et al. (maj 2012). "Utveckling av en kompakt fotosond för dopamintransportören baserad på (±)-treo-metylfenidat" . ACS Medicinal Chemistry Letters . 3 (5): 378–382. doi : 10.1021/ml3000098 . PMC 3469269 . PMID 23066448 .
- Deutsch HM, Ye X, Shi Q, Liu Z, Schweri MM (april 2001). "Syntes och farmakologi av platsspecifika kokainmissbruksbehandlingsmedel: en ny syntetisk metod för metylfenidatanaloger baserad på Blaise-reaktionen". European Journal of Medicinal Chemistry . 36 (4): 303–11. doi : 10.1016/s0223-5234(01)01230-2 . PMID 11461755 .