Marginal zon B-cells lymfom
| Marginal zon B-cells lymfom | |
|---|---|
| Andra namn | Marginalzonens lymfom (MZL) |
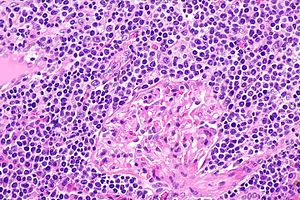 | |
| EMZL-infiltrerande njurvävnad. | |
| Typer | Extranodal marginal zon lymfom, mjält marginal zone lymfom och nodal marginal zon lymfom. |
B-cellslymfom i marginalzonen , även känd som marginalzonslymfom ( MZL ), är en heterogen grupp av lymfom som härrör från den maligna transformationen av B-celler i marginalzonen . Marginalzon B-celler är medfödda lymfoida celler som normalt fungerar genom att snabbt montera IgM- antikroppsimmunsvar mot antigener såsom de som presenteras av smittämnen och skadade vävnader. De är lymfocyter av B-cellinjen som har sitt ursprung och mognar i sekundära lymfoida folliklar och som sedan flyttar till marginalzonerna av slemhinneassocierad lymfoid vävnad ( dvs. MALT), mjälten eller lymfkörtlarna . Slemhinneassocierad lymfoid vävnad är ett diffust system av små koncentrationer av lymfoid vävnad som finns i olika submukosala membranplatser i kroppen såsom mag-tarmkanalen , mun , näshåla , svalg, sköldkörtel , bröst , lunga , spottkörtlar , ögon , hud och den mänskliga mjälten .
2016 klassificerade Världshälsoorganisationen MZL i tre olika typer. Extranodala marginalzonslymfom (EMZL) är MZL som utvecklas i extranodala vävnader. De flesta EMZL utvecklas i MALT och kallas ofta extranodal MZL av slemhinneassocierad lymfoid vävnad eller, enklare, MALT-lymfom. Mjältens marginalzonslymfom (SMZL) är MZL som initialt är begränsade till mjälten, benmärgen och blodet. Nodal marginal zone lymfom (NMZ) är MZL som initialt är begränsad till lymfkörtlar, benmärg och blod. Även om alla dessa MZL involverar maligna B-celler, skiljer de sig inte bara i de vävnader de involverar utan också i deras patofysiologi , kliniska presentationer, prognoser och behandlingar.
MZL representerar 5–17 % av alla non-Hodgkin-lymfom med de extranodala, mjält- och nodalformerna som står för 50–70 %, ~20 % och ~10 % av alla MZL. De tre MZL-subtyperna förekommer oftare hos äldre (65–68 år) och är indolenta sjukdomar som hos personer utan symtom initialt kan behandlas med en vaksam väntestrategi . NMZL har dock ett något sämre långsiktigt utfall än de andra subtyperna och någon av MZL-subtyperna kan i en låg andel av fallen utvecklas till ett mer aggressivt lymfom, särskilt diffust storcelligt B-cellslymfom . En av de mest utmärkande egenskaperna hos MZL är att många fall är förknippade med den ihållande simuleringen av immunsystemet av den kroniska inflammation som åtföljer infektioner eller autoimmuna sjukdomar . MZL-fall associerade med vissa infektiösa patogener kan botas genom behandling riktad mot de patogener som orsakar eller förknippas med dessa infektioner.
Extranodal marginalzon lymfom
EMZL är en form av MZL där maligna B-celler i marginalzonen initialt infiltrerar MALT-vävnader i magen (50-70 % av all EMZL) eller, mindre ofta, matstrupen , tunntarmen , tjocktarmen , ändtarmen , ögats bindhinna . , näsgångar , svalg , lungbronkier , vulva , vagina , hud , bröst , brässkörtel , hjärnhinnor (dvs membran ) som omsluter hjärnan och ryggmärgen eller andra organ. Dessa EMZL klassificeras i undertyper baserat på det eller de inblandade organen. Till exempel kallas EMZL i magen för primär gastrisk EMZL. Oavsett subtyp delar dessa EMZL liknande patofysiologiska (dvs. störda fysiologiska processer som orsakar sjukdomen) och histopatologiska (dvs mikroskopiska egenskaper hos sjuka vävnader ). Men subtyperna skiljer sig åt i presentation, progression, svårighetsgrad, behandling och anstiftande faktorer. Följande två avsnitt beskriver de vanliga patofysiologiska och histopatologiska egenskaperna som finns i alla EMZL-subtyper. Funktioner som är specifika för varje EMZL-undertyp följer dessa två avsnitt. [ citat behövs ]
Patofysiologi

Många faktorer verkar vara involverade i utvecklingen av EMZL. I ett litet antal fall har sjukdomen en ökad frekvens hos patienter som har en familjehistoria av en hematologisk malignitet, särskilt leukemi, eller olika autoimmuna sjukdomar som Sjögrens syndrom och lupus erythematosus . Nedärvda genetiska, delade miljöfaktorer och andra ännu oidentifierade faktorer kan ligga bakom dessa ökade risker för att utveckla en EMZL. En annan nyckelfaktor i initieringen av många EMZL-fall är kronisk inflammation orsakad av en kronisk infektion eller autoimmun reaktion. Den kroniska inflammationen stimulerar B-celler att omordna sina immunglobulin-tungkedjelokus så att de kodar för B-cellsreceptorer som känner igen onaturliga antigener som presenteras av de skadade problem och/eller infektionsämnen som ligger till grund för inflammationen. Denna omarrangering resulterar i att B-cellerna svarar på de onormala antigenerna genom att ta på sig egenskaper hos marginala B-celler och föröka sig överdrivet. celler progressivt på ett stegvis sätt kromosomavvikelser , genmutationer och/eller oreglerade gener som bidrar till att de blir maligna. De förvärvade genomiska abnormiteterna som finns i EMZL tillsammans med frekvensen av förekomst i specifika EMZL-subtyper inkluderar följande. [ citat behövs ]
- Kromosomtranslokationer : 1) En translokation av den långa (eller "q") armen av kromosom 11 vid position 21 med q-armen av kromosom 18 vid position 21 (noterad som vid(11;18)(q21;q21) translokation) inträffar i 24% av mag-, 38% av lungor och sällan andra EMZL-subtyper. Denna translokation placerar en del av API2 -genen med en del av MALT1 -genen för att skapa en fusionsgen som kodar för ett Api2-Malt1- fusionsprotein . Detta chimära protein främjar den kontinuerliga aktiveringen av en transkriptionsfaktor , NF-KB . NF-KB kontrollerar uttrycket av olika gener som ökar överlevnaden, cytokinproduktionen och andra potentiellt maligna beteenden hos celler. 2) En t(14;18)(q32;q21) translokation inträffar i 7 % av okulär adnexa, 6 % av lungan och sällan om alls i andra fall av EMZL. Det orsakar överuttryck av Malt1. Detta protein hämmar indirekt programmerad celldöd för att förlänga cellöverlevnad och främjar även aktivering av NF-KB. 3) En t(1;14)(p22;q32) ("p" står för en kromosoms korta arm) translokation sker i ~9% av lungorna, ~4% av magen och sällan om alls i andra fall av EMZL . Denna translokation orsakar överuttryck av BCL10 -genen. Bcl10-protein bidrar till aktiveringen av NF-KB. 4) En t(3;14)(p13;q32)-translokation inträffar i sällsynta fall av EMZL och tros orsaka överuttryck av FOXP1- genen . FoxP1-protein stimulerar produktionen av transkriptionsfaktorer såsom PRDM1 , IRF4 och XBP1 som främjar mognaden av B-celler till plasmaceller. 5) Tre translokationer, t(1;14)(p21;q32), t(5;14)(q34;q32), t(9;14)(p24;q32) och t(X;14)(p11) .4;q32), förekommer i sällsynta fall av EMZL men deras effekter på att främja malignitet är okända.
- Geninaktiveringar och -mutationer: 1) Inaktivering eller TNFAIP3 -genen på grund av dess deletion på kromosom 6 omkring position 23 (dvs. en 6q23-deletion) eller dess mutation förekommer huvudsakligen i okulär adnexa, spottkörtel och sköldkörtel EMZL. TNFAIP3- inaktivering sker vanligtvis i fall som inte har någon av ovanstående kromosomtranslokationer. Denna gens produkt, tumörnekrosfaktor, alfa-inducerat protein 3, fungerar för att försämra aktiveringen av NF-KB. 2) Gain-of-function mutationer i MYD88 -genen förekommer i ~5% av fallen med okulär adnexa EMZL. Produkten av denna gen, myeloid differentiering primärt svar 88, aktiverar kontinuerligt NF-KB såväl som STAT3 och AP1 transkriptionsfaktorerna. 3) Inaktiverande mutationer i generna NOTCH1 (8 % av alla fall) och NOTCH2 (8 % av alla fall) förekommer i EMZL. Produkterna av dessa gener är cellytreceptorproteiner som när de binds till sina aktiverande ligander flyttar till cellkärnan och bidrar till aktiveringen av gener som styr utvecklingen, proliferationen, överlevnaden och migrationen av B-celler.
Många EMZL-subtyper är associerade med infektionsämnen eller autoimmuna sjukdomar som kan bidra till deras maligna utveckling. Följande tabell rapporterar om dessa EMZL-undertyper; vävnaderna de involverar; de infektionsämnen/autoimmuna sjukdomar som kan ligga bakom utvecklingen av EMZL-subtyperna; styrkan av bevis som kopplar dessa infektionsämnen/autoimmuna sjukdomar till deras malignitet; förekomsten (dvs. procent) av fall med EMZL-subtypen associerad med infektionsämnet/autoimmun sjukdom; och några av de chimära generna som uttrycks av de neoplastiska B-cellerna av EMZL-subtypen. [ citat behövs ]
| Undertyp | Inblandade vävnader | Smittämne eller autoimmun sjukdom | Bevisets styrka | Frekvens | Chimära gener uttryckta (procentandel av fallen) | |
|---|---|---|---|---|---|---|
| Primär mag-EMZL | mage | Helicobacter pylori | bekräftad | ~80 % | BIRC3-MALT1 (23%), IGH-FOXP1 (3%), IGH-BCL-10 (2%) och IGH-MALT1 (1%) | |
| Primär mag-EMZL | mage | Helicobacter heilmannii sensu lato | troligt | <1 % | liknande antibiotika som används för Helicobacter pylori | |
| Primär spottkörtel EMZL | spott- och tårkörtlar | Sjögrens syndrom | bekräftad | ~4,3 % | IGH-MALT1 (6 %), BIRC3-MALT1 (2 %) och IGH-BCL-10 (1 %) | |
| Primär sköldkörtel EMZL | sköldkörtel | Hashimotos tyreoidit | bekräftad | ~0,5 % | ICH-FOXP1 (50 %) och BIRC3-MALLT1 (9 %) | |
| Primär okulär adnexa EMZL | okulär adenexa (dvs orbit , bindhinna och ögonlock ) | Chlamydia psittaci | suggestiva | 10–50 % | IGH-FOXP1 (20 %), IGH-MALT1 16 %) och BIRC3-MALT1 (7 %) | |
| Primär kutan EMZL | hud | Borrelia burgdorferi | suggestiva | variabel | IGH-FOXP1 (10 %), IGH-MALT1 (7 %) och BIRC3-MALT1 (4 %) | |
| Primär tunntarms-EMZL | tunntarm | Campylobacter jejuni | låg | variabel | BIRC3-MALT1 (19 %) och IGH-BCL10 (7 %) | |
| Primär pulmonell EMZL | lunga | Achromobacter xylosoxidans | låg | <50 % | BIRC3-MALT1 (45 %), IGH-BCL10 (8 %) och IGH-MALT1 (7 %) |
Histopatologi
Den histopatologiska (dvs. mikroskopiska) undersökningen av EMZL- lesioner avslöjar vanligtvis ett vagt nodulärt eller diffust mönster av celler. De maligna cellerna i dessa lesioner har, i varierande proportioner, morfologin hos små till medelstora lymfocyter, centrocytliknande B-celler, centroblastliknande B-celler, monocytliknande B-celler, plasmacellliknande B-celler och /eller stora B-celler. När de stora B-cellerna bildar framträdande ark som är tydligt separerade från celler med de andra, låggradiga maligna morfologierna, kan sjukdomen förvandlas till den mycket mer aggressiva maligniteten, diffust storcelligt B-cellslymfom . Denna transformation inträffar hos ~18% av patienterna med en median på 4–5 år efter den ursprungliga diagnosen EMZL. Immunfenotypning eller de neoplastiska stora B-cellerna i dessa lesioner visar att de uttrycker CD20 men inte CD3 ytmembran B-cellmarkörproteiner. Cellerna uttrycker nästan alltid BCL2 och kan uttrycka MNDA (~70% av fallen), CD23 (~33% av fallen) och CD5 (~20% av fallen) markörproteiner men uttrycker inte cyklin D1- markörproteinet., T. -cellmarkör, CD10 eller BCL6 .
Undertyper, diagnos, behandling och prognos
Det finns olika EMZL-subtyper baserat på de organ de involverar. Nästan alla dessa subtyper förekommer i den slemhinneassocierade lymfoidvävnaden i det drabbade organet och kallas ofta för MALT-lymfom i det drabbade organet (t.ex. mag-MALT-lymfom). Dessa lymfom kallas emellertid också för primär EMZL i det drabbade organet (t.ex. primär gastrisk EMZL). Medan båda termerna används här för dessa subtyper, föredras den primära (inblandade organet) EMZL för att indikera att EMZL-subtypen initialt utvecklades i och kan förbli begränsad till den angivna vävnaden. Emellertid sprids cirka 30 % av fallen till andra platser, främst lymfkörtlar och i sällsynta fall till benmärgen . De maligna B-cellerna i dessa subtyper kan också cirkulera i blodet men detta är mycket ovanligt. Oavsett subtyp av EMZL eller dess spridning till andra vävnader, är prognosen för dessa lymfom god med 5 års totala överlevnad i allmänhet mellan 86 % och 95 %.
Primär magsäck
Primärt gastriskt EMZL, även kallat primärt gastriskt MALT-lymfom eller, oftare, bara gastriskt MALT-lymfom, är vanligtvis en indolent sjukdom som i ~10% av fallen även involverar andra GI-kanal- och/eller icke-GI-kanalställen. Patienter uppträder vanligtvis i ett tidigt skede av sjukdomen med olika symtom som illamående , kräkningar, matsmältningsbesvär, smärta i övre delen av buken och magblödning, vilket indikeras av hosta upp blod, blodiga tarmrörelser och/eller järnbristanemi . I sällsynta fall uppvisar patienter perforering av magen eller B-symtom som feber och nattliga svettningar . Individer med kronisk Helicobacter pylori -infektion kan också ha halitosis . Endoskopisk inspektion och biopsi av lesioner och endoskopisk baserad ultraljudsinspektion av övre mag-tarmkanalen visar lesioner, oftast i magsäckens pylorusantrium , som är ytliga slemhinneerosion, grunda sår, knölar, förstorade rugae och/eller förtjockningar av magsäcken. . Histopatologin för primära MALT-lesioner i magen och markörproteinerna och genomiska abnormiteter som uttrycks av de maligna cellerna i dessa lesioner ges i avsnittet Histopatologi. Primär gastrisk EMZL är associerad med infektion i magen med Helicobacter pylori i >80 % av fallen eller med Helicobacter heilmannii sensu lato i <1 % av fallen. Indikationer på att gastrisk Helicobactor pylori är orsaken till gastrisk EMZL inkluderar: ett positivt urea utandningstest ; ett positivt avföringstest som detekterar ett antigen av patogenen i patientens avföring; ett positivt ureastest i ett biopsierat vävnadsprov; ett positivt serum- eller helblodstest med användning av specifika antikroppar riktade mot patogenen; och tillväxt av patogenen i vävnadskulturer av en biopsierad vävnad. Helicobacter heilmannii sensu lato betecknar minst 11 olika Helicobactor- arter av vilka 5 är kända för att infektera människans mage. Det har varit svårare att avgöra att Helicobacter heilmannii sensu lato är ansvarig för mänsklig magsjukdom eftersom urea utandningstestet är mindre ofta positivt vid angrepp av dessa arter, antikroppar riktade mot dem är i allmänhet inte tillgängliga och de är svåra att odla i kultur. . Diagnosen av Helicobacter heilmannii sensu lato beror därför på att man histologiskt detekterar organismen i vävnader eller fekalt material med hjälp av speciella silverfärgningsmetoder och sedan sekvenserar vissa gener (t.ex. ureas A, ureas B, värmechockprotein 60 och/eller gyrassubenhet B) i organismernas DNA och/eller organismernas 23sRNA. Behandlingen av lokaliserad (dvs. Ann Arbor stadium I och II) Helicobactor pylori -positiv primär gastrisk EMZL använder något av flera olika Helicobacter pylori- utrotningsprotokoll . Dessa protokoll inkluderar en protonpumpshämmare (t.ex. omeprazol eller lansoprazol ) plus någon av flera olika antibiotikakombinationer (t.ex. klaritromycin + amoxicillin eller levofloxacin + nitazoxanid + doxycyklin ). Den exakta läkemedelsregimen väljs baserat på den kända eller misstänkta resistensen hos patogenen mot dessa antibiotika i enskilda fall. Regimen ges i 7–14 dagar och följs upp med testning inom 4 veckor för förekomsten av patogenen genom urea-andnings- eller avföringsantigentest. Om den initiala kuren inte lyckas utrota patogenen, behandlas patienterna med en andra kur med en kombination av tre eller fyra läkemedel (t.ex. en protonpumpshämmare + vismutsubcitrat + tetracyklin + metronidazol ) . Utrotning av patogenen är framgångsrik i 70–95 % av fallen. Nyligen har en sekventiell behandlingsregim (dvs. en protonpumpshämmare + amoxicillin följt av en protonpumpshämmare + klaritromycin + Tinidazol ) rapporterats utrota patogenen i >90 % av fallen. Patienter som har lesioner som hyser vid(11;18) eller t(1;14) kromosomal translokation och därför uttrycker det chimära proteinet BIRC3-MALT1 respektive IGH-BCL10, har en ökad förekomst av att vara resistenta mot Helicobactor pylori- utrotningsprotokollen . Cirka 50-80 % av patienterna som har erfarit utrotning av patogenen utvecklar inom 3–28 månader en remission och långvarig klinisk kontroll av sitt lymfom. Strålbehandling av magen och omgivande (dvs peri-gastriska) lymfkörtlar har använts för att framgångsrikt behandla: a) lokaliserad Helicobactor pylori -positiv primär gastrisk EZML där patogenen inte har utrotats av de angivna läkemedelsprotokollen; b) lokaliserade Helicobactor pylori -negativa primära gastriska EZML-fall; och c) Helicobactor pylori -positiva och -negativa EZML-fall hos äldre eller svaga patienter. Patienter med systemisk (dvs. Ann Arbor stadium III och IV ) primär gastrisk EMZL som är fria från symtom har behandlats med vaksam väntan eller om symtomatiskt behandlats med immunterapiläkemedlet rituximab ( givet i 4 veckor) kombinerat med klorambucil givet i 6– 12 månader; 58 % av dessa patienter uppnår en 58 % progressionsfri överlevnad efter 5 år. Patienter med svaga stadium III/IV har framgångsrikt behandlats med enbart rituximab eller cyklofosfamid . Medan behandlingen av Helicobactor heilmanni sensu lato beror på mycket färre studier, följer den i allmänhet de rekommendationer som används för behandling av Helicobactor pylori.
Primär tunntarm
Primärt MZL i tunntarmen, även kallat primärt MALT-lymfom i tunntarmen, uppträder vanligen med kolikiga buksmärtor, diarré och i fall av avancerade sjukdomstecken och symtom på malabsorption (t.ex. viktminskning, undernäring och anemi), tunntarmsobstruktion , ascites ( dvs vätska i bukhålan) och/eller förstoringar av lymfkörtlar, mjälte och/eller lever. Även om det i allmänhet är en progressiv sjukdom, kan patienter med primär MZL i tunntarmen i ett tidigt stadium få spontana och fullständiga remissioner. Immunproliferativ tunntarmssjukdom , tidigare kallad medelhavslymfom eller ansett som en typ av alfa-tungkedjesjukdom (IgA/αHCD), är en variant och den i särklass vanligaste formen av tunntarms-MZL. Denna variant är endemisk i länder i Medelhavsområdet , särskilt de i Mellanöstern, även om fall av denna sjukdom har hittats över hela världen vanligtvis men inte alltid hos invandrare från Mellanöstern. I dess endemiska områden utgör immunproliferativ tunntarmssjukdom ~30% av alla GI-taktlymfom, drabbar främst individer 20–30 år gamla som har låg socioekonomisk status och är associerad med infektion av den livsmedelsburna bakterien Campylobacter jejuni . Campylobacter jejuni -associerad sjukdom är vanligare hos individer som uttrycker humant leukocytantigen AI19, B12 eller A9 eller är blodgrupp B. Det föreslås att dessa individer är genetiskt disponerade för att utveckla sjukdomen. Immunfärgning av tunntarmsskador i dessa fall upptäcker vanligtvis närvaron av Campylobacter jejuni och är förutsägande att sjukdomen kommer att svara på antibiotika. Det är dock inte klart att denna bakterie är den faktiska orsaken till immunproliferativ tunntarmssjukdom: den kan bara kolonisera tarmen hos individer med sjukdomen medan andra ännu oidentifierade antibiotikakänsliga bakterier eller icke-bakteriella patogener, t.ex. parasiter , ligger bakom sjukdomens utveckling.
I primära tunntarms-EMZL-fall avslöjar dubbelballong enteroskopi och kapselendoskopi förekomsten av omfattande slemhinneerosion och/eller, mindre vanligt, polyper, knölar, massor och/eller ärrbildning. Dessa lesioner lokaliseras till duodenum, jejunum eller ilium i cirka 63, 17 respektive 8 % av fallen, eller involverar mer än ett tunntarmsställe i ~17 % av fallen. Lesionerna består av lymfocyter, atypiska plasmaceller och, mindre vanligt, centrocytliknande celler infiltrerar i intestinal lamina propria med de lymfocyter och centrocytliknande celler som uttrycker markörproteiner (t.ex. CD20 och CD79a) som är typiska för EMZL. Campylobacter jejuni detekteras i dessa lesioner genom immunfärgning . Patienter med denna sjukdom har vanligtvis en monoklonal gammopati som bevis genom närvaron av en monoklonal antikropp som består av fragmentet av den kristalliserbara regionen av den tunga IgA -kedjan i deras blod, jejunumjuice och/eller, sällan, urin. Det onormala IgA-proteinet detekteras i patienternas sera genom immunfixering med användning av en antikropp riktad mot det tunga kedjefragmentet av IgA.
Behandlingen av primär tunntarms-EMZL har fokuserat på näringsstöd och kontroll av symtom inklusive kirurgi och/eller strålbehandling för att behandla tarmobstruktioner och mycket lokaliserad sjukdom. Studier indikerar dock att individer med sjukdomen, särskilt de med immunproliferativ tunntarmssjukdom, har en total svarsfrekvens på ~90 % efter behandling med bredspektrumantibiotika som tetracyklin, metronidazol eller tetracyklin + ampicillin. Dessa svar är varaktiga i de flesta fall. Följaktligen rekommenderas antibiotikabehandling för att behandla sjukdomar i ett tidigt stadium. Patienter som är refraktära mot antibiotikabehandling har behandlats med kemoterapi (dvs. CHOP eller CHOP-liknande behandlingar) följt av långvarigt underhåll med tetracyklin. Denna behandlingsregim har uppnått 5 års total överlevnad på 70 %. Eftersom kirurgi och strålbehandling inte är botande för sjukdomen har höga doser kemoterapiregimer och autolog stamcellstransplantation rekommenderats för refraktär och/eller återfallande sjukdom.
Kolorektala EMZL
ENZL som involverar tjocktarmen eller ändtarmen är extremt sällsynta. I en genomgång 2019 av 73 fall hade personer som diagnostiserades med en av dessa ENZL-subtyper en medianålder på 62 år (intervall 26–72), var övervägande kvinnor (66 %) och hade sina primära tumörer lokaliserade i ändtarmen (74 % av fallen), höger kolon (13,6 %), tvärgående tjocktarm (4,1 %) eller sigmoid tjocktarm (8,2 %). Trettio procent av dessa individer hade flera tumörer, av vilka ~40% var på platser i mag-tarmkanalen utanför tjocktarmen och ändtarmen. Dessa individer behandlades initialt och uppnådde fullständig remission med lokal kirurgisk resektion i 18 av 19 fall, mer omfattande kirurgisk resektion i 18 av 19 fall, kemoterapi i 12 av 13 fall, strålbehandling (i 4 av 5 fall, eller antibiotikabehandling för att uppnå Helicobacter pylori -utrotning i 12 av 15 fall. Två individer fick ingen behandling med en av dessa som hade en spontan remission. De 8 fallen som inte uppnådde en fullständig remission krävde andra linjens behandling; 3 fall var remissionsfel. Följande avsnitt beskriver dessa två ytterligare EMZL-undertyper.
Primär kolon
Primärt kolon EMZL, även kallat primärt kolon MALT-lymfom, uppträder vanligtvis i ett tidigt stadium av sjukdomen med tecken på blödning i nedre GI-kanalen (t.ex. tjärartad tarmrörelse och/eller järnbristanemi), mindre vanligt med smärta i nedre delen av magen och sällan med tarm . perforation eller intussusception . Endoskopisk undersökning avslöjar oftast en enda polyp eller sällan flera polyper, ett slemhinnesår eller en slemhinneknöl. Diagnos ges på biopsi av lesionerna som visar en histologi som är typisk för EMZL, t.ex. diffusa infiltrat bestående av små till medelstora lymfocyter som kan visa morfologiska egenskaper hos monocyter och/eller plasmaceller. Lymfocyterna i dessa lesioner uttrycker B-cellsmarkörer (t.ex. CD19 och CD79a) som är typiska för EMZL-lesioner. Den bästa behandlingsregimen för detta lymfom diskuteras. Kirurgisk resektion, endoskopisk resektion, strålning och kemoterapi har använts. Kirurgi följt av kemoterapi ( mitoxantron + klorambucil + prednison eller cyklofosfamid + vinkristin + prednison kombinerat med antingen klorambucil eller rituximab ) har betraktats som förstahandsbehandling för sjukdomen. På senare tid har rituximab ensamt som ett enda medel också visat sig vara framgångsrikt vid behandling av primärt kolon MALT-lymfom. Slutligen har sällsynta fall av primär kolon EMZL lösts helt med Helicobacter pylori antibiotikabehandling.
Primär rektal
Primärt rektalt EMZL, mer allmänt kallat MALT-lymfom i ändtarmen, uppträder vanligtvis i ett tidigt stadium av sjukdomen med analblödning och/eller blod i avföringen . Endoskopisk undersökning avslöjar en rektal polyp, rektal massa eller, mindre vanligt, ett rektalt sår. Vissa fall av detta lymfom har rapporterats gå tillbaka spontant. Vid undersökning visar >90 % av fallen lokaliserad (dvs. stadium I eller II) sjukdom. Lymfomens lesioner kännetecknas av reaktiva lymfoida folliklar infiltrerade med centrocytliknande eller monocytliknande B-celler (de senare cellerna kan visa egenskaper hos plasmaceller ). De maligna cellerna i dessa lesioner kan innehålla t(11;18)-translokationen och uttrycker därför det chimära API2-MALT1-proteinet (11 % av fallen). Cirka 22-45% av fallen är associerade med Helicobactor pylori GI-kanalinfektion. Behandlingar för sjukdomen har innefattat strålbehandling, kirurgisk resektion, endoskopisk slemhinneresektion, olika kemoterapier och antibiotikabaserad utrotning av Helicobactor pylori. Eradikeringsterapi för Helicobactor pylori -positiva fall med användning av för närvarande rekommenderade standardantibiotikakurer har gett fullständiga svar i 12 av 19 fall och anses därför vara korrekt behandling för sådana fall. Kirurgisk resektion för lokaliserad sjukdom har uppnått långtidsöverlevnad i enskilda fall. Strålbehandling för lokaliserad sjukdom har dock gett 5-års sjukdomsfri och total överlevnad på 76 % respektive 96 % i 16 av 19 granskade fall och föreslås vara den föredragna behandlingen för patienter med Helicobactor pylori-positiv primär rektal EMZL.
Primär matstrupe
Primär EMZL i matstrupen, även kallad MALT-lymfom i matstrupen, är extremt sällsynt och de flesta fall av det rapporteras från Japan. Det ger symtom på svår att svälja och/eller förnimmelser av en främmande kropp i matstrupsområdet. Endoskopi , endosonografi och CT-skanningar av bröstkorgen avslöjar en ensam matstrupsmassa av varierande storlek eller, vanligare, en linjär central fördjupning eller ås i matstrupen. I en granskning 2017 hade 6 av 18 patienter med EMZL i matstrupen tecken på samtidig Helicobacter pylori- infektion. Histopatologin för lesionerna i EMZL i matstrupen är typisk för EMZL genom att visa närvaron av centrocytliknande celler, monocytliknande celler och små lymfocyter som uttrycker CD20 men inte CD10. Behandling av EMZL i matstrupen har bestått av endoskopisk resektion, kirurgisk resektion, strålbehandling, endoskopisk resektion plus strålbehandling eller kemoterapi. De flesta patienter visar ett fullständigt svar på dessa ingrepp. Den långsiktiga effekten av dessa svar är dock inte känd eftersom behandlingsuppföljningstiderna har varit korta (6–35 månader). Systematisk antibiotikabaserad eradikeringsterapi för att behandla Helicobactor pylori -associerad EMZL i matstrupen hade inte rapporterats förrän ett nyligen inträffat fall av sjukdomen behandlades med vonoprazan + amoxicillin + klaritromycin under 1 vecka. Patienten visade bevis för att utrota bakterien baserat på ett urea-andningstest, men inte desto mindre visade lymfomet progression.
Primär okulär adnexa
Primärt okulärt adnexa EZML (även kallat primärt EMZL av det okulära adnexa, primärt okulärt adnexa MALT-lymfom eller primärt MALT-lymfom i det okulära adnexan) förekommer främst hos äldre patienter (medianåldern 65 år). Individer kan vara predisponerade för sjukdomen genom att ha en lång historia av exponering för boskap, främst nötkreatur och grisar eller arbeta med kött från dessa djur; autoimmuna sjukdomar, speciellt autoimmun sköldkörtelsjukdom; och infektioner, särskilt Clamydophelia psittaci , en smittbar intracellulär bakterie som infekterar vilda fåglar, husdjur och människor. Hos människor orsakar det respiratorisk psittacosis och ögoninfektioner, särskilt kronisk konjunktivit . Clammydophelia psittaci har upptäckts i lesionerna hos 47-80 % av patienterna med primär okulär adnexa EMZL, och de högsta frekvenserna av denna upptäckt inträffade i Italien, Österrike, Tyskland och Korea. Mycket lägre upptäcktshastigheter rapporteras i Storbritannien och södra Kina medan det har funnits få eller inga bevis för denna organism i fall från USA och Japan. Gastrisk Helicobactor pylori -infektion eller Hepatit C-virusinfektion har rapporterats vara associerad med primär okulär adnexa EZZML i ~33% respektive 2-36% av fallen; i sällsynta fall har sjukdomen också associerats med Herpes simplex virus 1 , Herpes simplex 2 , adenovirus 8 , adenovirus 19 , Chlamydia trachomatis eller Chlamydophila abortus infektion. Sambandet mellan dessa infektioner och utvecklingen och/eller progressionen av primär okulär adnexa EZML är oklar.
Patienter uppvisar konjunktivala (25 % av fallen) eller intraorbitala (75 % av fallen) lesioner som vanligtvis involverar ett öga men i 10-15 % av fallen, särskilt i konjunktivala fall, involverar båda ögonen. Konjunktiva lesioner uppträder vanligtvis som en laxröd fläck som täcker det yttre lagret av ögongloben; intraorbitala lesioner uppträder vanligen som exoftalmos (dvs. en utbuktning av ögat) (27 % av fallen), en palpabel ögonmassa (19 %), ptos (dvs. ögonlocket hänger) (6 %) och/eller, mindre vanligt, dubbelsidighet (dvs dubbelseende), nedsatt orbital rörlighet, överdriven tårbildning och/eller orbitala knölar. Patienter med konjunktivasjukdom kan vara asymtomatiska. En variabel procentandel av patienter med primär okulär adnexa MZL kan samtidigt påverkas av Hashimotos tyreoidit , Sjögrens syndrom eller IgG4-relaterad sjukdom . Vissa studier har också funnit att sjukdomen är associerad med Helicobactor pylori -infektion i magen (45 % av fallen) eller EMZL i andra vävnader (25 % av fallen). Lesionerna i primär okulär adnexa EMZL är typiska för EMZL: de innehåller centrocytliknande B-celler, monocytliknande B-celler och/eller små lymfocyter av vilka många uttrycker CD20, CD791, PAZ5 och BCL2 men inte CD10 eller cyklin D1-proteiner. t(1:14)(p22:q320-kromosomtranslokationen, som leder till överuttryck av MALT1 -genen, trisomi 3, trisomi 18 och deletioner vid position 23 på den långa armen av kromosom 6 finns också ofta i primära ögon. adnexa EMZL.
Behandling av sjukdomen kräver ytterligare studier. Hos patienter med lokaliserad sjukdom: 1) strålbehandling har uppnått fullständiga svar i 52-93% av fallen och 5 års systemiskt fria (men inte lokalfria) återfallsfrekvenser på >90%; 2) kemoterapi med en CHOP- regim hos 15 patienter har uppnått remission utan återfall hos 9, lokalt återfall hos 5 och systemiskt återfall hos 2 patienter efter 55 månaders uppföljning; 3) kemoterapi med klorambucil hos 33 patienter har uppnått fullständiga svar hos 26 patienter efter 24 månaders uppföljning; 4) immunterapi med rituximab har uppnått varierande resultat på kort sikt och kräver ytterligare studier under längre uppföljningsperioder med något bättre resultat hos patienter med konjunktival sjukdom; och 5) antibiotikabehandling med doxycyklin har uppnått 2 års och 5 års misslyckande överlevnad på 67 % respektive 55 % och en 5-års progressionsfri frekvens på 61 %. Den allmänt erkända behandlingen av patienter med systemisk inblandning använder olika kemoterapiregimer ofta kombinerade med rituximab. Fullständiga svar har observerats hos de flesta patienter som behandlats med klorambucil, CHOP-kurer eller rituximab, men återfallsfrekvensen har varit hög (t.ex. ~33%).
Primär hud
Primärt kutant EMZL eller primärt kutant MALT-lymfom (även kallat hudassocierat lymfoidvävnadslymfom ) uppträder vanligtvis som enstaka eller flera små papler eller plack , vanligtvis belägna på armar och/eller bål. Histologiskt består dessa lesioner av reaktiva germinala centra som innehåller en blandning av små B-celler som har en plasmacellsliknande eller monocytliknande morfologi sammanflätad med ett flertal T- cellslymfocyter . B-cellerna i dessa lesioner uttrycker de B-cellsmarkörer som vanligtvis ses i EMZL. DNA från Borrelia burgdorferi , det orsakande ämnet för borrelia , har upptäckts i lesioner hos 10–42 % av patienterna i Tyskland, Italien, Japan och Turkiet men inte hos patienter från Spanien, Finland, Nederländerna eller Förenta staterna. Medan sjukdomen nästan alltid har ett mycket indolent förlopp, är den föremål för upprepade skov som vanligtvis är begränsade till huden. I sällsynta fall sprids primär kutan EMZL till andra vävnader och blir en systemisk sjukdom. Behandling av primär kutan EMZL har varit konservativ med tanke på sjukdomarnas tröga beteende. Vid Borrelia burdorferi -positiv sjukdom bör antibiotikabehandling (kurer med cefalosporin eller tetracyklin betraktas som förstahandsval av antibiotika) övervägas även om denna åtgärd är mindre tillämplig i områden, som USA, där bakterien inte har associerats med sjukdomen. Behandling av Borrelia burdorferi -negativ sjukdom eller sjukdom för vilken antibiotikabehandling inte är ett alternativ eller har misslyckats beror på omfattningen av lesionerna. Enstaka lesionsbehandlingar inkluderar kirurgisk resektion, direkt injektion av interferon-alfa eller rituximab i lesionerna och lokaliserad extern strålbehandling . Sjukdomsfria frekvenser som hittas 5 och 10 år efter dessa behandlingar är 57 % respektive 43 %. Vid spridd sjukdom har vaksam väntan , intravenös rituximab och kemoterapi använts. Intravenöst rituximab uppnår remissionsfrekvenser på 85 % hos patienter som inte har fått kemoterapi; klorambucilkemoterapi med eller utan intravenös rituximab har signifikant förbättrat överlevnadstiden utan händelse; och CHOP- kemoterapi rekommenderas för patienter med B-symtom (t.ex. feber, nattliga svettningar, viktminskning, etc.), förhöjda nivåer av serummjölksyradehydrogenas eller sjukdom som har utvecklats till ett mer aggressivt stadium.
Primär lunga
Primärt pulmonellt EMZL (eller primärt pulmonellt MALT-lymfom ) är en sällsynt sjukdom men representerar ändå upp till 80 % av alla lymfom som har sitt ursprung i lungan. Orsaken till att utveckla detta lymfom är oklar. Cirka 16 % av individerna med sjukdomen uppvisar drag av en autoimmun sjukdom, varvid en studie rapporterade att 57 av 124 patienter med sjukdomen visade Achromobacter xylosoxidans DNA i sina lungskador. Achromobacter xylosoxidans är en betaproteobakterie som rutinmässigt isoleras från lungorna hos patienter med cystisk fibros ; den har låg virulens men är extremt resistent mot antibiotika. Primär pulmonell EMZL drabbar vanligtvis patienter 50–60 år gamla; i nästan 50 % av fallen diagnostiseras sjukdomen hos symtomfria individer som uppvisar en onormal lungröntgen eller datortomografi utförd av orelaterade skäl. Patienter med symtom uppvisar vanligtvis bröstsmärtor, andnöd och/eller en historia av återkommande luftvägsinfektioner. Bröströntgen och CT-skanningar visar vanligtvis bilaterala alveolära opaciteter som är <5 cm. Allvarligare lungskador (t.ex. atelektas , pleurautgjutning eller mediastinal lymfadenopati ) förekommer i <10 % av fallen. Patienter med mer avancerad sjukdom kan uppvisa benmärgspåverkan (13-30 % av fallen), involvering eller andra platser utanför lungan såsom mage, ögon, öron, näsa och/eller hals (25-35 % av fallen) , eller i sällsynta fall av särskilt aggressiv sjukdom, systemiska B-symtom som feber, nattliga svettningar och/eller viktminskning. En monoklonal gammopati (dvs för stora mängder av ett monoklonalt gammaglobulin i blodet ) finns i 20-60 % av fallen, och förekommer särskilt hos individer med vävnadsskador som innehåller lymfocyter som har ett plasmacellliknande utseende. Lesionerna i primärt pulmonellt lymfom finns i slemhinnan i luftvägarna och diagnostiseras genom nålbiopsi, bronkial biopsi, trans-bronkial biopsi och/eller bronkoalveolär sköljning . Fynd som överensstämmer med diagnosen inkluderar biopsiprover som avslöjar slemhinneinfiltrat av små B-celler som bär de typiska B-cellsmarkörerna som finns i EMZL; enstaka prover består av B-lymfocyter med plasmacellsutseende. Bronkoalveolär sköljvätska kan innehålla >10 % av cellerna som bär dessa markörer. B-celler i pulmonella lesioner har t(11;18)(q21;q21)-translokation och uttrycker därför det chimära API2-MALT1-proteinet i ~40% av fallen. Andra, mindre frekvent förekommande genomiska abnormiteter i dessa celler inkluderar t(1;14)(p22;q32), t(14;18)(q32;q21) och t(3;14)(p14.1;q32) translokationer och trisomi av kromosom 3 och/eller 18.
Behandling av primär pulmonell EMZL varierar. Antibiotikabehandling har inte studerats och kan inte rekommenderas. Rekommenderade behandlingar som har gett en total överlevnadsgrad på 89-100 % i fem år inkluderar kirurgi, strålbehandling, kemoterapi, immunterapi och vaksam väntan . Kirurgisk resektion eller strålbehandling kan övervägas för lokaliserad sjukdom. Vid mer omfattande sjukdomar har rituximab-immunterapi uppnått en svarsfrekvens på 70 % men med en hög återfallsfrekvens (~36 %). Behandling med fludarabin , CHOP , klorambucil eller klorambucil + rituximab har använts för att behandla omfattande sjukdomar med varje behandling som ger ungefär samma totala medianöverlevnadstider på >10 år.
Primär spottkörtel
Primär spottkörtel EMZL (även kallad MALT-lymfom i spottkörtlarna ) eller, i fall som primärt involverar tårkörtlarna , primär tårkörtel EMZL (även kallat MALT-lymfom i tårkörteln) är en komplikation av Sjögrens syndrom , en autoimmun sjukdom kronisk inflammation i spott- och/eller tårkörtlar. Denna autoimmuna sjukdom tros vara orsakad av en kombination av genetiska och miljömässiga faktorer inklusive infektionsämnen . Detta lymfom drabbar ~3% av patienterna med Sjögrens syndrom och involverar en eller flera av de drabbade spottkörtlarna eller, mindre vanligt, tårkörtlarna. Mediantiden mellan diagnos av den autoimmuna sjukdomen och EMZL varierar mellan 7,5 och 11 år. Drabbade individer är typiskt 55–60 år gamla och uppvisar lokal förhårdnad och/eller förstoring av öreskörteln eller, mindre vanligt, andra spott- eller tårkörtel. Cirka 20 % av fallen uppträder med eller utvecklas till att involvera lokala lymfkörtlar eller mjälten för att orsaka lymfadenopati eller splenomegali medan ~10 % av fallen uppträder med eller utvecklas till ett höggradigt lymfom, främst diffust storcelligt B-cellslymfom. Histologiskt visar de inblandade körtlarna lymfocytbaserade lesioner som är typiska för EMZL med de infiltrerande lymfocyterna i vissa fall med morfologiska egenskaper som liknar plasmaceller . Hos individer med mer avancerad sjukdom utvecklas dessa lesioner i slemhinnorna i ögonhålan , näshålan, svalget , luftvägarna i de nedre luftvägarna , magen och/eller sköldkörteln.
Behandling av primär spott/tårkörtel EMZL har inte standardiserats. En minoritet av patienterna har behandlats med vaksam väntan men de flesta patienter har genomgått kirurgi, strålbehandling, kemoterapi (dvs. klorambucil ), immunterapi (t.ex. rituximab , eller en kombination (t.ex. klorambucil + rituximab eller fludarabin + rituximab eller bendamustin + rituximab) immunterapi plus kemoterapi. Generellt sett har den totala överlevnaden efter 5, 10 och 15 års behandling varit 95 %, 85 % respektive 78 %. Även om svaret på dessa terapeutiska kurer har varit mycket bra, är ~33 % av de behandlade patienter har upplevt ett återfall av deras lymfom i spott-/tårkörtlarna, lymfkörtlarna eller andra platser.
Lymfoepitelial sialadenit
Lymfoepitelial sialadenit , även kallad kronisk sialadenit, är en godartad infiltration av spottkörtlar av B-celler med morfologiska egenskaper hos marginalzonens B-celler, centrocyter och monocyter. Histologiskt är denna störning associerad med atrofi av det kolumnära epitelet i spottkörtelkanalerna såväl som proliferationen av epitelceller och lymfepitelskador i dessa körtlar. Även om de vanligtvis är en del av Sjorgens syndrom, kan dessa histologiska fynd även förekomma hos patienter utan tecken på detta syndrom. I mycket sällsynta fall utvecklades lymfepithelial sialadenit till spottkörtel EMZL.
Primär sköldkörtel
Primär sköldkörtel-EMZL, även kallad MALT-lymfom i sköldkörteln, är extremt sällsynt. Det förekommer nästan uteslutande i sköldkörteln som påverkas av Hashimotos tyreoidit , en autoimmun sjukdom som kännetecknas av ackumulering av lymfocyter, inklusive B-celler, i sköldkörteln och den efterföljande förstörelsen av sköldkörtelvävnaden av dessa celler. Patienter med detta syndrom har en 40- till 80-faldigt ökad risk att utveckla sköldkörtellymfom, varav 25 % är primära sköldkörtel-EMZL. Patienter med Hashimotos tyreoidit som utvecklar detta lymfom är vanligtvis kvinnor (medianålder 70 år) som har haft tyreoidit i 20–30 år och som uppvisar en snabb ökning av sköldkörtelns storlek och i samband med detta har utvecklat heshet , hög andningsljud och/eller svårigheter att svälja och/eller andas . Histologiskt består lesionerna i detta lymfom i allmänhet av reaktiva lymfoida folliklar och lymfepitelskador som är befolkade av medelstora B-celler, centrocyter , plasmaceller och, i ~1/3 av fallen, ark av stora lymfocytiska celler liknande de. ses vid diffusa stora B-cellslymfom . De maligna cellerna i dessa lesioner uttrycker B-cellsmarkörer som är typiska för EMZL, t.ex. CD20 och BCL-6 men inte CD10-proteiner. Patienter med primär sköldkörtel-EMZL löper en ökad risk att utveckla ett mer spritt lymfom, särskilt diffust storcelligt B-cellslymfom eller, alternativt, nodal MZL eller mjält-MZL.
Behandling av primär sköldkörtel-EMZL är generellt konservativ eftersom upp till 90 % av patienterna diagnostiseras med sjukdom i ett tidigt stadium. Även om den optimala behandlingen för denna sjukdom är osäker, behandlas majoriteten av patienter med lokaliserad sjukdom med kirurgi, strålbehandling eller en kombination av båda modaliteterna och uppnår en total svarsfrekvens på upp till 100 % och en uppskattad 5 års sjukdomsfri överlevnad av 95 %. Kirurgi plus strålbehandling verkar inte ge bättre resultat än strålbehandling enbart. Patienter med omfattande sjukdom eller sjukdom som har utvecklats till ett lymfom av högre grad (huvudsakligen diffust B-cellslymfom) har behandlats med kemoterapi (vanligtvis CHOP ) och/eller immunterapi (dvs rituximab ). Emellertid är 5-årsöverlevnaden hos kemoterapibehandlade patienter med spridd primär sköldkörtel-EMZL eller sjukdom som har utvecklats till ett mer malignt lymfom endast 35 % respektive 44 %.
EMZL och andra autoimmuna sjukdomar
Patienter med en annan autoimmun sjukdom än Hashimotos tyreoidit har också en ökad risk att utveckla en EMZL på ett eller flera vävnader. Till exempel har patienter med systemisk lupus erythematosus en 7,5 gånger ökad risk att utveckla en EMZL jämfört med den allmänna befolkningen och har vid diagnos av denna utveckling en medianålder på 50 år och diagnostiserats med systemisk lupus ertyematos i 6,7 till 17,8 år. Patienter med reumatoid artrit , immun trombocytopen purpura och autoimmun hemolytisk anemi är på liknande sätt känsliga för att utveckla en EMZL. Även om de exakta orsakerna till dessa samband är oklara, anses det allmänt att den kroniska inflammationen som är involverad i varje sjukdom främjar det maligna beteendet hos B-celler och därmed utvecklingen av EMZL. Behandling av patienter med en autoimmun sjukdom komplicerad av EMZL har vanligtvis innefattat de standardmått som används för att behandla både den autoimmuna sjukdomen och EMZL.
Primärt centrala nervsystemet
Primär EMZL i centrala nervsystemet är en extremt sällsynt sjukdom. Jämfört med andra lymfom i centrala nervsystemet som är mycket aggressiva, är primär EMZL i centrala nervsystemet ett icke-aggressivt, låggradigt lymfom. I en genomgång av 70 publicerade fall involverade sjukdomen proliferation av maligna marginalzon B-celler inom dura mater , dvs tjockt membran som omger hjärnan och ryggmärgen, (56 fall), hjärnan eller ryggradsparenkym ( 6 fall), hjärnans kavernösa sinus (4 fall), hjärnans plexus choroid plexus (3 fall), inuti hjärnan [[Kammersystemet[ventrikel]] (1 fall), cerebellopontinvinkeln ( 2 fall) och synnerven (2 fall). Patienter (77 % kvinnor; medianåldern 55 år, från 18 till 78 år) uppvisade olika neurologiska tecken och symtom beroende på platsen för involveringen. De vanligaste symtomen var huvudvärk (30 fall); anfall (22 fall); och visuella förändringar (19 fall). Mindre vanligt förekom patienter med parestesier (dvs onormala hudförnimmelser), motoriska brister och ataxi , minnesfel och yrsel. Vid tidpunkten för diagnosen fanns inga tecken på EMZL utanför det centrala nervsystemet. Maligna celler upptäcktes i cerebrospinalvätskan i 5 av de 19 fall som testades för detta. Histologiskt var lesioner i sjukdomen typiska för EMZL genom att de bestod av små till medelstora B-celler som uttrycker CD19, CD20 och CD79a) men inte CD10, CD23 eller cyklin D1 markörproteiner tillsammans med vissa plasmaceller och en varierande antal reaktiva T-celler. Femtio procent av fallen som testades för trisomi av kromosom 3 var positiva.
Behandling av lokaliserad sjukdom bestod av kirurgi, strålbehandling eller en kombination av båda modaliteterna medan behandling av omfattande sjukdomar i centrala nervsystemet bestod av kemoterapi, inklusive intratekal kemoterapi , med eller utan kirurgi och/eller strålbehandling. Oavsett behandlingsregim har det primära centrala nervsystemet EZML en god prognos med komplett respons (CR) som inträffar hos 77 % av patienterna och 22 % av patienterna som lever med tecken på sjukdom efter 1–86 månaders uppföljningstider. Värdena av systemisk och intratekal kemoterapi vid behandling av sjukdomen är oklara och kräver ytterligare studier.
Primärt bröst
Primärt EMZL i bröstet (även kallat primärt MALT-lymfom i bröstet) är en ytterst sällsynt sjukdom. Den uppträder vanligtvis som en påtaglig bröstmassa hos en annars symtomfri patient. Histopatologiska fynd är typiska för EMZL: lesioner består av små till medelstora B-celler, centrocytliknande B-celler, små lymfoida celler med vissa egenskaper hos plasmaceller eller monocyter , och mogna plasmaceller där lymfoidcellerna i dessa lesioner uttrycker CD20 och CD79a men vanligtvis inte CD10, CD43 eller BCL6 markörproteiner. Måttliga doser av lokal strålbehandling rekommenderas för att behandla lokaliserad EMZL i bröstet. Denna behandling har uppnått en total överlevnadsgrad på >90 %. Med tanke på dessa resultat och den höga känsligheten hos EMZL för strålbehandling, rekommenderas inte mastektomi och bred excision är vanligtvis inte nödvändig för att behandla lokaliserad sjukdom. För patienter med spridd sjukdom inkluderar behandlingsalternativen vaksam väntan och kemoterapi (typiskt med CHOP eller CHOP-liknande behandling) med eller utan strålbehandling och/eller excision. Dessa tillvägagångssätt har uppnått fullständig sjukdomsremission hos 9 av 9 patienter som följts i 6–74 månader och ett dödsfall på grund av progressiv sjukdom hos en patient som följts i 107 månader. Andra läkemedel som används för att behandla sjukdomen inkluderar rituximab, tamoxifen och oxaliplatin .
Primära urinvägar
Primära urinvägs- EMZL i urinblåsan och njurarna är extremt sällsynta men de vanligaste formerna av lymfom som finns i dessa organ. De förekommer oftast hos medelålders kvinnor som har en historia av kronisk cystit , dvs inflammation i urinblåsan på grund av urinvägsinfektion eller andra orsaker.
Primär blåsa
Presenterande symtom på primärt blåslymfom inkluderar viktminskning, trötthet, hematuri , dysuri , natturi , urinfrekvens och smärta i buken och/eller det suprapubiska området. Emellertid uppstår detta lymfom vanligtvis som en spridd sjukdom som involverar andra organ och vävnader. Radiologiska och cystoskopiska undersökningar avslöjar en eller flera slemhinnemassor i eller diffus förtjockning av blåsväggen. Histopatologin för dessa lesioner är typisk för EMZL; de innehåller små lymfocyter av vilka några eller många har plasmacellsdrag med de maligna cellerna i dessa lesioner som typiskt uttrycker CD20 och PAX-5 men inte CD5- eller CD10-markörproteiner. Cellerna kan också innehålla t(11;18)(q21:q 21)-translokationen som är typisk för EZML. Behandling av primär urinblåsa EMZL beror på omfattningen av sjukdomen. Lokaliserad sjukdom bör bekräftas med t.ex. Positron-emissionstomografi – datortomografi (dvs PET/CT), magnetisk resonanstomografi (dvs. MRT) av bäckenområdet och benmärgsundersökning . Bekräftad lokaliserad sjukdom har behandlats med kirurgi och strålbehandling med strålbehandling som den klart föredragna och mest lämpliga metoden med tanke på detta lymfoms höga känslighet för strålning. Däremot kan kirurgisk resektion med resektion av blåstumör (dvs. TURBT) vara den bästa behandlingen där fertiliteten är ett problem. Disseminerad och återkommande primär urinblåsa EMZL har behandlats med systemisk kemoterapi (vanligtvis en CHOP- eller CHOP + rituximab -regim. Prognoser för behandlad lokaliserad och spridd sjukdom är goda med långtidsremissioner (t.ex. upp till 40 år) rapporterade för de flesta patienter med lokaliserad sjukdom och (upp till 10 år) för patienter med spridd sjukdom.
Njure
Njure-EMZL (dvs. njur-MALT-lymfom, renalt EMZL eller njur-MALT-lymfom) förekommer främst hos individer >50 år men har rapporterats hos individer så unga som 9 år. I något mer än hälften av de rapporterade fallen var detta lymfom lokaliserat till njuren eller upptäcktes i njuren plus lymfkörtlar runt njuren, någon annanstans i retroperitonium eller längs den abdominala aortan . Dessa fall kan därför betraktas som primära njure-EMZL. De återstående fallen hade en utbredd sjukdom, av vilka några verkar relaterade till primär spottkörtel EMZL, primär orbital EMZL, Helicobactor pylori -associerad gastrit , systemisk lupus erythematosus eller möjligen en Epstein-Barr-virus-associerad lymfoproliferativ sjukdom , dvs en lymfocytrelaterad sjukdomsrelaterad sjukdom och tros vara orsakad av infektion med detta virus. Patienter kan uppvisa tecken och symtom på en njurmassa (t.ex. lågpacksmärta och/eller onormal njurfunktion som bestäms av förhöjt serumkreatinin ) . Den bästa behandlingen för njur-EMZL är oklart. Rapporterade fall har genomgått nefrektomi och/eller kemoterapi.
Primär gallblåsa
Primär gallblåsa EMZL (dvs. extranodal marginalzonslymfom i gallblåsan, primär MALT-lymfom i gallblåsan) är en extremt sällsynt sjukdom med endast 17 fall som rapporterats i litteraturen från och med 2017. Presenterar egenskaper hos individer (i åldern 31–84 år, medianåldern 74, >60 % kvinnor) med sjukdomen liknar de som ses vid andra lymfom och icke-lymfomatösa cancerformer i gallblåsan; dessa inkluderar smärta i den övre högra delen av buken, illamående, kräkningar och i ungefär två tredjedelar av fallen gallsten . Med tanke på dessa likheter såväl som likheter i laboratorie-, medicinska ultraljuds- och röntgenfynd av primär gallblåsa EMZL jämfört med andra cancerformer i gallblåsan som står för >99 % av cancer i urinblåsan, har diagnosen primär gallblåsa EMZL ännu inte gjorts före -operativt. Snarare har dess diagnos uteslutande vilat på undersökning av kirurgiskt avlägsnade gallblåsor. Lesionerna i dessa gallblåsor visar infiltrat i körtelns submucosa som består av små lymfocyter varvat med lymfepitelskador . Lymfocyterna har markörproteinprofiler (t.ex. CD20 och Bcl-2 positiva; CD5, cyklin D1 och CD10 negativa) som är typiska för EMXL. Kolecystektomi , dvs kirurgiskt avlägsnande av gallblåsan, har gett remissioner hos alla patienter med endast ett återfall under observationsperioder på 2 till 96 månader.
Primär lever
Primärt lever-EMZL (dvs primärt extranodalt B-cellslymfom i marginalzonen i levern, primärt leverslemhinnaassocierat lymfoidvävnadslymfom, primärt leverslemhinneassocierat lymfom) är en extremt sällsynt malignitet som representerar <3 % av alla primära leverlymfom. Endast 47 fall av primär lever-EMZL rapporterades i den engelska litteraturen som utvärderades av en 2019 granskning. Baserat på denna översyn hade individer med primär lever-EMZL samtidig leversjukdom (främst hepatit B viral hepatit eller hepatit C viral hepatit , mindre vanligt, primär biliär cirros eller hepatocellulärt karcinom , och, sällan, andra leversjukdomar såsom hepatit A viral hepatit . Patienter (medianålder 63 år, intervall 30–85 år) uppvisade inga symtom (~64 % av fallen) eller symtom (som kan ha varit relaterade till deras andra leversjukdomar) såsom buksmärtor, allmän svaghet, hosta, förhöjda deras blodnivåer av leverenzymer och/eller bevis på en eller flera levermassor som detekteras med magnetisk resonanstomografi , datortomografi eller positronemissionstomografi . Dessa presentationer är praktiskt taget identiska med de som ses vid andra former av levercancer. Följaktligen, diagnosen primär lever-EMZL har varit extremt svår att ställa utan att erhålla vävnad med kirurgiska metoder Histologisk undersökning av involverade levervävnader visade vanligen diffusa infiltrationer av små till medelstora atypiska lymfocyter. Dessa infiltrationer, som kan involvera leverns gallgångar, innehöll ofta lymfepitelskador . Immunhistokemitestning av dessa vävnader avslöjade lymfocyter som uttryckte CD20 och BCL-2 men inte CD10 eller cyklin D1. Även om optimala terapeutiska strategier för denna sjukdom inte har fastställts, verkar primär lever-EMZL vara en indolent cancer. Patienter som genomgick kirurgisk resektion med eller utan behandling med kemoterapi eller rituximab och observerades under en medianperiod på 31 månader hade mestadels positiva resultat: 92 % överlevde, 8 % dog av orsaker som inte var relaterade till eller endast indirekt relaterade till sin cancer, och 11 % hade återfall.
EMZL i samband med hepatit C
EMZL förekommer oftare (~2,5 gånger ökad risk) hos individer som har hepatit C-virus- inducerad hepatit . Lymfomet uppträder vanligtvis 15–25 år (mediantider) efter virusinfektionen och involverar huden (35 % av fallen), spottkörtlar (25 %), orbital adnexa (15 %) eller, ovanligt, magen eller andra vävnader. Det är associerat med typ II kryoglobulinemi , dvs cirkulationen av ett immunkomplex bestående av polyklonalt IgG , monoklonalt IgM och hepatit C viralt RNA . Detta immunkomplex orsakar tecken och symtom på vaskulit i 10% av fallen. Andra tecken och symtom på sjukdomen inkluderar de som är associerade med kronisk hepatit och den specifika subtypen av EMZL. I sällsynta fall uppträder EMZL associerat med hepatit C-virusinfektion som enstaka eller flera mjuka, rörliga subkutana knölar. Denna presentation förekommer främst hos kvinnliga (83 % av fallen) och äldre patienter. Patienter med denna störning kan ha detekterbara nivåer av cirkulerande hepatit C-virus. Histologin för lesionerna i EMZL associerade med hepatit C-virusinfektion är typisk för EMZL även om de genomiska abnormiteterna i sjukdomarna maligna celler inte har varit väldefinierade utöver deras uttryck av t(14;18) kromosomtranslokation i ett betydande antal av fall. Behandling av denna sjukdom hade förlitat sig på att utrota viruset med hjälp av peginterferon-alfas, interferon -alfa-liknande läkemedel för att mobilisera värdarnas immunsystem. Denna behandling botade virusinfektionen i ~50% och gav lymfomremissioner i <50% av fallen. På senare tid har läkemedel (t.ex. simeprevir , daclatasvir , sofosbuvir och dasabuvir ) som direkt hämmar virusets reproduktion botat infektionen och uppnått lymfomsvar hos upp till 100 respektive 73 % av patienterna med ett års total överlevnad och progressionsfri överlevnad satser på 98 respektive 75 %. För patienter vars lymfom inte svarar på denna terapi (~25 % av fallen), inkluderar rekommenderade behandlingar rituximab eller rituximab + en peginterferon-alfa. Eftersom kemoterapiregimer är mycket toxiska för patienter med leversjukdom, bör de undvikas, där så är möjligt, vid behandling av EMZL i samband med hepatit C-virusinfektion.
Mjältens marginalzon lymfom
Mjältrandzonslymfom (SMZL) är ett låggradigt lymfom där maligna B-celler ackumuleras i mjälten, benmärgen och, mindre vanligt, cirkulationen. Även om det i allmänhet är en indolent sjukdom, förvandlas cirka 5-10% av fallen till en mycket mer aggressiv malignitet, diffust storcelligt B-cellslymfom . I en varierande andel av fallen har SMZL observerats förekomma med en ökad incidens hos individer som är kroniskt infekterade med hepatit C-virus eller har någon av olika kroniska autoimmuna sjukdomar eller abnormiteter.
tecken och symtom
Vid presentationen uppvisar patienter (medianålder 65 år; intervall 30–90 år) i allmänhet förstoring av sin mjälte (75 % av fallen). De har vanligtvis inga förstoringar av sina lymfkörtlar förutom lymfkörtlarna runt mjältens hölje . De flesta patienter har inga systemiska symtom som feber, nattliga svettningar , viktminskning eller trötthet. Blodprov avslöjar minskningar av nivåerna av röda blodkroppar, blodplättar och/eller vita blodkroppar i 25 % av fallen; ett onormalt cirkulerande IgM- myelomprotein i <33 % av fallen; och i ~20% av fallen tecken på autoimmunitetsavvikelser såsom cirkulerande autoantikroppar (dvs antikroppar riktade mot patientens egna antigener), autoimmun hemolytisk anemi, immun trombocytopen purpura, kalla agglutininer och/eller antikoagulerande antikroppar. Individer med SMZL uppvisar också vanligtvis ökade nivåer av cirkulerande blodlymfocyter som i vissa fall kan identifieras som maligna B-celler; dessa maligna celler kan ha hårliknande utsprång som liknar de maligna B-celler som finns i cirkulationen hos patienter med hårcellsleukemi . Patienter med SMZL kan också uppvisa tecken och symtom på förvärvad von Willebrands sjukdom, angioödem på grund av brist på C1-esterashämmare eller hepatit C-virusinfektion (t.ex. klinisk hepatit , cirkulerande hepatit C-virus). Sambandet mellan hepatit C-virusinfektion och SMZL varierar med lokalisering och kan vara så hög som 10 % i vissa områden. Slutligen, noggrann undersökning av patientens benmärg finner nästan alltid fickor eller mer omfattande ansamlingar av maligna B-celler.
Patofysiologi
De maligna cellerna som är involverade i SMZL identifieras preliminärt som antigen-upplevda B-celler. Sjukdomen verkar initieras i åtminstone vissa fall av kronisk antigenstimulering av prekursor B-celler som därigenom blir antigenupplevda. Bevis för denna härledning kommer från studier som visar att de antigenupplevda B-cellerna i SMZL uttrycker strukturellt begränsade immunglobuliner och B-cellsreceptorer (se klonalt urval ) som sannolikt binder specifika men generellt oidentifierade antigener. Vidare visar sig patienter med SMZL ofta ha autoimmuna abnormiteter såsom cirkulerande autoantikroppar (dvs antikroppar riktade mot patientens egna antigener), autoimmun hemolytisk anemi , immun trombocytopen purpura , förkylningsagglutininsjuka , cirkulerande antikoagulantantikroppar, förvärvad, von angeobrand sjukdom och Willebrands sjukdom på grund av brist på C1-esterashämmare. Man tror att B-cellsreceptorbindningen av oidentifierade antigener inklusive de som är involverade i de citerade autoimmuna abnormiteterna stimulerar B-cellernas proliferation, långsiktiga överlevnad och därigenom det stegvisa förvärvet av genomiska abnormiteter som i slutändan orsakar antigen- upplevt B-celler att bli maligna. De genomiska abnormiteter som tros bidra till denna maligna transformation inkluderar:
- Kromosomavvikelser såsom: 1) deletioner i den långa (dvs. "q") armen av kromosom 7 (kommenterad som del7q) i 30-40 % av fallen (denna deletion är sällsynt i andra lymfom och används därför som en markör för SMZL) ; 2) deletion av en region på den korta (dvs. "p") armen av kromosom 17 i 3-17% av fallen för att resultera i att en av de två p53-gener som kodar för en tumörsuppressor som verkar för att reglera cellulär överlevnad försvinner ; och 3) ökningar i q-armen av kromosom 3 i 10-20% av fallen.
- Mutationer i gener såsom: 1 KLF2 (21% av fallen), en transkriptionsfaktor som indirekt reglerar NF-KB- signalvägen för cellulär överlevnad, proliferation och produktion av cellstimulerande cytokiner ; 2) NOTCH2 (20 % av fallen), ett membranprotein som reglerar utvecklingen av B-celler i marginalzonen från deras prekursorceller och har tumörsuppressoraktivitet för att därigenom främja cellulär överlevnad; 3) TP53 (14 % av fallen), en transkriptionsfaktor som indirekt reglerar cellproliferation och programmerad celldöd för att därigenom främja cellulär överlevnad; 4) IGLL5 (14 % av fallen) med oklara funktioner; 5) TNFAIP3 (13 % av fallen), som verkar indirekt för att hämma NF-KB-aktivering och programmerad celldöd; och 6) i <10 % av fallen minst 16 andra gener.
Sammantaget verkar mutationer i NOTCH-, NF-KB- och KLF2-signalvägarna vara särskilt viktiga i patogenesen av SMZL.
Diagnos
Det tydligaste beviset för diagnosen SMZL erhålls genom undersökning av patienternas mjälte erhållen genom splenektomi . Dessa mjältar uppvisar typiskt lymfoida infiltrat i den vita pulpan och, i mindre och mer varierande utsträckning, den röda pulpan . Dessa infiltrat består av små lymfocyter, B-celler i marginalzonen, centroblastliknande B-celler, monocytliknande B-celler och plasmaceller . Epiteloidliknande histiocyter kan finnas i den röda pulpan . Hilarlymfkörtlar i mjälten kan visa nodulära infiltrat av små lymfocyter. Noggrann och grundlig undersökning av patientens benmärg visar vanligtvis aggregat av lymfoida celler mellan organen trabeculae och inom dess bihålor . Neoplastiska B-celler kan också cirkulera i patientens blod. De neoplastiska cellerna i alla dessa vävnader, liknande de neoplastiska cellerna i extranodal och nodal MZL, uttrycker CD20 , CD27 och BCL2 men inte CD10 , CD23 , CD5 , CD43 , CD38 , BCL6 , cyklin D1 eller annexin A1 markörproteiner. Dessa celler kan också uttrycka del7q-deletionen (dvs. deletioner i q-armen av kromosom 7) i 30-40 % av fallen och i lägre procentandelar av fallen de muterade generna som listas i avsnittet Patofysiologi. Medan diagnosen SMZL initialt baserades på undersökning av mjältvävnad, ställs diagnosen för närvarande i de flesta fall på kliniska fynd plus undersökningar av patienternas benmärg och/eller blod som upptäcker neoplastiska B-celler som uttrycker några av proteinerna och /eller genomiska abnormiteter citerade ovan; fall som är svåra att diagnostisera baserat på benmärgs- och blodfynd kräver dock undersökning av mjälten för att få en definitiv diagnos av SMZL.
Behandling
Med tanke på dess sällsynthet har det inte gjorts några systematiska och kontrollerade studier på behandlingen av SMZL. Aktuella rekommendationer för detta inkluderar följande. Watchful waiting , vilket är att undanhålla specifika behandlingar samtidigt som man utför uppföljningsundersökningar var 3:e till 6:e månad för att upptäcka sjukdomsprogression. Denna kurs rekommenderas för ~33 % av SMZL-patienter som uppvisar asymtomatisk, icke-progressiv eller långsamt progressiv sjukdom. Dessa patienter behöver kanske inte terapeutiska ingrepp under långa perioder. Historiskt sett var den initiala behandlingen för patienter med snabbt fortskridande sjukdom splenektomi . Ungefär 90 % av dessa patienter visar minskningar i sina symtom och förbättringar i deras låga antal röda blodkroppar, blodplättar och vita blodkroppar; de hade medianprogressionsfri, 5 år totalt och 10 års total överlevnad på 8,2 år, 84% respektive 67%. Dessa patienter visar dock ingen förändring i nivåerna av neoplastiska B-celler i blodet, var föremål för allvarliga komplikationer från sin splenektomi (t.ex. trombos , infektioner) och visade inte förändrade totala överlevnadsgrader bättre än de som erhölls med andra behandlingsstrategier. Följaktligen har splenektomi för SMZL begränsats till fall av signifikant symtomatisk förstorade mjältar hos patienter med mild till måttlig benmärgspåverkan och inga skrymmande lymfkörtelförstoringar.
Aktuella behandlingsrekommendationer för patienter med symtomatisk eller snabbt progressiv SMZL är beroende av läkemedel. Rituximab , en kommersiell beredning av en monoklonal antikropp riktad mot CD20-proteinet på B-celler, är signifikant aktiv i SMZL, med korttidsbehandlingar (t.ex. ~4 veckor) som uppnår totala svarsfrekvenser på 90-100 %, fullständig remissionsfrekvens på >50 % och en 7-års progressionsfri överlevnad på 69 %. Långvarig underhållsbehandling med rituximab tycks förbättra dessa resultat och patienter som återfaller efter rituximabbehandling svarar vanligtvis på en andra behandlingskur med läkemedlet. Innan rituximab var tillgänglig var kemoterapi med enstaka läkemedel (t.ex. klorambucil , cyklofosfamid , fludarabin , pentostatin , 2CDA eller bendamustin ) och flera läkemedelsregimer (dvs. CVP-regimen för cyklofosfamid , vinkristin och prednison plus doxobi -regimen med C CHVP ) eller används för att behandla sjukdomen. Aktuella studier indikerar dock att dessa kemoterapeutiska medel inte är överlägsna rituximab-terapi med enstaka medel när det gäller svarsfrekvens såväl som kvaliteten och varaktigheten av dessa svar. En klinisk fas II-studie har funnit att behandlingen av SMZL med en kombination av rituximab plus bemdamustin uppnår ett totalt svar och en fullständig svarsfrekvens på 91 % respektive 73 %, med procentuella svar som varar i >3 år, progressionsfri överlevnadsfrekvens, och en total överlevnad på 93 %, 90 % respektive 96 %. Resultaten av denna studie, även om de kräver bekräftelse, tyder starkt på att denna tvåläkemedelsregim används i stället för enbart rituximab, de citerade kemoterapiregimerna eller rituximab plus de citerade kemoterapiregimerna för patienter med symtomatisk/progressiv SMZL.
Experter rekommenderar att SMZL-patienter som också har hepatit C-virusinfektion bör behandlas med läkemedel som verkar för att eliminera viruset som deras första linje. Innan utvecklingen av direktverkande antivirala medel rapporterade flera studier att IFN-α- behandling av dessa patienter gav förbättringar inte bara av virusinfektionen utan även remissioner (~65 % av fallen) i deras lymfom. Flera nyare, direktverkande antivirala medel, t.ex. grazoprevir , daclatasvir , sofosbuvir och dasabuvir , är mer effektiva vid behandling av hepatit C-virusinfektion och hos ett litet antal patienter har eller förväntas vara mer effektiva för att ge lymfomremissioner i patienter med SMZL plus hepatit C-virusinfektion.
Prognos
SMZL följer i allmänhet en indolent kurs med 10 års överlevnadsfrekvens på 42-95 %. Ungefär en tredjedel av dessa dödsfall är inte relaterade till SMZL och ~5-10 av dessa dödsfall beror på omvandlingen av deras SMZL-sjukdom till diffust stort C-cellslymfom.
Nodal marginalzon lymfom
Nodal marginalzonslymfom (NMZL), tidigare benämnd monocytoid B-cellslymfom, nodal monocytoid B-cellslymfom och nodal marginalzonslymfom med eller utan monocytoida B-celler, är en infiltration av vävnader med maligna lymfoida celler som har morfologiska och fenotypiska egenskaper hos alla marginalzonens lymfom. NMZL skiljer sig från de andra subtyperna av marginalzonslymfom genom sin primära involvering av lymfkörtlar snarare än andra vävnader och organ. NMZL är den minst vanliga subtypen av de tre marginalzonens lymfom.
tecken och symtom
Nästan alla patienter med NMZL uppvisar (medianålder 50–64 år; manlig till kvinnlig ranson 1,5 till 1) med icke skrymmande förstoring av sina lymfkörtlar i nacken, ljumsken, buken och bröstkorgen; vissa fall kan också uppvisa denna inblandning i deras Waldeyers tonsillarring . Patienter vid presentationen är i allmänhet fullt fungerande men i 10-20% av fallen klagar de över B-symtom som feber, nattliga svettningar , viktminskning och/eller trötthet. Laboratoriestudier visar att maligna B[celler infiltrerar benmärgen hos ~33% av patienterna och ett onormalt IgM- myelomprotein i ~20% av fallen. I sällsynta fall kan patienter uppvisa cirkulerande maligna marginalzon B-celler och/eller minskningar av en eller flera typer av cirkulerande normala blodkroppar . Biopsi av involverade vävnader olika mönster (t.ex. diffust genom lymfkörteln, centrerad mellan folliklarna i lymfkörtlarna och/eller knölar spridda över hela lymfkörteln) lymfocytinfiltration. Dessa mönster liknar de som ses i EMZL MALT-lymfom. Cellerna i dessa infiltrationer malm, i varierande proportioner, små lymfocyter, marginalzonsliknande B-celler, centrocytliknande celler, monocytliknande celler, plasmacellsliknande celler och i >20 % av fallen stora blastiska B-celler . De maligna B-cellerna i dessa infiltrationer är, liksom de i andra marginalzonslymfom, B-celler i marginalzonen som typiskt uttrycker CD20 , CD19 , CD79 och Bcl2 men inte CD10 , CD5 , CD23 eller cyklin D1 . [ citat behövs ]
Patofysiologi
Cirka 6-19% av NMZL-fallen har rapporterats vara associerade med autoimmuna sjukdomar som reumatoid artrit , Sjögrens syndrom , autoimmun hemolytisk anemi och kronisk tyreoidit . Det finns dock få bevis för att dessa sjukdomar bidrar till utvecklingen av NMZL. Dessutom har sambandet mellan NMZL och hepatit C-virusinfektioner som hittats i tidigare studier inte bekräftats i nyare studier. Det verkar därför som om den postulerade rollen av kronisk immunstimulering för att främja extranodala och mjältrandzonslymfom inte tydligt har visats i och kanske inte gäller för NMZL: den underliggande initierande orsaken till att utveckla denna sjukdom är för närvarande oklar. Icke desto mindre förvärvar anstiftande B-celler i NMZL genomiska abnormiteter som tros bidra till deras maligna transformation. [ citat behövs ] Dessa genomiska abnormiteter inkluderar följande.
- Kromosomavvikelser såsom: 1) trisomi av kromosom 3 (24 % av fallen) som orsakar överuttryck av FOXP1 , NFKBIZ och BCL6 vars proteinprodukter främjar cellulär proliferation och överlevnad; 2) trisomi av kromosom 18 (~50% av fallen) som orsakar överuttryck av NFATC1 vars proteinprodukt kan verka för att främja cellproliferation och överlevnad; 3) ovanligt, trisomi av kromosom 7 och 12 och deletion av den långa armen av kromosom 6 som har ännu okända funktionella effekter; och 4) kromosomtranslokation mellan den korta (dvs. "p") armen av kromosom 2 vid position 24 och den långa (dvs. "q") armen av kromosom 14 vid position 32, en translokation av ännu okänd funktionell konsekvens men som inte hittats i de andra marginalzonens lymfomformer och därför användbara som en diagnostisk markör för NMZL.
- Mutationer i gener såsom: 1) NOTCH2 (25 % av fallen) ett membranprotein som reglerar utvecklingen av B-celler i marginalzonen från deras prekursorceller och som också är en tumörsuppressor som verkar för att reglera källaröverlevnad; 2) TNFAIP3 (5-15 % av fallen) vars produkt är ett deubikvitinerande enzym som fungerar för att undertrycka NF-KB- transkriptionsfaktorn och därigenom NF-KB-signalvägen som kontrollerar cellulär aktivering, proliferation och överlevnad; 3) BIRC3 , som kodar för cIAP2-proteinet som fungerar för att reglera celldöd orsakad av apoptos ; 3) MYD88 (0-10 % av fallen) vars proteinprodukt indirekt reglerar aktiveringen av NF-KB- cellsignalvägen; 4) KLF2 vars produktprotein är en transkriptionsfaktor som indirekt reglerar NF-KB- cellens signalväg; 5) PTPRD vars produktprotein är ett receptortyrosinfosfatas som har tumörsuppressoraktivitet och indirekt reglerar flera signalprogram som reglerar cellproliferation och svar på cytokiner ; och 5) i ~40% av fallen en eller flera av olika andra gener såsom MLL2 , SIN3A , ARID1A , EP300 , CREBBP och TBL1XR1 ) som har kromatinremodelleringsaktivitet för att därigenom reglera uttrycket av ett brett spektrum av andra gener.
Diagnos
Diagnosen NMZL beror på identifiering av neoplastiska B-celler i lymfkörtlar och i vissa fall benmärgen men inte, åtminstone i tidigt stadium av sjukdom, i extranodala organ. Dessa neoplastiska celler bör uttrycka de markörproteiner som är vanliga för lymfom i marginalzonen (se föregående avsnitt) och, i de flesta fall, en eller flera av de genomiska abnormiteter som anges i avsnittet Patofysiologi.
Behandling
Rekommenderade behandlingar för NMZL beror på sjukdomstillståndet. Asymtomatisk NMZL kan använda vaksam väntan med rutinmässiga uppföljningsundersökningar var, t.ex. 3–6 månader, för att kontrollera sjukdomsprogression. Emellertid har lokaliserad sjukdom, även hos asymtomatiska patienter, successivt behandlats med kirurgi följt av lokal strålbehandling. Sjukdom som går förbi ett lokaliserat stadium för att spridas, snabbt progressiv sjukdom och symtomatisk sjukdom har behandlats med ett enda kemoterapiläkemedel (t.ex. kladribin , fludarabin , klorambucil eller bendamustin ); ett enda immunterapiläkemedel (t.ex. rituximab); en kemoterapiregim med flera läkemedel (t.ex. CHOP ), eller en kombination av flera läkemedel för kemoterapi plus immunterapi (dvs. CHOP + rituximab). Det är inte klart att någon eller flera av dessa kurer uppnår är överlägsen de andra.
Prognos
NMZL anses vara en obotlig men relativt indolent sjukdom som tar ett långsamt progressivt, återfallande förlopp. Dess prognos tycks vara något sämre än den som ses vid extranodala lymfom och mjältzonslymfom med ~15 % av personerna som utvecklas till ett mer aggressivt lymfom, diffust storcellslymfom, vid mediantiden på ~4,5 år efter diagnosen NMZL. I olika studier har personer med sjukdomen 5 års överlevnad på 62-90%.
Barn
Hos barn har NMZL klassificerats av Världshälsoorganisationen (2016) som en separat variant av NMZL baserat på dess presentation, histologi av de inblandade lymfkörtlarna och kliniskt förlopp. Av de mer än 60 publicerade fallen inträffade 95 % av pediatriska NMZL-fall hos tonårspojkar med >90 % av fallen som en asymtomatisk, lokaliserad (stadium I/II) sjukdom som involverade förstoring av lymfkörtlarna i huvud- och halsregionerna. Dessa fall visade inga samband med autoimmuna eller patogeninducerade inflammatoriska sjukdomar. Alla dessa fynd står i kontrast till de som ses vid extranodala marginalzonslymfom hos barn. Histologiskt visar de inblandade lymfkörtlarna infiltrationer i könscentrum av påverkade lymfkörtlar av lymfoida celler som vanligtvis uttrycker CD20 och CD43 , ofta (~50 % av fallen) som uttrycker Bcl2, och vanligtvis inte uttrycker CD10 eller BCL6 . Marginalzonens B-celler i dessa infiltrationer har relativt få genomiska abnormiteter jämfört med NMZL hos vuxna. Trisomi av kromosom 18 har rapporterats i 21 % av fallen och, i sällsynta fall, trisomi av kromosom 3. Inga återkommande genmutationer har rapporterats förekomma i dessa celler. Förloppet av pediatriskt NMZL är extremt trögt med sjukdomen som har en låg återfallsfrekvens och vanligtvis ett utmärkt resultat. Observationsperioder på upp till 12–18 år har funnit att patienter har en total överlevnadsgrad på 100 % och en återfallsfrekvens på ~4 %. Behandling av pediatrisk NMZL har använt en vaksam väntestrategi , rituximab , kemoterapi och/eller lokal strålbehandling. Den vaksamma väntande strategin har fungerat lika bra som de andra terapierna och är därför den rekommenderade initiala behandlingen för sjukdomen.
Senare forskning
Olika nya läkemedel som B-cellsreceptor (se intill figur) signalblockerare och ibritumomab tiuxetan (Zevlin) testas i kliniska prövningar för MZL. Dessa prövningar är viktiga för att bestämma doser och säkerhet för de läkemedel som studeras. Från och med den 19 januari 2017 FDA det första riktade läkemedlet någonsin för MZL, ibrutinib . Detta läkemedel verkar genom att hämma Brutons tyrosinkinas (BKT), som kan skicka signaler till kärnan för överlevnad. Med andra ord bromsar det tillväxten av B-celler . Vacciner har utvecklats som kraftigt minskar antalet Helicobacter pylori i magen på djur som tidigare koloniserats med dessa bakterier. Ett eller flera av dessa vacciner kan vara en lovande kandidat för att kontrollera Helicobacter pylori -infektion hos människor såväl som husdjur och husdjur.