CREB-bindande protein
| CREBBP | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , AW558298, CBP, CBP/p300, KAT3A, p300/CBP, RSTS, CREB-bindande protein, RSTS1, MKHK1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa IDs | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Cyklisk adenosinmonofosfatsvar Element B- indande protein B- indande protein ( CREB -bindande protein ) , även känt som CREBBP eller CBP eller KAT3A , är en koaktivator kodad av CREBBP - genen hos människor, lokaliserad på kromosom 16p13.3. CBP har inneboende acetyltransferasfunktioner ; det kan lägga till acetylgrupper till både transkriptionsfaktorer såväl som histonlysiner, varav den senare har visat sig förändra kromatinstrukturen vilket gör gener mer tillgängliga för transkription . Denna relativt unika acetyltransferasaktivitet ses även i ett annat transkriptionsenzym, EP300 (p300). Tillsammans är de kända som p300-CBP-koaktivatorfamiljen och är kända för att associera med mer än 16 000 gener hos människor; Men även om dessa proteiner delar många strukturella egenskaper, tyder nya bevis på att dessa två samaktivatorer kan främja transkription av gener med olika biologiska funktioner.
Till exempel har enbart CBP varit inblandat i en mängd olika patofysiologier inklusive kolorektal cancer såväl som skivepitelcancer i huvud och hals . I dessa sjukdomar har association av CBP med β-catenin visat sig främja cancercellsproliferation och sjukdoms aggressivitet, medan p300/β-catenin leder till celldifferentiering och/eller apoptos . CBP har också visat sig hjälpa till att modulera leverfunktionen genom att upprätthålla energihomeostas som svar på förändringar i cellnäringsförhållanden genom att reglera aktiviteten hos transkriptionsfaktorer och gener som är ansvariga för lipogenes och glukoneogenes . CBP är också inblandat i etiologierna för flera andra sjukdomar inklusive hematologiska maligniteter och andra solida tumörer, diabetes , schizofreni , Alzheimers sjukdom , depression och många andra neurologiska tillstånd.
Strukturera
Det funktionella CBP är ungefär 7362 nukleotider långt och kodar för 2441 aminosyror. CBP interagerar inte direkt med promotorelement; det förs till platsen via protein-protein-interaktioner som är resultatet av dess olika strukturella domäner som komplexbinder med andra transkriptionella ko-aktivatorer.
Övergångsadapter zinkfingerdomäner
CBP har två TAZ-domäner (Transitional Adapter Zinc Finger) som var och en består av fyra alfaspiraler stabiliserade av zinkjoner. Både TAZ1- och TAZ2-domäner gynnar de hydrofoba resterna inom amfipatiska aminosyrasekvenser, och deras bindningsaffinitet förstärks av interaktionen av sura rester med positiva sidokedjor. Faktorer som binder till TAZ2 regleras också potentiellt via acetylering på grund av dess närhet till acetyltransferasdomänen (KAT).
Cystein-histidinrika regioner
Även om det finns tre cystein - histidinrika domäner identifierade inom CBP, har endast domänerna 1 och 3 (CH1, CH3) fått sina strukturella funktioner lösta. Ett antal faktorer som associerar med CBP binder till antingen CH1- eller CH3-domänen, eller till båda, trots deras placeringar i motsatta ändar av proteinet. Hittills är lite känt om interaktionen mellan dessa två domäner. Den primära strukturen av CH1 och CH3 har visat sig bryta ner i konsensussekvenser som kan kelera zinkjoner (Zn2 + ). Utförda experiment visade också att resterna i dessa sekvenser är obligatoriska för att transkriptionell samaktivering ska ske av antingen CH1 eller CH3. CH2-regionen, belägen i mitten av proteinet, i dess acetyltransferasdomän, innehåller inte denna konsensussekvens och har inte definitivt visat sig binda zinkjoner.
Kinas-inducerbar domän interagerande domän
Aka KIX Domain , CREB Binding Domain, MYB Interaction Domain
Den K inas- inducerbara domänen (KID) Interacting Domain (KIX), är också proteindomänen på CBP och p300 där heterodimerer bildas från interaktionen av CBP (eller p300) med andra transkriptionsfaktorer och koaktivatorer. Den består av tre alfa- och två 3 10 helixar som har hög affinitet för amfipatiska proteinsekvenser. Intressant nog kan dessa spiraler vikas till ett antal olika konformers vilket gör det möjligt för domänen att bibehålla både en promiskuitetsnivå samtidigt som den utövar regulatorisk kontroll. KIX-domänen kontrollerar transkriptionshastigheten och har visat sig vara kritisk för hematopoetisk differentiering. Vissa av proteinerna som binder till denna domän har visat sig binda konkurrenskraftigt - som CREB och Myb - medan andra binder via allosteriskt samarbete som i fallet med MLL och Myb .
Bromodomain
Bromodomains (BRD) består av cirka 110 aminosyror, som fungerar för att känna igen acetylerade lysinmolekyler. De består av fyra vänsterhänta alfaspiraler förbundna med slingor som bildar hydrofoba bindningsfickor. Bromdomänen av CBP binder till regioner i genomet är rika på acetylerade lysinrester, vilket betyder att de har förlorat sin positiva laddning, vilket minskar histonaffiniteten för DNA, vilket gör regionen mer öppen och tillgänglig för transkription. Acetylerad p53 och STAT3 har visat sig binda till CBP:s bromdomän.
Lysinacetyltransferasdomän
Domänen med 380 proteinrester lysinacetyltransferas (KAT) är utan tvekan en av de viktigaste och mest identifierande strukturella komponenterna i CBP. Dess aktivitet regleras via fosforylering av CBP. Vad som är intressant är att det kan acetylera inte bara histoner utan också andra proteiner. För närvarande finns det över 100 kända substrat för CBP:s KAT-domän inklusive proteiner såsom p53, E2F -1-3, GATA-1 , MyoD och CREB . CBP:s förmåga att acetylera p53 via dess KAT-domän, vilket sedan ökar p53:s affinitet för CBP:s bromodomän visar upp en intressant mekanism genom vilken detta unika protein kan självbetjänande reglera gentranskription.
Nuclear Receptor Coactivator Binding Domain
Aka Interferon Response Factor Binding Domain (IBiD)
Nuclear Receptor Coactivator Binding Domain (NCBD) belägen vid c-terminalen av CBP, i dess obundna tillstånd, fluktuerar mellan flera konformationer. Bindning av ett målprotein till NCBD kommer att få det att vikas till tre helixar som specifikt fungerar för att associeras med de oordnade domänerna hos dess bindningspartners. Bland de proteiner som är kända för att binda till denna region inkluderar ACTR (p160) - en koaktivator för sköldkörtel- och retinoidreceptorerna, dess homolog SRC-1 , p53 och SMAD .
Interaktioner
Proteiner har visat sig interagera specifikt med CBP
Fungera
Denna gen uttrycks allestädes närvarande och är involverad i transkriptionell samaktivering av många olika transkriptionsfaktorer . CBP har två kritiska mekanismer genom vilka det kan reglera genuttryck: som ett acetyltransferas och som en proteinställning som hjälper till att rekrytera och konstruera de komplex som är nödvändiga för transkription eller kromatinremodellering. Fosforylering av CBP ökar dess acetyltransferasaktivitet, en process som antas regleras på ett cellcykelberoende sätt. Nya resultat tyder på att ny CBP-medierad posttranslationell N- glykosyleringsaktivitet förändrar konformationen av CBP-interagerande proteiner, vilket leder till reglering av genuttryck, celltillväxt och differentiering,
Skillnad från p300
Ofta i vetenskapliga artiklar (särskilt i mindre nyare) används CBP och p300 omväxlande som CBP/p300. Detta är en rimlig sammanslagning med tanke på sekvenshomologin, strukturell likhet och bindningsbeteende hos dessa två proteiner. Men pågående forskning visar att CBP och p300 upprätthåller distinkta biologiska funktioner och därför inte bör blandas ihop.
Det har rapporterats att trots att de har gemensamma histonsubstrat, när det finns lägre mängder histon eller acetyl-CoA tillgängligt, har CBP och p300 olika föredragna acetyltransferassubstrat. I ett experiment utfört som involverade det Kaposi-sarkom-associerade herpesviruset visades det patologiska proteinet (vIRF), vara uppreglerat av CBP och undertryckt av p300. p300 homozygota knockoutstudier på möss var embryonala dödliga, med felaktig neurulation och dålig hjärtutveckling som inträffade under deras begränsade överlevnad. Dessutom kunde fibroblasterna isolerade från dessa möss inte proliferera ordentligt och saknade retinsyrareceptorn . Transgeniskt förändrade möss homozygota för muterade kopior av CBP (saknade KAT-domänen), var också embryonala dödliga, men i stället hade dessa möss dålig vaskulär angiogenes och onormal hematopoies som kännetecknas av frånvaron av progenitorcellsproliferation och en förändrad hematopoetisk mikromiljö. Det faktum att både CBP och p300 homozygota knockouts var embryonala dödliga tyder på att dessa faktorer spelar en avgörande roll i embryogenes. De differentiella fenotyperna för dessa embryon indikerar också att CBP och p300 reglerar olika aspekter av embryologisk utveckling.
Roll i cellcykelreglering
Studier utförda i slutet av 1990-talet visade att topp CBP-acetyltransferasaktivitet inträffar vid övergången mellan G1/S- fasen av cellcykelns kontrollpunkt . Med tanke på koncentrationerna av CDK2 närvarande i cellen i detta skede av cellcykeln, antogs det att CDK2 kan vara en nyckelregulator för dessa post-translationella modifieringar. Det visade sig att administrering av cyklin E/CDK2-hämmare faktiskt hämmade den enzymatiska aktiviteten hos CBP:s KAT-domän. Andra proteiner som har visat sig fosforylera CBP inkluderar MAP Kinase , PKA och CAMK4 . Ser-133 har visat sig vara en viktig rest som fosforyleras av PKA för att initiera CBP-transkriptionsaktivitet.
E2F - familjen av transkriptionsfaktorer är avgörande för att ta en cell från G1- till S-fasen av cellcykeln. De binder till en sekvenskonsensus i promotorregionen av gener involverade i DNA-replikation. CBP (och p300) har visats interagera med E2F-proteiner som både en koaktivator och som ett acetyltransferas, varav det senare orsakar ökad E2F DNA-bindningsaffinitet. En knockout-studie som publicerades 2000, som använde en mikroinjektion av en antikropp mot CBP/p300 minskade avsevärt antalet celler som kunde gå in i S-fasen, vilket ytterligare stöder tanken att CBP är väsentligt i transkriptionen av nödvändiga faktorer G1/S Fasövergång.
CBP tros också underlätta processen för DNA-replikation under S-fasen genom att acetylera histoner runt replikationsursprunget . Acetylering av histoner , speciellt lysinrester i histonerna, försvagar den elektriska laddningsinteraktionen mellan histonen och DNA, vilket gör att detta område blir mer öppet och tillgängligt för det maskineri som krävs för DNA-replikation. Två histonacetyleringsmarkörer som har associerats med aktiva regioner inkluderar histon 3 lysin 18 acetylering (H3K18ac) och histon 3 lysin 27 acetylering (H3K27ac). Det har också visats att CBP acetylerar två endonukleaser ( FEN1 , DNA2 ) som är involverade i bearbetningen av Okazaki-fragment .
En annan nyckelkomponent i cellcykeln som regleras av CBP är det anafasfrämjande komplexet/cyklosomen ( APC/C). Detta komplex består av ett flertal underenheter som är grupperade i två underdomäner, "Arc Lamp" och "Platform", och fungerar som ett E3 ubiquitinligas som riktar sig mot komponenter relaterade till cellcykeln såsom cyklin B , securin och PLK1 för proteasom degradering. Två subenheter av APC/C har visat sig interagera direkt med CBP: AP5, som är beläget i plattformens underdomän, och AP7, beläget i underdomänen Arc Lamp. Experiment utförda med RNAi för att fullständigt undertrycka CBP och p300 visade signifikanta ökningar i proteinkoncentrationer för de som normalt riktas mot APC/C, och orsakade ett antal celler att stanna i den mitotiska fasen av cellcykeln.
CBP och p300 har visat sig acetylera nyckelfaktorer som är involverade i olika DNA-reparationsprocesser , inklusive basexcisionsreparation , nukleotidexcisionsreparation och icke-homolog ändfogning . CBP och p300 spelar en roll i acetyleringen av DNA - skaderesponsproteiner och denna posttranslationella modifiering påverkar deras funktion.
Roll i sjukdom
Rubinstein-Taybis syndrom
Rubinstein-Taybis syndrom (RTS) är en sällsynt genetisk störning som är resultatet av genetiska mutationer i antingen CBP eller p300. RTS Typ 1, som orsakas av CBP-mutationer, för vilka över 500 olika variationer har dokumenterats, står för ungefär 55 % av alla fall, medan RTS Typ 2, som orsakas av någon av de nästan 120 olika typerna av p300-mutationer, står för endast 8 % av de diagnostiserade fallen. Majoriteten av dessa mutationer har visat sig orsaka förlust av funktion hos genen via deletioner, punkt- eller trunkerande mutationer. Statistik indikerar att RTS-patienter har en ökad risk för cancer, med cirka 5 % av den som kan hänföras till pediatriska maligniteter som härrör från nervkammen. Individer med RTS har ofta skelettavvikelser, neuroanatomiska defekter och mentala funktionsnedsättningar inklusive lägre nivåer av intelligens, uppmärksamhetsbrist och nedsatt motorisk koordination.
| Cancer typ | N | % av prover muterade |
|---|---|---|
| Follikulärt lymfom | 66 | 33.3 |
| Skivepitelcancer i huden | 77 | 28.6 |
| Marginal zon B-cells lymfom | 15 | 13.3 |
| Diffust stort B-cellslymfom | 242 | 12,0 |
| Spottkörtelkarcinom | 63 | 9.5 |
| Blåskarcinom | 438 | 8.9 |
| Endometriekarcinom | 337 | 8,0 |
| Småcelligt lungkarcinom | 52 | 7.7 |
| ER+ Bröstkarcinom | 80 | 7.5 |
Cancer
CBP har visat sig spela en roll i varje skede av tumörutveckling. På grund av dess kritiska roll vid reglering av cellproliferation, tillväxt, migration och apoptos anses den vara en onkogen eller tumörsuppressor. Tvärtemot Hittills har ökad CBP-aktivitet varit inblandad i en mängd olika maligniteter inklusive bröstcancer , lungcancer , prostatacancer , kolorektal cancer, akut leukemi, huvud- och halscancer och många andra. Enligt Catalog of Somatic Mutations in Cancer ( COSMIC ) är de vanligaste genetiska mutationerna i CBP missense-mutationer (som står för ~71% av alla CBP-mutationer). De vanligaste mutationerna förekommer i KAT-domänen, vilket till stor del resulterar i antingen minskad eller hämmad acetyltransferasaktivitet.
Hematologiska maligniteter
Embryonala möss heterozygota för CBP (Cbp +/- ) uppvisade " extramedullär hematopoiesis , minskad benmärgscellularitet [ett lägre förhållande mellan benmärg och fett] och hematopoetiska differentieringsavvikelser." Vid 1 års ålder hade dessa möss en ökad förekomst av leukemi eller hematologisk neoplasi. Intressant nog visade tumörsekvensering förlust av heterozygositet för vildtypsallelen . En förklaring som föreslås för dessa experimentella resultat är att CBP spelar en roll vid självförnyelse av hematopoetiska stamceller.
I fall av patienter som diagnostiserats med akut myeloisk leukemi (AML) och myelodysplastiskt syndrom har CBP visat sig få funktion. Detta sker via kromosomala translokationer mellan CBP och andra acetyltransferaser som kallas monocyterna leukemi zinkfinger (MOZ), och eller mellan MORF (MOZ-relaterad faktor) och MLL (blandade leukemi) gener. Båda fallen resulterar i sammansmälta proteiner där C-terminalen av CBP går förlorad, och acetyltransferasdomänerna från båda proteinerna finns kvar, vilket resulterar i uppreglerad KAT-aktivitet och sjukdomsdebut.
För patienter med ett återfallande fall av akut lymfatisk leukemi (ALL), rapporterades att cirka 18 % av dem hade mutationer i CBP KAT-domänen.
Fasta tumörer
CBP-mutationer, även om de är relativt sällsynta, har identifierats i lungcancer . Ytterligare analys har också avslöjat att under de tidiga stadierna av respiratorisk epiteltumörbildning, finns det ökat uttryck i CBP såväl som AP-1 och cyklin D1, faktorer som är kända för att vara associerade med CBP-transkriptionsaktivitet. Detta överuttryck kan leda till nedströms signaleringshändelser som gynnar lungtumörutveckling.
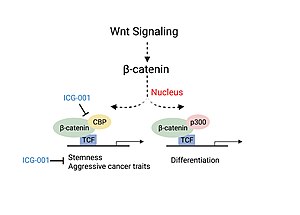
Kolorektal cancer och huvud- och halscancer (HNSCC) sjukdomens svårighetsgrad har kopplats till associeringen av CBP med β-catenin, en kritisk faktor som är involverad i den kanoniska Wnt-signalvägen . Association av CBP med β-catenin leder till transkription av gener som är ansvariga för mer aggressiva canceregenskaper inklusive närvaron av cancerstamcellspopulationer, minskad immuncellsinfiltration och sannolikhet för metastaser. Experiment som studerade användningen av en liten molekylhämmare av β-catenin/CBP association (ICG-001), som inte blockerar p300/β-catenin association, såg minskad karcinogenes och ökad cellulär differentiering och apoptos.
Ökad signalering av nukleär hormon, medierad av androgen (AR) och östrogen (ER) receptorer, är ansvarig för ett antal fall av prostata respektive bröstcancer . CBP är känt för att interagera med AR och ER i både samaktivator- och acetyltransferassammanhang. Hämning av CBP KAT-aktivitet har visat sig minska AR- och ER-signalering genom att nedreglera receptoruttryck; detta undertrycker i sin tur tumörbildning av båda maligniteterna.
Metabolisk homeostas
Energihomeostas , som är beroende av en balans mellan glukos och lipider , är avgörande för organismens överlevnad. Sjukdomar som involverar nedsatt metabol aktivitet inkluderar fetma , typ 2-diabetes (T2D) och icke-alkoholisk fettleversjukdom (NAFLD). I sammanhanget jämvikt främjar övernäring lipogenes (lipidsyntes) som svar på ökade glukos- och insulinkoncentrationer, och fasta främjar β-oxidation (lipidnedbrytning) och glukoneogenes (syntes av glukos). Experiment utförda i dietinducerade överviktiga möss såg ökad lipogenes driven av överuttryck av sterolregulatoriskt elementbindande protein 1C ( SREBP1C ), som fungerar i samordning med det kolhydratresponsiva elementbindande proteinet ( ChREBP ). Båda är transkriptionsfaktorer som är kritiska för lipogenes, och båda acetyleras av CBP, en post translationell modifiering som ökar deras transkriptionsaktivitet. För att balansera ökningen av lipidsyntesen behöver kroppen kunna exportera makromolekylen ut ur celler och lagring. Mikrosomalt triglyceridöverföringsprotein ( MTP ) är ansvarigt för lipoproteinsammansättning och utsöndring, och det associeras med ett RNA-helikas, DDX3, som interagerar med CBP och orsakar HNF4 -acetylering, vilket i sin tur ökar transkriptionshastigheten av MTP i en positiv återkopplingsslinga.
CBP har också en roll i regleringen av glukoshomeostas under fasta. Forskning har också visat att glukagon , ett hormon som frigörs när kroppen har lågt blodsocker, aktiverar cAMP-responselementbindande protein ( CREB ), som sedan binder till CBP som en koaktivator för transkription av FOXO1. FOXO1 är en transkriptionsfaktor för enzymer inklusive glukos-6-fosfatas och fosfoenolpyruvatkarboxykinas ( PECK1 ), som är nödvändiga för glukoneogenes.
Neurologiska störningar
CREB har visat sig ha neuroprotektiva egenskaper. På grund av dess koppling till CBP blir förståelsen av CBP:s roll i neurologiska vägar och hur avvikelser påverkar sjukdomen av allt större intresse. Många djurmodeller har designats för att utvärdera förändringar i motorik, inlärning och minnesfunktion hos möss med CBP-mutationer. Conditional knockout (cKO) möss som var hemizygota för CBP eller hade CBP-punktmutationer uppvisade minnesdefekter - specifikt relaterade till långtidsminnet . För möss med homozygota punktmutationer i deras CBP KIX-domän visade de nedsatt motorisk inlärning och utförande. I samband med de neurologiska utmaningar som RTS-patienter upplever (lägre nivåer av intelligens, uppmärksamhetsbrist) kan CBP tillskrivas en mängd olika neurologiska symtom som är karakteristiska för många olika typer av sjukdomar.
Fetala alkoholspektrumstörningar
Fetal alkoholspektrumstörningar (FASD) är en klassificering av sjukdomar som alla beror på alkoholexponering under graviditeten. Symtom på dessa störningar inkluderar dålig cerebellarberoende inlärning, motorisk koordination och försämrad balans. Hos råttor med FASD visades det att de hade minskade koncentrationer av CBP och lägre mängder H3 och H4 acetylering.
Huntingtons sjukdom
Huntingtons sjukdom (HD) är en dödlig, fortskridande neurodegenerativ sjukdom som är resultatet av en genetisk mutation i Huntingtin -genen som orsakar syntes av ett muterat huntingtin-protein (Htt). Symtom som oftast förknippas med denna sjukdom är rörelsestörningar, inklusive nedsatt motorisk funktion, beteendeförändring och kognitiv försämring som i slutändan leder till demens. Det har observerats i djurmodeller att HD-personer hade minskad CBP-aktivitet och minskad neuronal histonacetylering. Forskning har visat att mutHtt direkt interagerar med CBP Det har antagits att mutant Htt antingen kan bryta ner CBP eller direkt hämmar CBP:s acetyltransferasdomän.
Alzheimers sjukdom
Alzheimers sjukdom (AD) är en progressiv neurodegenerativ sjukdom vars patologi diagnostiseras baserat på närvaron av neuritiska amyloid beta (Aβ) plack och neurofibrillära tau (τ) trassel. Eftersom de exakta orsakerna till sjukdomen inte är tydliga, finns det ett antal olika mekanismer genom vilka CBP antas spela en roll i utvecklingen av AD. I många fall av tidig familjär AD (FAD) finns det mutationer av proteinerna som utgör enzymet som ansvarar för skapandet av Aβ-plack. CBP-aktiviteten minskar i frånvaro av dessa proteiner ( presenilin 1 eller presenilin 2) . Dessutom, i musmodeller av AD, har det visats att det finns en minskning av neuronal histonacetylering, en kritisk funktion av CBP.
Hämning av CBP
Med tanke på den kontroll som CBP har över en mängd olika fysiologiska processer har utvecklingen av inhibitorer för CBP-aktivitet blivit allt viktigare som potentiella terapier. Hittills har bara en bråkdel av det som har upptäckts gått vidare till kliniska prövningar.
| Läkemedel | Utvecklingsstadium | Sjukdom(ar)/ Målområden | Referens |
|---|---|---|---|
| A-485 | In vitro/in vivo | Hematologiska maligniteter, androgenreceptorpositiv prostatacancer |
|
| C646 | In vitro/in vivo | Fasta tumörer, neuroepitelial histonacetyleringsräddning | |
| CBP30 | In vitro | Autoimmuna sjukdomar | |
| CCS1477 | Fas 1b/2a | Avancerad kastrationsresistent prostatacancer, hematologiska maligniteter |
|
| CPI-637 | In vitro/in vivo | Kastrationsresistent prostatacancer | |
| dCBP-1 | I kisel | Multipelt myelom (MM) | |
| DC_CP20 | I kisel | Leukemi | |
| E7386 | Fas 1 | Fasta tumörer, förhindrar β-catenin/CBP protein-protein interaktioner |
|
| Garcinol | In vitro/in vivo | Cancer i matstrupen | |
| GNE-049 | In vitro/in vivio | Bröst- och prostatacancer | |
| GNE-207 | In vitro/in vivo | Akut myeloid leukemi (AML), potentiellt annat hematologiska maligniteter |
|
| GNE-781 | In vitro/in vivo | Akut myeloid leukemi (AML), potentiellt annat hematologiska maligniteter, prostata- och bröstcancer |
|
| HBS1 | In vitro/in vivo | Njurcellscancer | |
| I-CBP112 | In vitro/in vivo | CBP-bromdomän | |
| ICG-001 | In vitro/in vivo | Kolorektal cancer, skivepitelcancer i huvud och hals | |
| KCN1 | In vitro/in vivo | Gliom | |
| MYBMIM | I kisel | Akut myeloid leukemi (AML), förhindrar CBP/Myb protein-protein interaktioner |
|
| NASTRp | In vitro/in vivo | Lungadenokarcinom | |
| NEO2734 | In vitro/in vivo | Prostatacancer | |
| Nicur | I kisel | Gastrointestinala cancer | |
| OHM1 | In vitro/in vivo | Förhindrar interaktion mellan CBP/HIF-1α protein-protein | |
| PRI-724 | In vitro/in vivo | Leverfibros | |
| PU139 | In vitro/in vivo | Neuroblastom | |
| Y08197 | In vitro | Kastrationsresistent prostatacancer |
Vidare läsning
- Goldman PS, Tran VK, Goodman RH (1997). "Den multifunktionella rollen för co-aktivator CBP i transkriptionsreglering". Nya framsteg inom hormonforskning . 52 : 103–19, diskussion 119–20. PMID 9238849 .
- Marcello A, Zoppé M, Giacca M (mars 2001). "Flera sätt för transkriptionsreglering av HIV-1 Tat-transaktivatorn". IUBMB liv . 51 (3): 175–181. doi : 10.1080/152165401753544241 . PMID 11547919 . S2CID 10931640 .
- Matt T (2002). "Transkriptionell kontroll av det inflammatoriska svaret: en roll för det CREB-bindande proteinet (CBP)". Acta Medica Austriaca . 29 (3): 77–79. doi : 10.1046/j.1563-2571.2002.02010.x . PMID 12168567 .
- Combes R, Balls M, Bansil L, Barratt M, Bell D, Botham P, et al. (2002). "En bedömning av framstegen i användningen av alternativ i toxicitetstestning sedan publiceringen av rapporten från den andra FRAME Toxicity Committee (1991)". Alternativ till försöksdjur . 30 (4): 365–406. doi : 10.1177/026119290203000403 . PMID 12234245 . S2CID 26326825 .
- Minghetti L, Visentin S, Patrizio M, Franchini L, Ajmone-Cat MA, Levi G (maj 2004). "Flera åtgärder av humant immunbristvirus typ-1 Tat-protein på mikrogliacellfunktioner". Neurokemisk forskning . 29 (5): 965–978. doi : 10.1023/B:NERE.0000021241.90133.89 . PMID 15139295 . S2CID 25323034 .
- Kino T, Pavlakis GN (april 2004). "Partnermolekyler av accessoriskt protein Vpr av humant immunbristvirus typ 1" . DNA och cellbiologi . 23 (4): 193–205. doi : 10.1089/104454904773819789 . PMID 15142377 .
- Greene WC, Chen LF (2004). "Reglering av NF-kappaB-verkan genom reversibel acetylering". Novartis Foundation Symposium . Novartis Foundation Symposia. 259 : 208–17, diskussion 218–25. doi : 10.1002/0470862637.ch15 . ISBN 9780470862612 . PMID 15171256 .
- Liou LY, Herrmann CH, Rice AP (september 2004). "HIV-1-infektion och reglering av Tat-funktion i makrofager". The International Journal of Biochemistry & Cell Biology . 36 (9): 1767–1775. doi : 10.1016/j.biocel.2004.02.018 . PMID 15183343 .
- Pugliese A, Vidotto V, Beltramo T, Petrini S, Torre D (2005). "En översyn av HIV-1 Tat protein biologiska effekter". Cellbiokemi och funktion . 23 (4): 223–227. doi : 10.1002/cbf.1147 . PMID 15473004 . S2CID 8408278 .
- Bannwarth S, Gatignol A (januari 2005). "HIV-1 TAR RNA: målet för molekylära interaktioner mellan viruset och dess värd". Aktuell HIV-forskning . 3 (1): 61–71. doi : 10.2174/1570162052772924 . PMID 15638724 .
- Le Rouzic E, Benichou S (februari 2005). "Vpr-proteinet från HIV-1: distinkta roller längs den virala livscykeln" . Retrovirologi . 2 : 11. doi : 10.1186/1742-4690-2-11 . PMC 554975 . PMID 15725353 .
- Gibellini D, Vitone F, Schiavone P, Re MC (april 2005). "HIV-1 tat-protein och cellproliferation och överlevnad: en kort recension". The New Microbiologica . 28 (2): 95–109. PMID 16035254 .
- Hetzer C, Dormeyer W, Schnölzer M, Ott M (oktober 2005). "Avkoda Tat: biologin av HIV Tat posttranslationella modifieringar". Mikrober och infektion . 7 (13): 1364–1369. doi : 10.1016/j.micinf.2005.06.003 . PMID 16046164 .
- Peruzzi F (januari 2006). "De multipla funktionerna av HIV-1 Tat: spridning kontra apoptos" . Frontiers in Bioscience . 11 : 708-717. doi : 10.2741/1829 . PMID 16146763 . S2CID 12438136 .
externa länkar
- GeneReviews/NCBI/NIH/UW-post om Rubinstein-Taybis syndrom
- CREBBP+protein,+human vid US National Library of Medicine Medical Subject Headings (MeSH)
- NURSA C39
- Drosophila nejire - Den interaktiva flugan
- Mänskligt CREBBP- genomplacering och CREBBP- geninformationssida i UCSC Genome Browser .
Denna artikel innehåller text från United States National Library of Medicine, som är allmän egendom .