Farmakologi av bicalutamid
 | |
| Kliniska data | |
|---|---|
Administreringsvägar _ |
Via mun |
| Läkemedelsklass | Icke-steroid antiandrogen |
| Farmakokinetiska data | |
| Biotillgänglighet | Väl absorberad; absolut biotillgänglighet okänd |
| Proteinbindning |
Racemat : 96,1% ( R )-isomer : 99,6% (främst till albumin ) |
| Ämnesomsättning |
Lever (extensivt): • Hydroxylering ( CYP3A4 ) • Glukuronidering ( UGT1A9 ) |
| Metaboliter |
• Bicalutamid glukuronid • Hydroxybicalutamid • Hydroxybicalutamid gluc. (Alla inaktiva) |
| Eliminationshalveringstid _ |
Engångsdos: 6 dagar Kontinuerlig: 7–10 dagar |
| Exkretion |
Avföring : 43% Urin : 34% |
Farmakologin , för bicalutamid , en icke-steroid antiandrogen (NSAA) har varit välkarakteriserad. När det gäller farmakodynamik fungerar bicalutamid som en selektiv antagonist av androgenreceptorn (AR), det biologiska målet för androgener som testosteron och dihydrotestosteron (DHT). Den har ingen kapacitet att aktivera AR . Det minskar inte androgennivåerna och har ingen annan viktig hormonell aktivitet. Läkemedlet har progonadotropa effekter på grund av dess AR- antagonistaktivitet och kan öka produktionen och nivåerna av androgen, östrogen och neurosteroider . Detta resulterar i en mängd olika skillnader mellan monoterapi med bicalutamid jämfört med kirurgisk och medicinsk kastration , såsom indirekta östrogena effekter och associerade fördelar som bevarande av sexuell funktion och nackdelar som gynekomasti . Bicalutamid kan paradoxalt nog stimulera sen prostatacancer på grund av ackumulerade mutationer i cancern. När det används som monoterapi kan bicalutamid inducera bröstutveckling hos män på grund av dess östrogena effekter. Till skillnad från andra typer av antiandrogener kan det ha mindre negativ effekt på testiklarna och fertiliteten .
När det gäller farmakokinetiken absorberas bicalutamid väl när det tas genom munnen . Emellertid minskar absorptionen vid högre doser. Den når maximala konstanta nivåer efter 4 till 12 veckors behandling. Bicalutamid visar omfattande plasmaproteinbindning , främst till albumin . Den passerar blod-hjärnbarriären och utövar effekter i det centrala nervsystemet . Bicalutamid metaboliseras i levern genom hydroxylering och glukuronidering . Metaboliterna av bicalutamid är inte kända för att vara aktiva . Läkemedlet har en mycket lång biologisk halveringstid på 6 dagar vid engångsdos och 7 till 10 dagar vid upprepad administrering. Bicalutamid och dess metaboliter elimineras i urin , feces och galla , huvudsakligen i form av konjugat . Farmakokinetiken för bicalutamid påverkas inte av föda , ålder , kroppsvikt , nedsatt njurfunktion eller lätt till måttligt nedsatt leverfunktion , men etnicitet kan påverka dess farmakokinetik i vissa fall.
Farmakodynamik
| Antiandrogen | AR | PR-B | |||
|---|---|---|---|---|---|
| K i (nM) | IC 50 (nM) | jag max (%) | IC 50 (nM) | jag max (%) | |
| Bicalutamid | 117 | 157 | 78 | 1 819 | 88 |
| Cyproteronacetat | 14 | 26 | 48 | >10 000 | 12 |
| Hydroxiflutamid | 27 | 15 | 83 | 2 013 | 90 |
| Mifepriston | 22 | 5 | 75 | 0,18 | 96 |
| Anmärkningar: IC 50 -värden är för funktionell antagonism. I max är maximal hämning. Källa: | |||||
| Förening | AR | PR | ER | GR | HERR |
|---|---|---|---|---|---|
| Bicalutamid | 14–54 | 3 500–7 200 | >1 000 000 | 44 000–320 000 | ≥360 000 |
| Dihydrotestosteron | 0,5–3,1 | 280–440 | 38 000–340 000 | 2 700–20 000 | 2 100–2 300 |
| Noteringar: Värden är Ki eller IC50 ) (nM) för bindningsinhibering (affinitet . Källor: | |||||
Antiandrogen aktivitet

| Förening | RBA |
|---|---|
| Metribolon | 100 |
| Dihydrotestosteron | 85 |
| Cyproteronacetat | 7.8 |
| Bicalutamid | 1.4 |
| Nilutamid | 0,9 |
| Hydroxiflutamid | 0,57 |
| Flutamid | <0,0057 |
|
Anmärkningar: |
|
| Antiandrogen | Relativ styrka |
|---|---|
| Bicalutamid | 4.3 |
| Hydroxiflutamid | 3.5 |
| Flutamid | 3.3 |
| Cyproteronacetat | 1.0 |
| Zanoterone | 0,4 |
| Beskrivning: Relativ styrka av oralt administrerade antiandrogener för att antagonisera 0,8 till 1,0 mg/kg sc testosteronpropionat -inducerad viktökning i ventral prostata hos kastrerade omogna hanråttor. Högre värden betyder större styrka. Källor: Se mall. | |

Bicalutamid fungerar som en mycket selektiv konkurrerande tyst antagonist av androgenreceptorn (AR) ( IC 50 = 159–243 nM), det huvudsakliga biologiska målet för androgena könshormonerna testosteron och dihydrotestosteron (DHT). Den har ingen kapacitet att aktivera AR under normala fysiologiska omständigheter. Förutom konkurrerande antagonism av AR , har bikalutamid visat sig accelerera nedbrytningen av AR , och denna verkan kan också vara involverad i dess aktivitet som en antiandrogen. Aktiviteten av bicalutamid ligger i ( R ) -isomeren , som binder till AR med en affinitet som är cirka 30 gånger högre än den för ( S )-isomeren. Nivåer av ( R )-isomeren är också anmärkningsvärt 100 gånger högre än de för ( S )-isomeren vid steady-state.
I förhållande till dess selektivitet för AR , till skillnad från steroida antiandrogener (SAA) såsom cyproteronacetat (CPA) och megestrolacetat , interagerar bicalutamid inte särskilt viktigt med andra steroidhormonreceptorer (inklusive ER , PR , GR eller MR ), och har i enlighet med detta ingen kliniskt relevant ytterligare hormonell aktivitet utanför målet ( östrogen eller antiöstrogen , gestagen eller antiprogestogen , glukokortikoid eller antiglukokortikoid , eller mineralokortikoid eller antimineralokortikoid ). Det har emellertid rapporterats att bicalutamid har svag affinitet för progesteronreceptorn ( PR) (~100 till 500 gånger lägre än för AR ), där den fungerar som en antagonist (med endast ~12 gånger lägre funktionell hämning relativt sett) till AR i en studie). Bicalutamid kan därför ha viss antiprogestogen aktivitet, även om den kliniska relevansen av detta är okänd. Bicalutamid hämmar inte 5α-reduktas och är inte känt för att hämma andra enzymer involverade i androgensteroidogenes ( t.ex. CYP17A1 ) . Även om bicalutamid inte binder till ER , kan det öka östrogennivåerna sekundärt till blockad av AR när det används som monoterapi hos män, och av denna anledning kan medicinen indirekt aktivera ERs till en viss grad och följaktligen ha vissa indirekta östrogena effekter hos män. Också i motsats till SAA , hämmar eller undertrycker bicalutamid varken androgenproduktionen i kroppen (dvs. det fungerar inte som en antigonadotropin eller steroidogeneshämmare ), och förmedlar istället uteslutande dess antiandrogeneffekter genom att blockera androgenbindning och efterföljande receptoraktivering vid nivån av AR . _
Förutom den klassiska nukleära AR , har bicalutamid också identifierats som en potent antagonist av ZIP9 , en membranandrogenreceptor (mAR) och zinktransporterprotein , med en IC50 ) på 66,3 nM (relativt Kd = 17,9 nM för testosteron . Detta protein verkar vara involverat i prostatacancer och bröstcancer . Bicalutamid misslyckades med att påverka testosteronsignalering medierad av GPRC6A , en annan mAR , å andra sidan.
| Arter | IC 50 (nM) | RBA (kvot) | ||||
|---|---|---|---|---|---|---|
| Bicalutamid | 2-hydroxiflutamid | Nilutamid | Bica / 2-OH-influensa | Bica / nilu | Ref | |
| Råtta | 190 | 700 | ND | 4.0 | ND | |
| Råtta | ~400 | ~900 | ~900 | 2.3 | 2.3 | |
| Råtta | ND | ND | ND | 3.3 | ND | |
| Råtta a | 3595 | 4565 | 18620 | 1.3 | 5.2 | |
| Mänsklig | ~300 | ~700 | ~500 | 2.5 | 1.6 | |
| Mänsklig | ~100 | ~300 | ND | ~3,0 | ND | |
| Människan a | 2490 | 2345 | 5300 | 1.0 | 2.1 | |
| Fotnoter: a = Kontroversiell data. Källor: Se mall. | ||||||
Läkemedelsnivåer, androgennivåer och effekt
Affiniteten för bicalutamid för AR är ungefär 30 till 100 gånger lägre än den för DHT ( IC 50 ≈ 3,8 nM), den huvudsakliga endogena liganden för receptorn i prostatakörteln. Tillräckligt höga relativa koncentrationer av bicalutamid (1 000- till 10 000-faldigt överskott) kan dock helt förhindra aktivering av AR av androgener som DHT och testosteron och efterföljande uppreglering av transkriptionen av androgenkänsliga gener och associerade effekter. Vid steady-state, i förhållande till det normala intervallet för vuxna män för testosteronnivåer (300–1 000 ng/dL), är cirkulerande koncentrationer av bicalutamid vid 50 mg/dag ungefär 600 till 2 500 gånger högre och vid 150 mg/dag runt 1 500 till 8 000 gånger högre än cirkulerande testosteronnivåer, medan bikalutamidkoncentrationer, i förhållande till de genomsnittliga testosteronnivåerna hos män som har kastrerats kirurgiskt (15 ng/dL), är cirka 42 000 gånger högre än testosteronnivåerna vid 50 mg/dag.
Medan testosteron är den huvudsakliga cirkulerande androgenen, är DHT den största androgenen i prostatakörteln. DHT- nivåerna i cirkulationen är relativt låga och endast cirka 10% av de cirkulerande testosteronnivåerna. Omvänt är lokala koncentrationer av DHT i prostatakörteln 8 till 10 gånger högre än cirkulerande nivåer av DHT . Detta beror på högt uttryck av 5α-reduktas i prostatakörteln, som mycket effektivt katalyserar bildandet av DHT från testosteron så att över 90 % av det intraprostatiska testosteronet omvandlas till DHT . I förhållande till testosteron DHT 2,5 till 10 gånger så potent som en AR- agonist i bioanalyser , och är därför en mycket starkare androgen i jämförelse. Som sådan AR- signalering exceptionellt hög i prostatakörteln, och effektiviteten av bicalutamidmonoterapi vid behandling av prostatacancer, vilket är ungefär likvärdigt med gonadotropinfrisättande hormonanaloger (GnRH-analoger), visar bicalutamids förmåga att starkt antagonisera AR . Å andra sidan GnRH -analog monoterapi endast en 50 till 60 % minskning av nivåerna av DHT i prostatakörteln, och kombinerad androgenblockad (CAB), kombinationen av kirurgisk kastration eller en GnRH -analog och bicalutamid, är betydligt effektivare än antingen enbart modalitet vid behandling av prostatacancer. Bicalutamidmonoterapi har visat sig minska cirkulerande nivåer av prostataspecifikt antigen (PSA), en markör för prostatacancertillväxt, med 57 % vid 10 mg/dag, 73 % vid 30 mg/dag, 90 % vid 50 mg/dag, 97% vid 100 mg/dag och 97% vid 150 mg/dag, medan en 97% minskning av PSA observeras med 50 mg/dag bicalutamid som en del av CAB. Det har också rapporterats att monoterapi med bikalutamid minskar mediannivåerna av cirkulerande PSA efter 3 månader med 86,7 % vid 100 mg/dag, 91,1 % vid 150 mg/dag och 93,8 % vid 200 mg/dag. Över en monoterapidos av bicalutamid på 200 mg/dag, upp till 600 mg/dag, når minskningar av PSA-nivåer en platå.
Trots de höga medicinnivåer som uppnås, på grund av deras relativt låga affinitet för AR , har det föreslagits att 5 till 10% av DHT kan förbli oblockerad i prostatakörteln med CAB med standarddoser av första generationens NSAA . I enlighet med andra generationens NSAA som enzalutamid och apalutamid , som har 5 till 10 gånger högre affinitet för AR än bikalutamid, har visat sig vara mer effektiva än bicalutamid vid behandling av prostatacancer. I TERRAIN- och STRIVE-studierna, som jämförde bicalutamid och enzalutamid som en komponent i CAB och fann att enzalutamid förlängde livslängden med 3 till 4 gånger så lång tid som bicalutamid, var dosen av enzalutamid som användes (160 mg) över 3 gånger så mycket som av den dos av bicalutamid som används (50 mg). Som ett resultat har det föreslagits att den 50 mg/dag dosen av bicalutamid som används i denna studie och i CAB i allmänhet kan vara suboptimal. Detta är i enlighet med kliniska fynd att PSA minskar med CAB vid användning av bicalutamidplatå vid en dos av bicalutamid på 150 till 200 mg/dag.
Hos kvinnor är de totala testosteronnivåerna 20 gånger och nivåerna av fritt testosteron 40 gånger lägre jämfört med män. Dessutom, medan monoterapi med bicalutamid kan öka testosteronnivåerna med upp till två gånger hos män, ökar inte läkemedlet testosteronnivåerna hos kvinnor. Av dessa skäl kan mycket lägre doser av bicalutamid (t.ex. 25 mg/dag i hirsutismstudierna) användas till kvinnor med betydande antiandrogen effekt.
Påverkar hormonnivåer

| Dosering | Innan | Efter a | Skillnad | Förändra |
|---|---|---|---|---|
| 10 mg/dag | 400 ng/dL | 490–520 ng/dL | +90–120 ng/dL | +21–29 % |
| 30 mg/dag | 320 ng/dL | 490–550 ng/dL | +170–230 ng/dL | +55–73 % |
| 50 mg/dag | 370 ng/dL | 550–610 ng/dL | +180–240 ng/dL | +46–62 % |
| 100 mg/dag | 320 ng/dL | 460–490 ng/dL | +140–170 ng/dL | +45–55 % |
| 150 mg/dag | 290 ng/dL | 460–490 ng/dL | +170–200 ng/dL | +60–70 % |
| 200 mg/dag | 320 ng/dL | 520–550 ng/dL | +200–230 ng/dL | +64–73 % |
| Fotnoter: a = Efter 29 till 85 dagars behandling. Källor: | ||||
Hos män förhindrar blockad av AR av bicalutamid i hypofysen och hypotalamus den negativa återkopplingen av androgener på hypotalamus–hypofys–gonadala (HPG) axeln , vilket resulterar i en ökning av utsöndringen och nivåerna av luteiniserande hormon (LH). Follikelstimulerande hormonnivåer (FSH) förblir däremot i stort sett oförändrade. Ökningen av LH- nivåerna leder till en höjning av androgen- och östrogennivåerna. Vid en dos på 150 mg/dag har bikalutamid visat sig öka testosteronnivåerna med cirka 1,5 till 2 gånger (59–97 % ökning) och östradiolnivåerna med cirka 1,5 till 2,5 gånger (65–146 % ökning) . Nivåerna av DHT ökar också i mindre utsträckning (med 24–30 %), och koncentrationerna av könshormonbindande globulin (SHBG) och prolaktin ökar också (med 8–42 % respektive 40–65 %) sekundärt till ökningen av östradiolnivåerna. De östradiolkoncentrationer som produceras hos män genom monoterapi med bicalutamid sägs approximera de låga normala östradiolnivåerna hos en premenopausal kvinna, medan testosteronnivåerna i allmänhet förblir i den övre delen av det normala manliga intervallet och sällan överskrider det. Doser av bicalutamid på 10 mg, 30 mg och 50 mg per dag har visat sig ge en "måttlig" effekt på könshormonnivåerna hos män med prostatacancer (särskilt ger indikation på att läkemedlet har kliniskt relevanta antiandrogeneffekter hos män vid en dos så låg som 10 mg/dag). De förhöjda nivåerna av gonadotropiner och gonadale steroider associerade med NSAA- monoterapi är ett unikt endokrint tillstånd som kan beskrivas som " hypergonadotrop hypergonadism" .
Bicalutamid ökar androgen- och östrogennivåerna endast hos män, och gör det inte hos kvinnor. Detta beror på att androgennivåerna är jämförelsevis mycket lägre hos kvinnor och i sin tur utövar liten eller ingen basal suppression av HPG -axeln. Minimala eller inga förändringar av betydelse i nivåerna av totalt testosteron, fritt testosteron, dihydrotestosteron, östradiol, androstenedion (A4), dehydroepiandrosteron (DHEA), dehydroepiandrosteronsulfat (DHEA-S), 3α-androstandiol glukuronid ( 3α-ADG), progesteron , -hydroxiprogesteron (17α-OHP), LH , FSH , prolaktin eller SHBG har observerats hos kvinnor med hirsutism med eller utan polycystiskt ovariesyndrom som behandlats med 25 eller 50 mg/dag bicalutamid under 6 till 12 månader. I en studie på kvinnor med polycystiskt ovariesyndrom, sänkte 25 mg/dag bicalutamid signifikant nivåerna av totalt och fritt testosteron och signifikant ökade nivåerna av SHBG . Förutom de minimala förändringarna i hormonnivåer hos kvinnor, även om bikalutamidmonoterapi ökar gonadotropin- och könshormonnivåerna hos män, kommer detta inte att inträffa om bicalutamid kombineras med ett antigonadotropin som en GnRH-analog, östrogen eller gestagen , eftersom dessa mediciner bibehåller negativ feedback på HPG-axeln.
Anledningen till att testosteronnivåerna är förhöjda men nästan alltid förblir i det normala manliga intervallet med bikalutamidmonoterapi tros bero på de samtidigt ökade nivåerna av östradiol, eftersom östradiol är potent antigonadotropiskt och begränsar utsöndringen av LH . Faktum är att östradiol är en mycket starkare hämmare av gonadotropinsekretion än testosteron, och även om de cirkulerande koncentrationerna av östradiol är mycket lägre än testosteron hos män, sägs det att östradiol ändå troligen är den viktigaste återkopplingsregulatorn för gonadotropinsekretion i detta sex. I enlighet med detta klomifen , en selektiv östrogenreceptormodulator med antiöstrogen aktivitet, visat sig öka testosteronnivåerna till så mycket som 250 % av initiala värden hos män med hypogonadism , och en studie av klomifenbehandling hos normala män observerade ökningar av FSH och LH nivåer på 70–360 % respektive 200–700 %, med ökningar av testosteronnivåer som liknade ökningarna med gonadotropinerna. Förutom systemisk eller cirkulerande östradiol kan lokal aromatisering av testosteron till östradiol i hypotalamus och hypofysen bidra till undertryckande av gonadotropinsekretion.
Bicalutamid mer än blockerar effekterna av de ökade testosteronnivåerna som det inducerar hos män, vilket bevisas av dess dosberoende antiandrogena effekter och av det faktum att monoterapi med läkemedlet är ungefär lika effektivt som GnRH-analogterapi vid behandling av prostatacancer . Däremot förblir effekterna av de förhöjda östrogennivåerna obestridda av bikalutamid, och detta är till stor del ansvarigt för de feminiserande biverkningarna (t.ex. gynekomasti) av läkemedlet hos män.
Testosteronnivåerna sjunker med åldern hos män och yngre män har högre testosteronnivåer i genomsnitt än äldre män. Män med prostatacancer som behandlas med bicalutamid är relativt äldre. Ökningen av testosteronnivåer med NSAA som flutamid och bicalutamid kan resultera i högre absoluta nivåer av testosteron och östradiol hos yngre män än hos äldre män. I en studie som administrerade flutamid ökade nivåerna av fritt testosteron hos unga män från cirka 26 pg/ml vid baslinjen till cirka 34 pg/ml med flutamid (+31 %) och hos äldre män från cirka 16 pg/ml vid baslinjen till cirka 21 pg/ml (+31%) med flutamid. Följaktligen var nivåerna av fritt testosteron med flutamid cirka 1,6 gånger högre hos unga män än hos äldre män i denna studie. När det gäller östradiol ökade de totala östradiolnivåerna hos unga män från cirka 26 pg/ml vid baslinjen till cirka 45 pg/ml med flutamid (+73 %) och hos äldre män ändrades från cirka 31 pg/ml till cirka 30 pg/ml. ml (–3%). Andra studier har på liknande sätt funnit relativt höga absoluta testosteronnivåer med NSAA hos unga män. Till exempel fann en studie som administrerade flutamid till män i sen pubertet att de totala testosteronnivåerna ökade från 729 ng/dL vid baslinjen till 991 ng/dL med flutamid (+34%).
Skillnader från kastrering
Det har föreslagits att ökningen av östrogennivåer orsakad av NSAA som bicalutamid kompenserar för androgenblockad i hjärnan, vilket kan förklara skillnader i biverkningsprofilerna för dessa läkemedel i förhållande till GnRH- analoger/kastrering, kombinerad androgenblockad och CPA (som sänker däremot både androgen- och östrogennivåerna). När det gäller sexuellt intresse och funktion stöds denna uppfattning av en mängd olika fynd, inklusive djurstudier som visar att östrogenbrist resulterar i minskat sexuellt beteende, behandling med tamoxifen som resulterar i avsevärt sänkt libido hos 30 % av männen som får det för manlig bröstcancer , och östrogenadministrering som återställer libido och frekvensen av samlag hos män med medfödd östrogenbrist, bland annat.
Flera metaboliter av testosteron och DHT , inklusive estradiol, 3α-androstanediol och 3β-androstanediol , är östrogener (främst potenta ERβ- agonister i fallen av de två sistnämnda), och 3α-androstanediol är dessutom en potent GABA A -receptor-potentierande receptor-steroid. På grund av det faktum att bicalutamid inte sänker testosteronnivåerna, skulle nivåerna av dessa metaboliter inte heller förväntas sänkas, till skillnad från terapier som GnRH -analoger. (Ja, nivåerna av testosteron, DHT och östradiol höjs faktiskt av bicalutamidbehandling, och av denna anledning kan nivåerna av 3α- och 3β-androstanediol vara förhöjda i någon grad på liknande sätt.) Dessa metaboliter av testosteron har visat sig ha AR - oberoende positiva effekter på sexuell motivation, och kan vara involverade i bevarandet av sexuellt intresse och funktion av bicalutamid och andra NSAA . En studie fann dock att en kombination av bicalutamid och dutasterid , en 5α-reduktashämmare och hämmare av neurosteroidbiosyntes , gav färre sexuella biverkningar än GnRH -analogterapi, vilket specifikt antyder rollen av östradiol i bevarandet av sexuellt intresse och funktion med bicalutamid monoterapi. snarare än av DHT-metaboliter.
Som en alternativ möjlighet till testosteronmetaboliter som bevarar sexuell lust och funktion med bicalutamid, har det föreslagits att bicalutamid kanske inte kan blockera androgeners verkan i hjärnan i en tillräcklig grad för att orsaka betydande sexuella försämringar.
Det har rapporterats att bicalutamid, överraskande nog, inte har någon antianabol effekt på testosteronpropionat -inducerade ökningar av levator ani muskelvikt vid doser som hämmar och till och med helt förhindrar testosteronpropionat-inducerad tillväxt av prostatakörteln och sädesblåsor hos råttor. Som sådan har det sagts att bicalutamid, baserat på preklinisk forskning , inte har några markanta antianabola effekter. Men högre doser av bicalutamid kan avsevärt hämma tillväxten av levator ani-muskeln hos råttor. I vilket fall som helst, analogt med djurfynd, har bikalutamidmonoterapi visat sig signifikant bevara muskelmassa och muskelstyrka hos äldre män med prostatacancer i förhållande till GnRH-agonister. Det är anmärkningsvärt att i motsats till kastration bevarar och ökar bicalutamid östrogennivåerna, och östrogener tros ha positiva effekter på skelettmuskulaturen, inklusive på muskelmassa.
Paradoxal stimulering av sent stadium av prostatacancer
Även om en ren eller tyst antagonist av AR under normala omständigheter, har bicalutamid, såväl som andra tidigare antiandrogener som flutamid och nilutamid, visat sig ha svaga partiella agonistegenskaper vid AR -överuttryck och agonistaktivitet i fallet med vissa mutationer i den ligandbindande domänen (LBD) av AR . Eftersom båda dessa omständigheter så småningom kan uppstå vid prostatacancer, utvecklas vanligtvis resistens mot bicalutamid och läkemedlet har potential att paradoxalt nog stimulera tumörtillväxt när detta händer. Detta är mekanismen för fenomenet antiandrogenabstinenssyndrom , där antiandrogenavbrytande paradoxalt nog saktar ned tumörtillväxthastigheten. Det nyare läkemedlet enzalutamid har visat sig inte ha agonistiska egenskaper i samband med överuttryck av AR , även om vissa mutationer i AR fortfarande kan omvandla det från en antagonist till agonist.
Induktion av bröstutveckling
| Studie | N | Dosering | Gynekomasti | Ömhet i brösten | Ref |
|---|---|---|---|---|---|
| Tyrrell et al. (1998) a | 386 | 10 mg/dag | 9 % | 11 % | |
| 30 mg/dag | 26 % | 42 % | |||
| 50 mg/dag | 36 % | 48 % | |||
| 100 mg/dag | 79 % | 86 % | |||
| 150 mg/dag | 78 % | 89 % | |||
| 200 mg/dag | 79 % | 79 % | |||
| Kennealey & Furr (1991) f | 210 | 10 mg/dag | 29 % | 38 % | |
| 30 mg/dag | 60 % | 64 % | |||
| 50 mg/dag | 52 % | 60 % | |||
| Zanardi et al. (2006) c | 66 | 0 mg/vecka (kontroller) | 0 % | 0 % | |
| 50 mg/vecka (~7 mg/dag) | 44 % | 32 % | |||
| 100 mg/vecka (~14 mg/dag) | 50 % | 64 % | |||
| Fotnoter: a = Testosteronnivåerna ökade till ~460–610 ng/dL och östradiolnivåerna till ~32–51 pg/ml. b = Testosteronnivåerna ökade till ~505–715 ng/dL och östradiolnivåerna till ~32–53 pg/ml. c = Testosteronnivåerna ökade till ~540–600 ng/dL och östradiolnivåerna till ~29–34 pg/ml. | |||||
Hos transpersoner är bröstutveckling en önskad effekt av antiandrogen- och/eller östrogenbehandling. Bicalutamid inducerar bröstutveckling hos individer som tilldelats en man vid födseln genom två mekanismer: 1) blockering av androgensignalering i bröstvävnad; och 2) ökande östrogennivåer. Östrogen är ansvarigt för induktion av bröstutveckling under normala omständigheter, medan androgener kraftfullt undertrycker östrogeninducerad brösttillväxt. Det har visat sig att mycket låga nivåer av östrogen kan inducera bröstutveckling i närvaro av låg eller ingen androgensignalering. I enlighet med detta inducerar bicalutamid inte bara gynekomasti i hög takt när det ges som monoterapi till män med prostatacancer (47–85 %; 66 % i en mycket stor studie), på samma sätt som högdos östrogenbehandling med dietylstilbestrol ( 41– 77 %), har NSAA visat sig resultera i en högre incidens av gynekomasti i kombination med en GnRH -analog (13–25 %) jämfört med GnRH -analogbehandling eller enbart kastrering (1–16 %) (trots endast förekomst av kastrera nivåer av östrogen i båda fallen). Frekvensen av gynekomasti med CAB är också högre än med CPA monoterapi (7%).
En studie av män som behandlats med NSAA (flutamid eller bicalutamid) monoterapi för prostatacancer fann att NSAA inducerade full ductal utveckling och måttlig lobuloalveolär utveckling av brösten ur histologisk synvinkel. Studien fann också att behandling av transpersoner med östrogen och CPA (som är gestagen utöver antiandrogen, till skillnad från NSAA ) däremot resulterade i full lobuloalevolär utveckling, såväl som graviditetsliknande brösthyperplasi hos två av försökspersonerna. Dessutom observerades det att den lobuloalveolära mognaden vände vid avbrytande av CPA efter könsbyteoperation hos dessa individer. Man drog slutsatsen att gestagen utöver antiandrogen/östrogenbehandling krävs för induktion av fullständig histologisk bröstutveckling hos kvinnor (dvs. det inkluderar fullständig lobuloalveolär mognad), och att fortsatt gestagenbehandling är nödvändig för att bibehålla sådan mognad. Det bör dock noteras att även om dessa fynd kan ha viktiga implikationer i samband med amning och amning, svarar epitelvävnad för ungefär endast 10 % av bröstvolymen (med huvuddelen av brösten (80–90 %) representeras av stroma eller fettvävnad ), och det är osäkert i vilken utsträckning, om någon, att utvecklingen av lobuloalveolära strukturer (en form av epitelvävnad ) bidrar till bröststorlek och/eller form.
Effekter på spermatogenes och fertilitet
Spermatogenes och manlig fertilitet är beroende av FSH , LH och höga nivåer av testosteron i testiklarna. LH verkar inte vara inblandad i spermatogenesen utanför dess roll i att inducera produktion av testosteron av Leydig-cellerna i seminiferous tubuli (som utgör cirka 80 % av huvuddelen av testiklarna), medan detta inte är fallet för FSH , vilket är viktigt inblandat. I enlighet med det faktum att testiklarna är källan till 95 % av cirkulerande testosteron i kroppen, är de lokala nivåerna av testosteron inuti testiklarna extremt höga, från 20 till 200 gånger högre än cirkulerande koncentrationer. Dessutom krävs höga nivåer av testosteron i testiklarna för spermatogenes, även om endast en liten del (5–10%) av normala nivåer faktiskt verkar vara nödvändiga för spermatogenes.
Till skillnad från antigonadotropa antiandrogener som CPA- och GnRH -analoger har det rapporterats att monoterapi med bicalutamid (vid 50 mg/dag) har mycket liten eller ingen effekt på testiklarnas ultrastruktur och på spermatogenesen hos män även efter långtidsbehandling (>4 år). Detta kan förklaras av de extremt höga lokala nivåerna av testosteron i testiklarna, genom att det är troligt att systemisk bicalutamidterapi inte kan uppnå koncentrationer av läkemedlet i testiklarna som avsevärt kan blockera androgensignalering i denna del av kroppen . Detta är särskilt fallet med tanke på att bicalutamid ökar cirkulerande testosteronnivåer, och i förlängningen gonadal testosteronproduktion, med upp till två gånger hos män, och att endast en liten del av normala intratestikulära testosteronnivåer, och i förlängningen androgenverkan, verkar vara nödvändiga för att upprätthålla spermatogenesen. Bicalutamid monoterapi vid 50 mg/dag orsakar ingen eller kliniskt oviktig Leydig-cellshyperplasi .
I motsats till bikalutamid och andra rena antiandrogener eller NSAA , undertrycker antigonadotropa antiandrogener gonadotropinsekretion, vilket i sin tur minskar testosteronproduktionen i testiklarna samt underhållet av testiklarna av FSH , vilket resulterar i atrofi och förlust av deras funktion. Som sådan kan bicalutamid och andra NSAA unikt ha potentialen att bevara testikelfunktion och spermatogenes och därmed manlig fertilitet i förhållande till alternativa terapier. I enlighet med denna uppfattning fann en studie att långvarig, högdosbehandling av bicalutamid hade minimala effekter på fertiliteten hos hanråttor. En annan studie fann dock att administrering av lågdos bicalutamid resulterade i testikelatrofi och minskade antalet könsceller i testiklarna hos råttor av hankön med nästan 50 %, även om graden av framgångsrik befruktning och graviditet efter parning inte bedömdes. Ytterligare studier visade att bicalutamid minskade testikelvikten, förändrade testiklarnas histologi och minskade antalet spermier hos hanråttor. Ännu en studie fann att bicalutamid inte har någon effekt på testiklarnas vikt eller spermatogenes hos hanråttor.
Behandling av män med exogent testosteron eller annan AAS resulterar i undertryckande av gonadotropinsekretion och gonadal testosteronproduktion på grund av deras antigonadotropa effekter eller aktivering av AR i hypofysen, vilket resulterar i hämning eller avskaffande av spermatogenes och fertilitet:
Behandling av en infertil man med testosteron förbättrar [inte] spermatogenesen, eftersom exogent administrerat testosteron och dess metabolit östrogen kommer att undertrycka både GnRH -produktion av hypotalamus och luteiniserande hormonproduktion av hypofysen och därefter undertrycka produktionen av testikeltestosteron. Dessutom behövs höga nivåer av testosteron inuti testiklarna och detta kan aldrig uppnås genom oral eller parenteral administrering av androgener. Undertryckande av testosteronproduktion av leydigcellerna kommer att resultera i en bristfällig spermatogenes, vilket kan ses hos män som tar anabola-androgena steroider.
Däremot skulle rena AR- antagonister i teorin resultera i motsatsen (även om minskad spermavolym och sexuell dysfunktion kan förekomma):
Det är teoretiskt sett en god hypotes att spermatogenesen kan ökas genom att indirekt stimulera FSH- och LH -sekret från hypofysen. Men för att detta ska bli fruktbart krävs användning av testosteronantagonist för att omintetgöra den negativa återkopplingseffekten av cirkulerande testosteron på frisättningen av FSH och LH , vilket ökar utsöndringen av testosteron och spermatogenes. Tyvärr kommer en testosteronantagonist att vara oacceptabel för män, eftersom den kan minska sekundära sexuella funktioner inklusive erektion och utlösning som är avgörande för en framgångsrik befruktning.
Men även om bicalutamid inte verkar ha en negativ inverkan på testikelspermatogenesen, och friska spermier kan produceras i testiklarna under monoterapi med bicalutamid, kan AR- antagonister eventuellt störa manlig fertilitet via interferens med androgensignalering bortom testiklarna. Mognad och transport av spermier sker inte bara i testiklarna utan även utanför testiklarna i epididymiderna och sädesledaren , och dessa processer i dessa vävnader är beroende av AR- signalering på samma sätt som testikelspermatogenes. Men medan androgennivåerna är extremt höga i testiklarna, är detta inte sant i epididymiderna och sädesledaren. Eftersom androgennivåerna är relativt låga i dessa vävnader, åtminstone jämfört med testiklarna, kan bicalutamid blockera AR- signalering i dessa delar av kroppen i en utsträckning som är tillräcklig för att störa manlig fertilitet. I själva verket AAS mesterolone använts för att förbättra spermiekvalitet och fertilitet hos män eftersom det, uppenbarligen till skillnad från andra AAS , uppvisar minimala antigonadotropa effekter vid typiska kliniska doser men aktiverar AR och stödjer därmed spermiemognad i bitestiklarna. Denna användning av mesterolone är dock kontroversiell och dess effektivitet för sådana ändamål är inte helt säker.
Även om enbart bicalutamid tycks ha minimal skadlig effekt på testikelspermatogenesen och därmed på vissa aspekter av manlig fertilitet, kan andra hormonella medel som bicalutamid kan kombineras med, inklusive GnRH- analoger och särskilt östrogener (som vid transgenderhormonbehandling), ha en betydande skadlig effekt på fertiliteten. Detta är till stor del en konsekvens av deras antigonadotropa aktivitet. Antigonadotropa medel som högdos CPA , högdos androgener (t.ex. testosteronestrar ) och GnRH- antagonister (men framför allt inte GnRH- agonister i fallet med fertilitet) producerar hypogonadism och höga frekvenser av allvarlig eller fullständig infertilitet (t.ex. svår oligospermi ) fullständig azoospermi ) hos män. Dessa effekter är dock fullt och ofta snabbt reversibla när de avbryts, även efter långvarig behandling. Däremot, medan östrogener i tillräckligt höga doser på liknande sätt kan producera hypogonadism och att avskaffa eller allvarligt försämra spermatogenesen, är detta inte nödvändigtvis reversibelt när det gäller östrogener och kan vara långvarigt efter långvarig exponering. Skillnaden tillskrivs en till synes unik, direkt cytotoxisk och negativ effekt av höga koncentrationer av östrogener på Leydig-cellerna i testiklarna.
Andra aktiviteter
Cytokrom P450-modulering
Det har rapporterats att bicalutamid kan ha potential att hämma enzymerna CYP3A4 och, i mindre utsträckning, CYP2C9 , CYP2C19 och CYP2D6 , baserat på in vitro- forskning. Ingen relevant hämning av CYP3A4 har dock observerats in vivo med bicalutamid i en dos på 150 mg (med midazolam som en specifik markör för CYP3A4-aktivitet). Hos djur har bikalutamid visat sig vara en inducerare av vissa cytokrom P450- enzymer. Doser på 150 mg/dag eller mindre har dock inte visat några tecken på detta hos människor.
Bicalutamid har identifierats som en stark CYP27A1- hämmare (kolesterol 27-hydroxylas) in vitro . CYP27A1 omvandlar kolesterol till 27-hydroxikolesterol , en oxysterol som har flera biologiska funktioner inklusive direkt, vävnadsspecifik aktivering av ER (den har karakteriserats som en selektiv östrogenreceptormodulator) och lever X-receptorn . 27-Hydroxykolesterol har visat sig öka ER -positiv bröstcancercelltillväxt via dess östrogena verkan, och därför har det föreslagits att bicalutamid och andra CYP27A1-hämmare kan vara effektiva som adjuvansbehandlingar till aromatashämmare vid behandling av ER -positiva bröst cancer. Förutom CYP27A1 har bikalutamid visat sig binda till och hämma CYP46A1 (kolesterol 24-hydroxylas) in vitro , men detta har ännu inte utvärderats och bekräftats in vivo .
P-glykoproteinhämning
Bicalutamid, såväl som enzalutamid, har visat sig fungera som inhibitorer av P-glykoproteinutflöde och ATPas- aktivitet. Denna åtgärd kan vända docetaxelresistens i prostatacancerceller genom att minska transporten av läkemedlet ut ur dessa celler.
GABA A- receptor positiv modulering
Alla NSAA som godkänts för behandling av prostatacancer har visat sig ha en off-target-verkan av att fungera som svaga icke-konkurrerande hämmare av mänskliga GABAA - receptorströmmar in vitro i varierande utsträckning. IC 50 -värdena är 44 μM för flutamid (som hydroxiflutamid) , 21 μM för nilutamid, 5,2 μM för bicalutamid och 3,6 μM för enzalutamid. Dessutom har flutamid, nilutamid och enzalutamid visat sig orsaka kramper och/eller död hos möss vid tillräckligt höga doser. Bicalutamid visade sig inte göra detta, men detta berodde troligen helt enkelt på den begränsade centrala nervsystemet hos denna art. Enzalutamid är i alla fall den enda godkända NSAA som har visat sig vara associerad med en signifikant ökad förekomst av anfall och andra associerade biverkningar kliniskt, så relevansen av de ovan nämnda fynden med avseende på bicalutamid och de andra NSAA är oklar .
Diverse
som α2 -makroglobulin en potent antagonist av den proteasaktiverade receptorn 2 (PAR-2) och som en ligand och hämmare av .
Farmakokinetik
| 50 mg/dag | 150 mg/dag | |
|---|---|---|
| C max |
0,77 μg/ml (1,8 μmol/L) |
1,4 μg/ml (3,3 μmol/L) |
| t max | 31 timmar | 39 timmar |
| C ss |
8,85 μg/ml (20,6 μmol/L) |
21,6–28,5 μg/mL (50,2–66,3 μmol/L) |
| t ss | 4–12 veckor | 4–12 veckor |
| Anmärkningar: Alla värden är för ( R )-bicalutamid. Källor: | ||
Farmakokinetiken för bicalutamid påverkas inte av föda , ålder , kroppsvikt , nedsatt njurfunktion och lätt till måttligt nedsatt leverfunktion . Det har emellertid observerats att steady-state-koncentrationer av bicalutamid är högre hos japanska individer än hos kaukasier , vilket indikerar att etnicitet kan vara associerat med skillnader i farmakokinetiken för bicalutamid i vissa fall.
Absorption
Bicalutamid absorberas i hög grad och väl efter oral administrering , och dess absorption påverkas inte av mat. Den absoluta biotillgängligheten av bicalutamid hos människor är okänd på grund av dess mycket låga vattenlöslighet och därför avsaknaden av en bedömbar intravenös formulering. Den absoluta biotillgängligheten av bicalutamid har dock visat sig vara hög hos djur vid låga doser (109 % hos möss vid 10 mg/kg; 72 % hos råttor vid 1 mg/kg; 100 % hos hundar vid 0,1 mg/kg). men minskar med ökande doser så att biotillgängligheten av bicalutamid är låg vid höga doser (10 % hos råttor vid 250 mg/kg; 31 % hos hundar vid 100 mg/kg). I enlighet med detta absorptionen av ( R )-bicalutamid hos människor långsam och omfattande men mättbar, med steady-state-nivåer som ökar linjärt vid en dos på upp till 150 mg/dag och icke-linjärt vid högre doser.
Vid högre doser på 100 till 200 mg/dag är absorptionen av bicalutamid ungefär linjär, med en liten men ökande avvikelse från linjäritet över 150 mg/dag. När det gäller geometriska genomsnittliga steady-state-koncentrationer av ( R )-bicalutamid, var avvikelserna från linjäritet 4 %, 13 %, 17 % och 32 % med doser på 100, 150, 200 respektive 300 mg/dag. Det finns en platå i steady-state-nivåer av ( R )-bicalutamid med bikalutamiddoser över 300 mg/dag, och följaktligen resulterar doser av bicalutamid på 300 till 600 mg/dag i liknande cirkulerande koncentrationer av (R) -bicalutamid och liknande grader av klinisk effekt, tolerabilitet och toxicitet. I förhållande till 150 mg/dag bicalutamid är nivåerna av ( R )-bicalutamid cirka 15 % högre vid en dos av 200 mg/dag och cirka 50 % högre vid en dos av 300 mg/dag. I motsats till ( R )-bicalutamid absorberas den inaktiva enantiomeren ( S )-bicalutamid mycket snabbare (liksom rensas från cirkulationen).
Steady-state-koncentrationer av läkemedlet uppnås efter 4 till 12 veckors administrering oberoende av dosering, med en ungefärlig 10- till 20-faldig progressiv ackumulering av cirkulerande nivåer av (R) -bicalutamid . Den relativt långa tiden för att nå steady-state är en produkt av den långa elimineringshalveringstiden för bicalutamid. Med engångsdoser på 50 mg och 150 mg av bicalutamid är genomsnittliga toppkoncentrationer (C max ) av ( R )-bicalutamid 0,77 μg/mL (1,8 μmol/L) (vid 31 timmar) och 1,4 μg/mL (3,3 μmol/L) ) (vid 39 timmar). Vid steady-state är de genomsnittliga cirkulerande koncentrationerna (C ss ) av ( R )-bicalutamid med 50 mg/dag och 150 mg/dag bicalutamid 8,85 μg/ml (20,6 μmol/L) och 21,6 μg/ml (50,2 μg/ml (50,2 μmol/L 2) ), respektive. I en annan 150 mg/dag bicalutamid-studie var medelkoncentrationen av ( R )-bicalutamid i cirkulation 19,4 μg/ml (45,1 μmol/L) och 28,5 μg/mL (66,3 μmol/L) dag 28 och 84 och 1 veckor (2 veckor). ) av behandling, respektive.
Distribution
Den skenbara orala distributionsvolymen (VSS / F) vid steady state av ( R ) -bicalutamid med oral administrering av en engångsdos på 5 till 80 mg ( R )-bicalutamid i en ny fast dispersion med en polymermatris av hydroxipropylmetylcellulosa ftalat (HP55S) (även känd som ( R )-bicalutamid/HP55S) varierar från 22,53 ± 3,71 L till 25,38 ± 2,69 L. Bicalutamid är starkt proteinbundet (96,1% för racemisk bicalutamid, 99,6% för racemisk bicalutamid, 99,6% för Ramid )-b. främst till albumin. Det har försumbar affinitet för SHBG och ingen affinitet för kortikosteroidbindande globulin .
Vävnadsfördelningen av bicalutamid är inte välkarakteriserad . Det har emellertid rapporterats att distributionsstudier med bicalutamid har visat att preferentiell (dvs vävnadsselektiv ) ackumulering i anabola (t.ex. muskel ) vävnader inte förekommer. Det finns inga tillgängliga data om leverbicalutamidkoncentrationer hos människor, men en råttstudie fann att oral bicalutamidbehandling resulterade i 4 gånger högre koncentrationer av läkemedlet i levern jämfört med plasma (ett vanligt fynd med oralt administrerade läkemedel, på grund av överföring via leverportalsystemet innan det når cirkulationen ) . Hos män som fick 150 mg/dag bicalutamid var koncentrationerna av ( R )-bicalutamid i sperma 4,9 μg/ml (11 μmol/L), och mängden av läkemedlet som potentiellt skulle kunna levereras till en kvinnlig partner under samlag anses vara så låg (uppskattad till 0,3 μg/kg) och under den mängd som krävs för att framkalla förändringar hos avkomma till försöksdjur.
Baserat på djurforskning trodde man från början att bicalutamid inte kunde passera blod-hjärnbarriären in i det centrala nervsystemet och därför skulle vara ett perifert selektivt antiandrogen hos människor. Denna slutsats drogs från upptäckten att bicalutamid inte ökar LH- eller testosteronnivåerna hos flera testade djurarter (inklusive råttor och hundar). AR- antagonister som flutamid gör normalt detta genom att blockera AR i hypofysen och hypotalamus i hjärnan och därigenom desinhibera HPG -axeln. Hos människor har dock bicalutamid visat sig öka LH- och testosteronnivåerna, och i jämförbar utsträckning jämfört med flutamid och nilutamid. Detta sker i betydande utsträckning även vid en mycket låg dos på 10 mg/dag bicalutamid. Som sådan verkar det finnas artskillnader i den centrala penetrationen av bicalutamid och att medicinen verkligen passerar blod-hjärnbarriären och påverkar central funktion hos människor. Detta stöds av potentiella biverkningar av bicalutamid, trots ökade testosteronnivåer, som värmevallningar och minskat sexuellt intresse hos män. En klinisk studie som jämförde bicalutamid och flutamid hos män fann dock att bicalutamid hade mindre inflytande på HPG -axeln än flutamid, vilket tyder på att bicalutamid kan ha en begränsad grad av perifer selektivitet, åtminstone jämfört med andra NSAA , hos människor.
Bicalutamid har identifierats som ett substrat för P-glykoprotein och för bröstcancerresistensproteinet (BCRP), men inte av det multidrogresistensassocierade proteinet 1 (MRP1). Detta kan vara involverat i tumörresistens mot bicalutamid. P-glykoprotein är också känt för att spela en viktig roll för att utesluta läkemedel från hjärnan på grund av utflöde tillbaka över blod-hjärnbarriären .
Ämnesomsättning
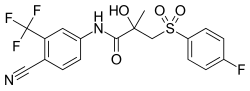
Metabolismen av bicalutamid är hepatisk och stereoselektiv . Den inaktiva ( S )-enantiomeren metaboliseras huvudsakligen genom glukuronidering och rensas snabbt från cirkulationen, medan den aktiva ( R )-isomeren långsamt hydroxyleras och glukuronideras sedan. I enlighet med detta har den aktiva ( R )-enantiomeren en mycket längre elimineringshalveringstid än ( S )-isomeren, och cirkulerande nivåer av ( R )-bicalutamid är 10- till 20-faldigt och 100-faldigt högre än ( S )-bicalutamid efter en engångsdos respektive vid steady-state. ( R )-Bicalutamid metaboliseras nästan uteslutande via hydroxylering till ( R )-hydroxybicalutamid av cytokrom P450- enzymet CYP3A4 . Bicalutamid glukuronideras också av UGT1A9 , ett UDP-glukuronyltransferas , till bicalutamidglukuronid, och ( R )-hydroxibicalutamid glukuronid bildas från metabolismen av ( R )-hydroxibicalutamid av UGT1A9. I likhet med den inaktiva ( S )-enantiomeren av bicalutamid, glukuronideras ( R )-hydroxibicalutamid och rensas snabbt från cirkulationen. Ingen av metaboliterna av bicalutamid är känd för att vara aktiv. Efter administrering av bicalutamid kan endast låga koncentrationer av metaboliterna detekteras i blodplasma , medan oförändrad bicalutamid dominerar. ( R )-Bicalutamid har en lång eliminationshalveringstid på 5,8 dagar med en engångsdos och en eliminationshalveringstid på 7 till 10 dagar vid upprepad administrering, vilket möjliggör bekväm dosering en gång dagligen av bicalutamid.
|
Bicalutamidmetabolism hos människor
|
Eliminering
Bicalutamid elimineras i feces (43%) och urin (34%), medan dess metaboliter elimineras i ungefär lika stora proportioner i urin och galla . Det utsöndras i stor utsträckning i sin ometaboliserade form, med både bicalutamid och dess metaboliter huvudsakligen som glukuronidkonjugat .

![Testosterone levels with 10, 30, and 50 mg/day bicalutamide monotherapy in men with prostate cancer.[108]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b7/Testosterone_levels_with_10%2C_30%2C_and_50_mg_per_day_bicalutamide_monotherapy_in_men.png/394px-Testosterone_levels_with_10%2C_30%2C_and_50_mg_per_day_bicalutamide_monotherapy_in_men.png)
![Testosterone levels with 10 to 200 mg/day bicalutamide monotherapy in men with prostate cancer.[109]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fa/Testosterone_levels_with_10_to_200_mg_per_day_bicalutamide_monotherapy_in_men.png/394px-Testosterone_levels_with_10_to_200_mg_per_day_bicalutamide_monotherapy_in_men.png)
![Estradiol levels with 10, 30, and 50 mg/day bicalutamide monotherapy in men with prostate cancer.[108]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/f6/Estradiol_levels_with_10%2C_30%2C_and_50_mg_per_day_bicalutamide_monotherapy_in_men.png/391px-Estradiol_levels_with_10%2C_30%2C_and_50_mg_per_day_bicalutamide_monotherapy_in_men.png)
![Estradiol levels with 10 to 200 mg/day bicalutamide monotherapy in men with prostate cancer.[81]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Estradiol_levels_with_10_to_200_mg_per_day_bicalutamide_monotherapy_in_men.png/396px-Estradiol_levels_with_10_to_200_mg_per_day_bicalutamide_monotherapy_in_men.png)
![(R)-Bicalutamide levels after a single 5 to 80 mg dose of (R)-bicalutamide/HP55S in men.[188] The mean elimination half-life of (R)-bicalutamide in this study was 5.6 to 7.5 days.[188]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/43/%28R%29-Bicalutamide_levels_with_a_single_5_to_80_mg_oral_dose_of_bicalutamide_in_men.png/250px-%28R%29-Bicalutamide_levels_with_a_single_5_to_80_mg_oral_dose_of_bicalutamide_in_men.png)
![Bicalutamide levels after a single 50 mg dose of bicalutamide in men.[205] The mean elimination half-life of bicalutamide in this study was 4.2 days.[205]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/83/Bicalutamide_levels_after_a_single_50_mg_oral_dose_of_bicalutamide_in_men.png/250px-Bicalutamide_levels_after_a_single_50_mg_oral_dose_of_bicalutamide_in_men.png)
![Bicalutamide levels after a single 10, 30, or 50 mg dose of bicalutamide in men.[206] The mean elimination half-life of bicalutamide in this study was 5.5 to 6.3 days.[206]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cd/Bicalutamide_levels_after_a_single_10%2C_30%2C_or_50_mg_oral_dose_of_bicalutamide_in_men.png/250px-Bicalutamide_levels_after_a_single_10%2C_30%2C_or_50_mg_oral_dose_of_bicalutamide_in_men.png)
![Mean plasma (R)-bicalutamide concentrations with 10 to 600 mg/day bicalutamide in men over the course of 12 weeks.[81][207][208]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5c/Mean_plasma_bicalutamide_levels_with_10_to_600_mg_per_day_bicalutamide_in_men.png/250px-Mean_plasma_bicalutamide_levels_with_10_to_600_mg_per_day_bicalutamide_in_men.png)
![Steady-state plasma levels of (R)-bicalutamide as a function of bicalutamide dosage (10 to 600 mg/day) in men.[81][207][208] Note the divergence from linearity at dosages above 200 mg/day, which demonstrates the saturation of absorption with higher dosages of bicalutamide.[208]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/06/Bicalutamide_levels_as_a_function_of_dosage_in_men.png/250px-Bicalutamide_levels_as_a_function_of_dosage_in_men.png)