alfa-2-makroglobulin
| A2M | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , A2MD, CPAMD5, FWP007, S863-7, transcuprein, alfa-2-makroglobulin | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
α2 - makroglobulin ( α 2M finns ), eller alfa-2-makroglobulin , är ett stort (720 KDa) plasmaprotein som i blodet . Det produceras huvudsakligen av levern och syntetiseras även lokalt av makrofager , fibroblaster och binjurebarkceller . Hos människor kodas den av A2M -genen.
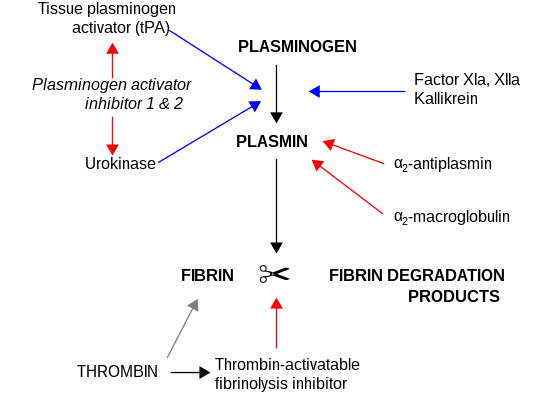
α 2 - Makroglobulin fungerar som ett antiproteas och kan inaktivera en enorm mängd proteinaser. Det fungerar som en hämmare av fibrinolys genom att hämma plasmin och kallikrein . Det fungerar som en hämmare av koagulation genom att hämma trombin . a2 - makroglobulin kan fungera som ett bärarprotein eftersom det också binder till många tillväxtfaktorer och cytokiner, såsom trombocythärledd tillväxtfaktor, grundläggande fibroblasttillväxtfaktor, TGF-p, insulin och IL-1β.
Ingen specifik brist med associerad sjukdom har erkänts, och inget sjukdomstillstånd tillskrivs låga koncentrationer av a2- makroglobulin . Koncentrationen av a2 - makroglobulin stiger 10 gånger eller mer vid nefrotiskt syndrom när andra proteiner med lägre molekylvikt går förlorade i urinen. Förlusten av α2 - makroglobulin till urinen förhindras av dess stora storlek. Nettoresultatet är att α2 - makroglobulin når serumnivåer lika med eller högre än albuminnivåerna vid nefrotiskt syndrom, vilket har effekten att upprätthålla onkotiskt tryck .
Strukturera
Humant a2 - makroglobulin är sammansatt av fyra identiska subenheter bundna tillsammans av -SS-bindningar . Förutom tetramera former av a2 - makroglobulin har dimera och på senare tid monomera aM-proteashämmare identifierats.
Varje monomer av humant a2 - makroglobulin är sammansatt av flera funktionella domäner, inklusive makroglobulindomäner, en tiolester-innehållande domän och en receptorbindande domän. Totalt sett är a2 - makroglobulin det största huvudsakliga icke-immunoglobulinproteinet i human plasma.
Aminosyrasekvensen för α2 - makroglobulin har visat sig vara 71 % densamma som för graviditetszonproteinet ( PZP ; även känt som graviditetsassocierat α2- glykoprotein ) .
Fungera
Familjen a-makroglobulin (aM) av proteiner inkluderar proteashämmare , kännetecknad av det humana tetramera a2 - makroglobulinet (a2M ) ; de tillhör MEROPS- proteinashämmarfamiljen I39, klan IL. Dessa proteashämmare delar flera definierande egenskaper, som inkluderar (1) förmågan att hämma proteaser från alla katalytiska klasser, (2) närvaron av en "beteregion" (även känd som en sekvens av aminosyror i en α2 - makroglobulinmolekyl eller ett homologt protein, som innehåller sprickbara peptidbindningar för de proteinaser som det hämmar) och en tiolester , (3) en liknande proteashämmande mekanism och (4) inaktivering av den hämmande kapaciteten genom reaktion av tiolestern med små primära aminer . aM- proteashämmare inhiberar genom steriskt hinder. Mekanismen involverar proteasklyvning av betesregionen, ett segment av αM som är särskilt känsligt för proteolytisk klyvning , vilket initierar en konformationsförändring så att αM kollapsar kring proteaset. I det resulterande αM-proteaskomplexet är det aktiva stället för proteaset steriskt avskärmat, vilket således väsentligt minskar tillgången till proteinsubstrat . Ytterligare två händelser inträffar som en konsekvens av klyvning av betesregionen, nämligen (1) h-cysteinyl-g-glutamyltiolestern blir mycket reaktiv och (2) en större konformationsförändring exponerar en konserverad COOH- terminal receptorbindande domän ( RBD ) . RBD-exponering tillåter αM-proteaskomplexet att binda till clearance- receptorer och avlägsnas från cirkulationen. Tetramera, dimera och, på senare tid, monomera aM-proteashämmare har identifierats.
α2 - makroglobulin kan inaktivera en enorm mängd proteinaser (inklusive serin- , cystein- , asparagin- och metalloproteinaser ). Det fungerar som en hämmare av fibrinolys genom att hämma plasmin och kallikrein. Det fungerar som en hämmare av koagulation genom att hämma trombin . α2 - makroglobulin har i sin struktur en 35 aminosyror "bete"-region. Proteinaser som binder och klyver betesregionen blir bundna till α 2 M. Proteinas-α 2 M-komplexet känns igen av makrofagreceptorer och rensas bort från systemet.
α2 - makroglobulin är känt för att binda zink , såväl som koppar i plasma, ännu starkare än albumin, och det är också känt som transcuprein . 10 till 15 % av koppar i human plasma kelateras av α2- makroglobulin .
Sjukdom
α2 - makroglobulinnivåerna ökar när serumalbuminnivåerna är låga, vilket är vanligast vid nefrotiskt syndrom , ett tillstånd där njurarna börjar läcka ut några av de mindre blodproteinerna. På grund av dess storlek hålls α2 - makroglobulin kvar i blodomloppet. Ökad produktion av alla proteiner innebär att α2 - makroglobulinkoncentrationen ökar. Denna ökning har liten negativ effekt på hälsan, men används som en diagnostisk ledtråd.
En vanlig variant (29,5%) ( polymorfism ) av α2 - makroglobulin leder till ökad risk för Alzheimers sjukdom .
α 2 -Makroglobulin binder till och tar bort de aktiva formerna av gelatinaset ( MMP-2 och MMP-9 ) från cirkulationen via scavenger-receptorer på fagocyterna.
- McPherson & Pincus: Henry's Clinical Diagnosis and Management by Laboratory Methods, 21:a upplagan.
- Firestein: Kelley's Textbook of Rheumatology, 8:e upplagan.
externa länkar
- MEROPS onlinedatabas för peptidaser och deras inhibitorer : I39.001
- alfa+2-makroglobulin vid US National Library of Medicine Medical Subject Headings (MeSH)
- A2M human genplacering i UCSC Genome Browser .
- A2M mänskliga gendetaljer i UCSC Genome Browser .