Lestaurtinib
 | |
 | |
| Kliniska data | |
|---|---|
Administreringsvägar _ |
Via mun |
| ATC-kod |
|
| Farmakokinetiska data | |
| Proteinbindning | starkt proteinbundet, speciellt till surt a-1-glykoprotein |
| Ämnesomsättning | lever P450 (CYP34A) enzymsystem |
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard ( EPA ) | |
| Kemiska och fysikaliska data | |
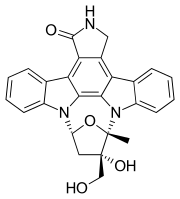
| Formel | C26H21N3O4 _ _ _ _ _ _ _ |
| Molar massa | 439,471 g·mol -1 |
| 3D-modell ( JSmol ) | |
| |
| |
|
| |
Lestaurtinib ( rINN , kodnamnet CEP-701 ) är en tyrosinkinashämmare strukturellt besläktad med staurosporin . Detta halvsyntetiska derivat av indolokarbazolen K252a undersöktes av Cephalon som en behandling för olika typer av cancer. Det är en hämmare av kinaserna fms-liknande tyrosinkinas 3 ( FLT3 ), Janus kinas 2 ( JAK2 ), tropomyosinreceptorkinas ( trk ) A ( TrkA ), TrkB och TrkC .
Används
Lestaurtinib har genomgått kliniska prövningar för behandling av olika cancerformer, inklusive pankreascancer och prostatacancer, V617F JAK2 positiv polycytemia vera och essentiell trombocytos , och refraktär neuroblastom . Den största ansträngningen investerades i att utveckla lestaurtinib för behandling av akut myelogen leukemi (AML). 24 % av den vuxna AML-drabbade populationen uppvisar FLT3-mutationer, som är associerade med en ökad sannolikhet för återfall och dödlighet efter behandling utöver den allmänna AML-populationen. FLT3-mutationer undertrycker apoptos i muterade celler, men lestaurtinib har potential att övervinna denna undertryckning genom att hämma FLT3-kinasaktivitet.
Prekliniska studier
Lestaurtinib identifierades tidigt som en trk- receptortyrosinkinashämmare (RTK), med en koncentration som hämmade 50 % av tyrosinkinasaktiviteten (IC50) på 25 nM. In vivo -studier visade en 50–70 % minskning av tumörbördan för xenotransplanterad pankreascancer och prostatacancer; efterföljande kliniska prövningar för pankreascancer och prostatacancer uppnådde dock inte de angivna målen. 2001 visades lestaurtinib ha en IC50 på 2–3 nM med avseende på FLT3-tyrosinkinas, utan någon signifikant effekt på strukturellt liknande tyrosinkinaser vid dessa koncentrationer. Eftersom leukemier vanligtvis utvecklar flera överlevnadsvägar, studerades lestaurtinib i samband med traditionell kemoterapi; det fastställdes att, medan lestaurtinibbehandling före kemoterapi gav antagonistiska resultat, gav lestaurtinibbehandling samtidigt med eller efter kemoterapi synergistiska resultat. Senast undersöktes lestaurtinibs styrka som en JAK2-hämmare.
Kliniska tester
Lestaurtinib registrerades som Investigational New Drug (IND) nummer 76431.
Inledande fas I-studier med lestaurtinib involverade bestämning av farmakokinetiska parametrar efter en engångsdos hos friska frivilliga. Därefter undersöktes säkerhet och tolerabilitet i en fas I-studie som involverade 30 frivilliga med avancerade solida tumörer eller lymfom . Även om det inte fanns några anmärkningsvärda tumörsvar, noterades en stark korrelation mellan dos och biverkningar, med den primära biverkningen som rapporterades var gastrointestinala reaktioner. En fas II-studie med 18 patienter med pankreascancer inleddes för kombinationsbehandling med lestaurtinib och gemcitabin , men effekten av lestaurtinib observerades inte.
Under 2004 involverade en fas I/II-studie 17 patienter på 2 platser med återfall, refraktär lågrisk-AML med FLT3-mutationer; denna studie visade effektiv FLT3-hämning av lestaurtinib. En multicenter fas II-studie med 29 patienter över 60 år inleddes för behandling med enbart lestaurtinib; resultaten, som rapporterades 2006, visade att det primära effektmåttet för fullständig remission inte uppnåddes hos några deltagare. Trots detta misslyckande, kombinerade en annan multicenter fas II-studie med 42 patienter lestaurtinib med konventionell kemoterapi; resultaten, rapporterade 2005, visade att dubbelt så många patienter visade ett kliniskt svar när de behandlades med lestaurtinib jämfört med de som inte behandlades. Följaktligen inleddes en fas III-studie med 224 patienter för lestaurtinib efter kemoterapi; ingen signifikant skillnad i cancerremission sågs mellan patienter som behandlades med enbart kemoterapi och med lestaurtinib och kemoterapi, enligt resultat i en rapport från 2011.
Ytterligare kliniska prövningar har inletts sedan denna fas III-studie. Dessa inkluderar en multicenter fas II-studie med 37 patienter med V617F JAK2 positiv polycytemi vera och essentiell trombocytos; resultat publicerade under 2014 tyder på att studien inte uppnådde slutpunkten med 15 % minskning av V617F JAK2-allelbördan hos 15 % av patienterna. En fas I-studie av 47 patienter rapporterade 2010 att behandling av refraktär neuroblastom tolererades väl vid rekommenderade doser, och en ytterligare fas I-studie på barn med refraktär neuroblastom avslutades 2011. Fas I-resultat rapporterades 2015 för en lestaurtinib-studie involverar patienter med V617F JAK2-positiv myelofibros .
Kommersialisering och immateriella rättigheter
Lestaurtinib studerades av Cephalon, ett internationellt läkemedelsföretag baserat i Frazer, PA. Cephalon grundades 1987 och hade växt till ett Fortune 1000-företag 2011, med 4 000 anställda och 170 produkter sålda i 100 länder.
Lestaurtinib nämndes som ett av två onkologiska läkemedel som utvecklas av Cephalon i en rapport från US Securities and Exchange Commission (SEC) från 2007. Enligt denna rapport innehade Cephalon, förutom att inneha patentansökningar som involverade behandlingsmetoder, formuleringar och polymorfer av lestaurtinib, ett patent för lestaurtinib i USA som skulle upphöra att gälla 2008. 2006 beviljade amerikanska FDA lestaurtinib. särläkemedelsstatus för behandling av AML, vilket återspeglar det betydande behovet men minimala marknaden för behandling av AML. I kölvattnet av preliminära misslyckade resultat för den kliniska fas III-studien som involverade Lestaurtinib, utfärdade Cephalons grundare och VD Frank Baldino, Ph.D., följande uttalande 2009:
Vi gjorde en betydande ekonomisk investering i denna banbrytande ansträngning för att utveckla lestaurtinib för denna molekylärt riktade patientpopulation med dålig prognos och få behandlingsalternativ. Patienter med livshotande sjukdomar behöver företag som Cephalon för att göra den investeringen och ta den risken om vi ska förbättra patienternas resultat och de totala kostnaderna för sjukvården.
2011 förvärvades Cephalon av Teva Pharmaceutical Industries (NASDAQ: TEVA) för 6,8 miljarder dollar i kontanter, vilket gör Cephalon till ett helägt dotterbolag till Teva. Detta förvärv var i linje med Tevas vision att utöka deras utbud av märkesvaror och specialläkemedel, mer än fördubbla försäljningen av märkesvaror till ett värde av 7 miljarder USD. I sin årliga SEC-rapport för 2011 inkluderade Teva inte lestaurtinib i en lista över viktiga onkologiska läkemedel i sin pipeline.
Ett betydande antal patent är relaterade till lestaurtinib. En patentsökning på Google ger 1 278 patent som involverar lestaurtinib, varav 6 inkluderar lestaurtinib i titeln och 8 av dem är tilldelade Cephalon. 2 017 patent involverar CEP-701, varav inget inkluderar CEP-701 i titeln och 8 av dem är tilldelade Cephalon. 13 666 patent är relaterade till FLT3-hämmare, varav 7 inkluderar FLT3-hämning i titeln och 3 av dessa är tilldelade Cephalon. FLT3-hämmare som för närvarande genomgår kliniska prövningar för AML inkluderar sorafenib , midostaurin och quizartinib .