IRAK1
| IRAK1 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| -identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , IRAK, pelle, interleukin 1-receptorassocierad kinas 1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Interleukin-1-receptorassocierat kinas 1 ( IRAK-1) är ett enzym hos människor som kodas av IRAK1 - genen . IRAK-1 spelar en viktig roll i regleringen av uttrycket av inflammatoriska gener av immunceller, såsom monocyter och makrofager , som i sin tur hjälper immunsystemet att eliminera bakterier, virus och andra patogener . IRAK-1 är en del av IRAK-familjen som består av IRAK-1, IRAK-2, IRAK-3 och IRAK-4, och aktiveras av inflammatoriska molekyler som frisätts av signalvägar under patogen attack . IRAK-1 klassificeras som ett kinasenzym , som reglerar vägar i både medfödda och adaptiva immunsystem.
Strukturera
IRAK-1 innehåller en N-terminal dödsdomän ( DD ), en ProST-domän, en centralt belägen kinasdomän och en C-terminal domän . DD på IRAK-1 fungerar som en interaktionsplattform för annat DD-innehållande protein, framför allt adapterproteinet myeloid differentieringsfaktor 88, MyD88 .
ProST-domänen innehåller serin-, prolin- och treoninaminosyrarester och används för att underlätta IRAK-1-interaktion med andra IRAK-familjemedlemmar eller proteiner. Till exempel autofosforylering ske flera gånger i ProST-domänen, vilket gör att IRAK-1 kan dissociera från MyD88 bunden till DD samtidigt som interaktioner med nedströmsproteiner som TNF -receptorassocierad faktor 6 ( TRAF-6) bibehålls för att initiera ytterligare vägsignalering.
Dessutom innehåller IRAK-1 ett invariant lysin inom den centralt belägna kinasdomänen. Det invarianta lysinet fungerar som ett bindningsställe för ATP och en mediator för katalytisk funktion och kinasaktivitet.
IRAK-1 innehåller också en tyrosinrest (Tyr 262 ) som konformationellt ändrar det aktiva stället för IRAK-1 genom att hämma den hydrofila fickan bakom bindningsstället och därigenom tillåter IRAK-1 att förbli i ett aktivt tillstånd. Till exempel kan ATP-bindning till IRAK-1-bindningsstället lätt ske i närvaro av Tyr 266 , eftersom Tyr 266 kommer att uppta den hydrofila fickan där ATP- kompetitiva hämmare kan binda och störa katalytisk funktion.
Aktivering
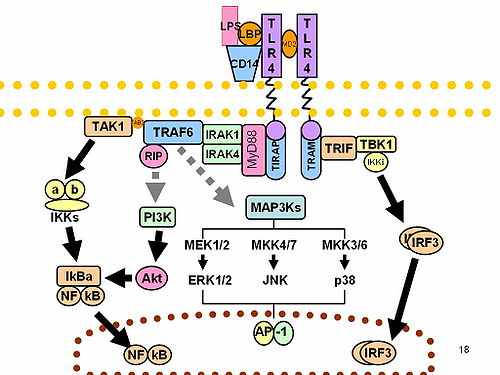
I närvaro av främmande patogener kan IRAK-1-inducerade signalvägar aktiveras av Toll-liknande receptorer ( TLR ) eller av interleukin-1 familjereceptorer ( IL-1R ) som svar. TLRs känner igen patogenassocierade molekylära mönster ( PAMPs ) uttryckta på bakterier och IL-1Rs känner igen och binder proinflammatoriska cytokiner från IL-1-familjen. Både TLR och IL-1R förmedlar en signaleringskaskad som involverar MyD88-bindning till receptorn, oligomerisering av MyD88, rekrytering av IRAK-1 via DD, multimerisering av IRAK-1, och slutligen kinasaktivering och vidare nedströmssignalering.
IRAK-1 kan också aktiveras vid interaktion med andra IRAK-familjemedlemmar. IRAK-1 och IRAK-4 kan aktivera varandra genom att använda DD som en plattform för MyD88. IRAK-4 fosforylerar först IRAK-1 som katalyserar en IRAK-1- autofosforyleringskaskad , som sker i tre steg. IRAK-1 fosforyleras först vid Thr209, vilket orsakar en konformationsförändring . Sedan fosforyleras IRAK-1 vid Thr387 vilket gör IRAK-1 fullt aktivt. Slutligen stimulerar autofosforylering vid flera rester i proST-regionen IRAK-1-frisättning från receptorkomplexet.
Fungera
IRAK-1 kodar för det interleukin-1-receptorassocierade kinas 1, som är ett serin-treoninproteinkinas som är associerat med interleukin-1-receptorn (IL1R) vid stimulering. IRAK-1 krävs för pro-inflammatorisk cytokinproduktion nedströms TLR och IL-1R signalvägar. Dessutom är IRAK-1 ansvarig för IL1-inducerad uppreglering av transkriptionsfaktorn NF-kappa B. Vid bindning till dess receptor aktiveras IRAK-1, såsom beskrivs i Aktivering, och dissocierar sedan från dess receptorkomplex . IRAK-1 dissocierar från receptorn vid sidan av TRAF6 - ett ubiquitin E3-ligas som intermedierar mellan olika typer av receptorer för exogena eller endogena mediatorer och aktivering av transkriptionssvar via NF-kappa B- och MAPK -vägar. IRAK-1 och TRAF-6 binder sedan till TAK-1-bindande protein-1 (TAB-1), följt av bindning till transformerande tillväxtfaktor-β-aktiverat kinas (TAK-1) och TAB-2, vilket bildar ett nytt komplex. Detta komplex translokeras sedan till cytoplasman där det associeras med ubiquitinligaser såsom ubiquitin-konjugerande enzym- 13 UBC-13 och ubiquitin-konjugerande enzym E2 variant-1 (UEV-1a), vilket leder till ubiquitination och nedbrytning av TRAF-6. TAK-1 aktiveras sedan och fosforylering av hämmaren av KB-kinas (IKK)-komplexet, bestående av IKKα, IKKβ och IKKγ, inträffar. MAPK aktiveras också i processen. Slutligen aktiveras NF-KB för att reglera transkriptionen av pro-inflammatoriska gener. Alternativt kan IRAK-1-aktivering av NF-KB-vägen regleras genom ubiquitinering av Lys 134 och Lys 180 .
Alternativt splitsade transkriptvarianter som kodar för olika isoformer har hittats för IRAK1-genen. För närvarande finns det tre differentiellt splitsade varianter av IRAK1 - IRAK1, IRAK1b och IRAK1c. IRAK1 observerades genomgå sumoylering , vilket främjade dess translokation till kärnan istället för cytoplasman vid patogen attack. IRAK1c, särskilt, förblir stabil vid sumoylering, genomgår inte modifiering under samma omständigheter och lokaliseras endast till cytoplasman.
IRAK-1 kinasaktivitet är inte det enda proteinet som är involverat i pro-inflammatoriska immunsvar, men det fungerar som ett adapterprotein som effektivt binder MyD88, IRAK-4, de toll-interagerande proteinerna (TOLLIP) tillsammans för att bilda ett komplex som inducerar IL-1R-medierad NF-KB-aktivering.
förordning
IRAK-1-aktiviteten regleras under dess aktivering och funktion. Autofosforylering spelar en roll vid IRAK-1-aktivering (se Aktivering ), och förmedlar även proteasommedierad nedbrytning som resulterar i förlust av IRAK1-proteinet. Alternativt kan IRAK-1 regleras på transkriptionsnivå . IRAK-1b splitsningsvarianten saknar kinasaktivitet och är resistent mot proteasommedierad nedbrytning. Dessutom har IRAK-1c splitsningsvariant en trunkerad och därmed muterad sekvens vid C-terminalen av dess kinasdomän och fungerar som en negativ regulator av TLR- och IL-1R-signalvägarna.
Interaktioner
IRAK1 har visat sig interagera med följande proteiner:
Klinisk signifikans
IRAK-1-signalering är involverad i reumatoid artrit . Dessutom spelar IRAK-1 en betydande roll vid cancer.
Vidare läsning
- Auron PE (1999). "Interleukin 1-receptorn: ligandinteraktioner och signaltransduktion". Cytokin & tillväxtfaktorrecensioner . 9 (3–4): 221–237. doi : 10.1016/S1359-6101(98)00018-5 . PMID 9918122 .
- Cao Z, Xiong J, Takeuchi M, Kurama T, Goeddel DV (oktober 1996). "TRAF6 är en signalgivare för interleukin-1". Naturen . 383 (6599): 443–446. Bibcode : 1996Natur.383..443C . doi : 10.1038/383443a0 . PMID 8837778 . S2CID 4269027 .
- Brenner V, Nyakatura G, Rosenthal A, Platzer M (augusti 1997). "Genomisk organisation av två nya gener på mänsklig Xq28: kompakt head to head arrangemang av IDH gamma och TRAP delta är bevarad i råtta och mus". Genomik . 44 (1): 8–14. doi : 10.1006/geno.1997.4822 . PMID 9286695 .
- Huang J, Gao X, Li S, Cao Z (november 1997). "Rekrytering av IRAK till interleukin 1-receptorkomplexet kräver interleukin 1-receptoraccessoarprotein" . Proceedings of the National Academy of Sciences of the United States of America . 94 (24): 12829–12832. Bibcode : 1997PNAS...9412829H . doi : 10.1073/pnas.94.24.12829 . PMC 24223 . PMID 9371760 .
- Muzio M, Natoli G, Saccani S, Levrero M, Mantovani A (juni 1998). "Den mänskliga signalvägen: divergens mellan kärnfaktor kappaB och JNK/SAPK-aktivering uppströms om tumörnekrosfaktorreceptorassocierad faktor 6 (TRAF6)" . Journal of Experimental Medicine . 187 (12): 2097–2101. doi : 10.1084/jem.187.12.2097 . PMC 2212359 . PMID 9625770 .
- Maschera B, Ray K, Burns K, Volpe F (april 1999). "Överuttryck av ett enzymiskt inaktivt interleukin-1-receptorassocierat kinas aktiverar nukleär faktor-kappaB" . The Biochemical Journal . 339 (2): 227–231. doi : 10.1042/0264-6021:3390227 . PMC 1220149 . PMID 10191251 .
- Wesche H, Gao X, Li X, Kirschning CJ, Stark GR, Cao Z (juli 1999). "IRAK-M är en ny medlem av familjen Pelle/interleukin-1-receptorassocierade kinaser (IRAK)" . Journal of Biological Chemistry . 274 (27): 19403–19410. doi : 10.1074/jbc.274.27.19403 . PMID 10383454 .
- Yang RB, Mark MR, Gurney AL, Godowski PJ (juli 1999). "Signalhändelser inducerade av lipopolysackaridaktiverad tollliknande receptor 2". Journal of Immunology . 163 (2): 639–643. PMID 10395652 .
- Thomas JA, Allen JL, Tsen M, Dubnicoff T, Danao J, Liao XC, et al. (juli 1999). "Försämrad cytokinsignalering hos möss som saknar det IL-1-receptorassocierade kinaset". Journal of Immunology . 163 (2): 978–984. PMID 10395695 .
- Reichwald K, Thiesen J, Wiehe T, Weitzel J, Poustka WA, Rosenthal A, et al. (mars 2000). "Jämförande sekvensanalys av MECP2-locus i människa och mus avslöjar nya transkriberade regioner". Däggdjurs genom . 11 (3): 182–190. doi : 10.1007/s003350010035 . PMID 10723722 . S2CID 15901911 .
- Burns K, Clatworthy J, Martin L, Martinon F, Plumpton C, Maschera B, et al. (juni 2000). "Tollip, en ny komponent i IL-1RI-vägen, länkar IRAK till IL-1-receptorn". Naturens cellbiologi . 2 (6): 346–351. doi : 10.1038/35014038 . PMID 10854325 . S2CID 32036101 .
- Böl G, Kreuzer OJ, Brigelius-Flohé R (juli 2000). "Translokation av interleukin-1-receptorassocierat kinas-1 (IRAK-1) till kärnan" . FEBS Bokstäver . 477 (1–2): 73–78. doi : 10.1016/S0014-5793(00)01759-2 . PMID 10899313 .
- Hartley JL, Temple GF, Brasch MA (november 2000). "DNA-kloning med användning av platsspecifik rekombination in vitro" . Genomforskning . 10 (11): 1788–1795. doi : 10.1101/gr.143000 . PMC 310948 . PMID 11076863 .
- Vig E, Green M, Liu Y, Yu KY, Kwon HJ, Tian J, et al. (mars 2001). "SIMPL är en tumörnekrosfaktorspecifik regulator av nukleär faktor-kappaB-aktivitet" . Journal of Biological Chemistry . 276 (11): 7859–7866. doi : 10.1074/jbc.M010399200 . PMID 11096118 .
- Li X, Commane M, Jiang Z, Stark GR (april 2001). "IL-1-inducerad NFkappa B och c-Jun N-terminalt kinas (JNK) aktivering divergerar vid IL-1 receptorassocierat kinas (IRAK)" . Proceedings of the National Academy of Sciences of the United States of America . 98 (8): 4461–4465. Bibcode : 2001PNAS...98.4461L . doi : 10.1073/pnas.071054198 . PMC 31857 . PMID 11287640 .
- Jensen LE, Whitehead AS (augusti 2001). "IRAK1b, en ny alternativ splitsningsvariant av interleukin-1-receptorassocierat kinas (IRAK), förmedlar interleukin-1-signalering och har förlängd stabilitet" . Journal of Biological Chemistry . 276 (31): 29037–29044. doi : 10.1074/jbc.M103815200 . PMID 11397809 .
- Qian Y, Commane M, Ninomiya-Tsuji J, Matsumoto K, Li X (november 2001). "IRAK-medierad translokation av TRAF6 och TAB2 i den interleukin-1-inducerade aktiveringen av NFkappa B" . Journal of Biological Chemistry . 276 (45): 41661–41667. doi : 10.1074/jbc.M102262200 . PMID 11518704 .