PRKACA
| PRKACA | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , PKACA, PPNAD4, proteinkinas cAMP-aktiverad katalytisk subenhet alfa, CAFD1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID :n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Den katalytiska subenheten α av proteinkinas A är ett nyckelregulatoriskt enzym som hos människor kodas av PRKACA -genen . Detta enzym är ansvarigt för att fosforylera andra proteiner och substrat, vilket förändrar deras aktivitet. Proteinkinas A katalytisk subenhet (PKA Ca) är en medlem av AGC-kinasfamiljen (proteinkinaserna A, G och C ) och bidrar till kontrollen av cellulära processer som inkluderar glukosmetabolism , celldelning och kontextuellt minne. PKA Cα är en del av ett större proteinkomplex som ansvarar för att kontrollera när och var proteiner fosforyleras. Defekt reglering av PKA- holoenzymaktivitet har kopplats till utvecklingen av hjärt-kärlsjukdomar, vissa endokrina störningar och cancer.
Upptäckt
Edmond H. Fischer och Edwin G. Krebs vid University of Washington upptäckte PKA i slutet av 1950-talet medan de arbetade genom mekanismerna som styr glykogenfosforylas . De insåg att ett nyckelmetaboliskt enzym som kallas fosforylaskinas aktiverades av ett annat kinas som var beroende av den andra budbärarens cykliska AMP (cAMP). De döpte detta nya enzym till det cAMP-beroende proteinkinaset och fortsatte med att rena och karakterisera detta nya enzym. Fischer och Krebs vann Nobelpriset i fysiologi eller medicin 1992 för denna upptäckt och deras fortsatta arbete med kinaser, och deras motsvarigheter proteinfosfataserna . Idag är detta cAMP-beroende proteinkinas enklare noterat som PKA.
En annan viktig händelse i PKA:s historia inträffade när Susan Taylor och Janusz Sowadski vid University of California San Diego löste den tredimensionella strukturen av enzymets katalytiska subenhet. Man insåg också att inuti celler finns PKA-katalytiska subenheter i komplex med regulatoriska subenheter och inhibitorproteiner som blockerar enzymets aktivitet. En ytterligare aspekt av PKA-verkan som pionjärer av John Scott vid University of Washington och Kjetil Tasken vid University of Oslo är att enzymet är bundet inuti cellen genom dess association med en familj av A-kinas-förankringsproteiner (AKAPs) . Detta ledde till hypotesen att den subcellulära lokaliseringen av förankrad PKA styr vilka proteiner som regleras av kinaset.
Katalytiska underenheter
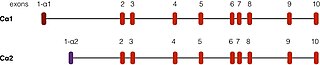
PRKACA finns på kromosom 19 hos människor. Det finns två väl beskrivna transkript av denna gen, som härrör från alternativa splitsningshändelser . Den vanligaste formen, kallad Ca1, uttrycks i mänsklig vävnad. Ett annat transkript, kallat Cα2, finns främst i spermieceller och skiljer sig från Cα1 endast i de första 15 aminosyrorna .
Dessutom finns det två andra isoformer av den katalytiska subenheten av PKA som kallas Cβ och Cγ som härrör från olika gener men har liknande funktioner som Ca. Cβ finns rikligt i hjärnan och i lägre nivåer i andra vävnader, medan Cγ med största sannolikhet uttrycks i testiklarna.
Signal

Inaktivt PKA-holoenzym existerar som en tetramer som består av två regulatoriska (R) subenheter och två katalytiska (C) subenheter. Biokemiska studier visade att det finns två typer av R-subenheter. Typ IR-subenheterna av vilka det finns två isoformer (RIα och RIβ) binder de katalytiska subenheterna för att skapa typ I PKA-holoenzymet. På samma sätt skapar typ II R-subenheter, av vilka det finns två isoformer (RIIα och RIIβ), typ II PKA-holoenzymet. I närvaro av cAMP binder varje R-subenhet 2 cAMP-molekyler och orsakar en konformationsförändring i R-subenheterna som frisätter C-subenheterna för att fosforylera nedströmssubstrat. De olika R-subenheterna skiljer sig i sin känslighet för cAMP, expressionsnivåer och subcellulära placeringar. A-kinas-förankringsproteiner (AKAPs) binder en yta som bildas mellan båda R-subenheterna och riktar kinaset till olika platser i cellen. Detta optimerar var och när cellulär kommunikation sker inom cellen.
Klinisk signifikans
Proteinkinas A har varit inblandat i ett antal sjukdomar, inklusive kardiovaskulär sjukdom, tumörer i binjurebarken och cancer. Det har spekulerats i att onormalt höga nivåer av PKA-fosforylering bidrar till hjärtsjukdomar. Detta påverkar excitation-kontraktionskopplingen, vilket är en rytmisk process som kontrollerar sammandragningen av hjärtmuskeln genom de synkroniserade åtgärderna av kalcium- och cAMP-känsliga enzymer . Det finns också bevis för att fellokaliseringen av PKA-signalering bidrar till hjärtarytmier, särskilt Long QT-syndrom . Detta resulterar i oregelbundna hjärtslag som kan orsaka plötslig död.
Mutationer i PRKACA -genen som främjar onormal enzymaktivitet har kopplats till sjukdom i binjuren. Flera mutationer i PRKACA har hittats hos patienter med Cushings syndrom som resulterar i en ökning av PKAs förmåga att brett fosforylera andra proteiner. En mutation i PRKACA -genen som orsakar en aminosyrasubstitution av leucin till arginin i position 206, hittades hos över 60 % av patienterna med binjurebarktumörer . Andra mutationer och genetiska förändringar i PRKACA -genen har identifierats i binjurebarkadenom som också stör PKA-signaleringen, vilket leder till avvikande PKA-fosforylering. Ca-genen har också inkriminerats i en mängd olika cancerformer, inklusive kolon-, njur-, rektal-, prostata-, lung-, bröst-, binjurekarcinom och lymfom.
Det finns nyligen och växande intresse för fibrolamellärt hepatocellulärt karcinom . Den molekylära grunden för denna sällsynta form av levercancer som drabbar unga vuxna är en genetisk deletion på kromosom 19. Förlusten av DNA har hittats hos en mycket hög procent av patienterna. Konsekvensen av denna deletion är den onormala sammansmältningen av två gener - DNAJB1 , som är genen som kodar för värmechockproteinet 40 (Hsp40), och PRKACA . Ytterligare analyser av fibrolamellära hepatocellulära karcinomvävnader visar en ökning av proteinnivåerna av detta DNAJ-PKAc-fusionsprotein. Detta överensstämmer med hypotesen att ökat kinas i levervävnader kan initiera eller vidmakthålla denna sällsynta form av levercancer. Med tanke på mängden information om de tredimensionella strukturerna av DNAJ och PKA Ca finns det visst hopp om att nya läkemedel kan utvecklas för att rikta in sig på detta atypiska och potentiellt tumörframkallande fusionskinas.
Anteckningar
externa länkar
- PDBe-KB ger en översikt över all strukturinformation som finns tillgänglig i PDB för humant cAMP-beroende proteinkinas katalytisk subenhet alfa (PRKACA)