Tullliknande receptor
| Tollliknande receptor | |
|---|---|
 Den krökta leucinrika repeterande regionen av tollliknande receptorer, representerad här av TLR3-
| |
| identifierare | |
| Symbol | Tullliknande receptor |
| Membran | 7 |
| PIRSF037595 | |
Toll-like receptors ( TLR ) är en klass av proteiner som spelar en nyckelroll i det medfödda immunsystemet . De är single-pass membranomspännande receptorer som vanligtvis uttrycks på sentinelceller såsom makrofager och dendritiska celler , som känner igen strukturellt konserverade molekyler som härrör från mikrober . När dessa mikrober har nått fysiska barriärer såsom huden eller tarmkanalens slemhinna , känns de igen av TLR, som aktiverar immuncellssvar . TLR:erna inkluderar TLR1 , TLR2 , TLR3 , TLR4 , TLR5 , TLR6 , TLR7 , TLR8 , TLR9 , TLR10 , TLR11 , TLR12 och TLR13. Människor saknar gener för TLR11, TLR12 och TLR13 och möss saknar en funktionell gen för TLR10. TLR1, TLR2, TLR4, TLR5, TLR6 och TLR10 är belägna på cellmembranet, medan TLR3, TLR7, TLR8 och TLR9 är belägna i intracellulära vesiklar (eftersom de är sensorer av nukleinsyror ).
TLRs fick sitt namn från sin likhet med proteinet som kodas av tollgenen .
Fungera
Immunsystemets förmåga att känna igen molekyler som i stor utsträckning delas av patogener beror delvis på närvaron av immunreceptorer som kallas toll-like receptors (TLR) som uttrycks på membranen av leukocyter inklusive dendritiska celler , makrofager , naturliga mördarceller , celler av adaptiv immunitet T-celler och B-celler , och icke-immuna celler ( epitel- och endotelceller och fibroblaster ).
Bindningen av ligander - antingen i form av adjuvans som används i vaccinationer eller i form av invasiva delar under tider av naturlig infektion - till TLR markerar de molekylära nyckelhändelserna som i slutändan leder till medfödda immunsvar och utveckling av antigenspecifika förvärvade immunitet.
Vid aktivering rekryterar TLR adapterproteiner (proteiner som förmedlar andra protein-proteininteraktioner) i immuncellens cytosol för att sprida den antigeninducerade signaltransduktionsvägen . Dessa rekryterade proteiner är sedan ansvariga för den efterföljande aktiveringen av andra nedströmsproteiner , inklusive proteinkinaser (IKKi, IRAK1 , IRAK4 och TBK1 ) som ytterligare förstärker signalen och i slutändan leder till uppreglering eller undertryckande av gener som orkestrerar inflammatoriska svar och andra transkriptioner evenemang. Vissa av dessa händelser leder till cytokinproduktion , proliferation och överlevnad, medan andra leder till större adaptiv immunitet. Om liganden är en bakteriell faktor kan patogenen fagocyteras och smältas och dess antigener presenteras för CD4+ T-celler . I fallet med en viral faktor kan den infekterade cellen stänga av sin proteinsyntes och kan genomgå programmerad celldöd ( apoptos ). Immunceller som har upptäckt ett virus kan också frigöra antivirala faktorer som interferoner .
Tullliknande receptorer har också visat sig vara en viktig länk mellan medfödd och adaptiv immunitet genom deras närvaro i dendritiska celler . Flagellin , en TLR5-ligand, inducerar cytokinutsöndring vid interaktion med TLR5 på humana T-celler.
Superfamilj
TLR: er är en typ av mönsterigenkänningsreceptor (PRR) och känner igen molekyler som i stor utsträckning delas av patogener men som kan skiljas från värdmolekyler, kollektivt kallade patogenassocierade molekylära mönster (PAMP). Förutom igenkännandet av exogena PAMPs, kan TLRs också binda till endogena skadeassocierade molekylära mönster (DAMPs) såsom värmechockproteiner (HSPs) eller plasmamembranbeståndsdelar. TLR tillsammans med Interleukin-1-receptorerna bildar en receptorsuperfamilj , känd som "interleukin-1-receptorn/tullliknande receptorsuperfamiljen"; alla medlemmar i denna familj har gemensamt en så kallad TIR-domän (toll-IL-1-receptor).
Det finns tre undergrupper av TIR-domäner. Proteiner med subgrupp 1 TIR-domäner är receptorer för interleukiner som produceras av makrofager , monocyter och dendritiska celler och alla har extracellulära immunglobulindomäner (Ig). Proteiner med subgrupp 2 TIR-domäner är klassiska TLR:er och binder direkt eller indirekt till molekyler av mikrobiellt ursprung. En tredje undergrupp av proteiner som innehåller TIR-domäner består av adapterproteiner som uteslutande är cytosoliska och förmedlar signalering från proteiner i undergrupp 1 och 2.
Utökad familj
TLR finns i såväl ryggradslösa som ryggradslösa djur . Molekylära byggstenar för TLRs är representerade i bakterier och i växter, och receptorer för igenkänning av växtmönster är välkända för att krävas för värdförsvar mot infektion. TLR:erna verkar alltså vara en av de äldsta, bevarade komponenterna i immunsystemet .
Under de senaste åren har TLR identifierats även i däggdjurens nervsystem. Medlemmar av TLR-familjen upptäcktes på glia, neuroner och på neurala progenitorceller där de reglerar cellödebeslut.
Det har uppskattats att de flesta däggdjursarter har mellan tio och femton typer av tollliknande receptorer. Tretton TLR:er (benämnt helt enkelt TLR1 till TLR13) har identifierats i människor och möss tillsammans, och likvärdiga former av många av dessa har hittats i andra däggdjursarter. Däremot finns inte ekvivalenter till vissa TLR som finns hos människor i alla däggdjur. Till exempel finns en gen som kodar för ett protein som är analogt med TLR10 hos människor närvarande i möss , men verkar ha skadats någon gång i det förflutna av ett retrovirus . Å andra sidan uttrycker möss TLR 11, 12 och 13, varav ingen är representerad hos människor. Andra däggdjur kan uttrycka TLR som inte finns hos människor. Andra icke-däggdjursarter kan ha TLR som skiljer sig från däggdjur, vilket visas av anti-cellvägg TLR14, som finns i Takifugu pufferfish. Detta kan komplicera processen att använda försöksdjur som modeller för mänsklig medfödd immunitet.
TLR:er för ryggradsdjur är uppdelade efter likhet i familjerna TLR 1/2/6/10/14/15, TLR 3, TLR 4, TLR 5, TLR 7/8/9 och TLR 11/12/13/16/21 /22/23.
TLR i Drosophila -immunitet

Inblandningen av avgiftssignalering i immunitet visades först i fruktflugan, Drosophila melanogaster . Fruktflugor har endast medfödda immunsvar vilket gör det möjligt för studier att undvika störningar av adaptiva immunmekanismer på signaltransduktion. Flugsvaret på svamp- eller bakterieinfektion sker genom två distinkta signalkaskader, varav en är vägtullvägen och den andra är immunbristvägen . Tullvägen liknar däggdjurs-TLR-signalering, men till skillnad från däggdjurs-TLR aktiveras tull inte direkt av patogenassocierade molekylära mönster ( PAMPs ). Dess receptorektodomän känner igen den kluvna formen av cytokinspätzle, som utsöndras i hemolymfen som en inaktiv dimer prekursor. Tullreceptorn delar den cytoplasmatiska TIR-domänen med däggdjurs-TLR, men ektodomänen och den intracytoplasmatiska svansen är olika. Denna skillnad kan återspegla en funktion av dessa receptorer som cytokinreceptorer snarare än PRR .
Tullvägen aktiveras av olika stimuli, såsom grampositiva bakterier , svampar och virulensfaktorer . Först aktiveras Spätzle-processenzymet (SPE) som svar på infektion och klyver spätzle ( spz ). Klyvd spätzle binder sedan till tollreceptorn och tvärbinder dess ektodomäner. Detta utlöser konformationsförändringar i receptorn vilket resulterar i signalering genom toll. Från denna punkt och framåt är signaleringskaskaden mycket lik däggdjurssignalering genom TLR:er. Det avgiftsinducerade signalkomplexet (TICS) består av MyD88 , Tube och Pelle (ortologen för däggdjurs-IRAK). Signal från TICS transduceras sedan till kaktus (homolog av däggdjurs IκB ), fosforylerad kaktus polyubiquityleras och nedbryts, vilket möjliggör nukleär translokation av DIF (dorsal-relaterad immunitetsfaktor; en homolog av däggdjurs NF-kB ) och induktion av transkription av gener peptider (AMP) såsom drosomycin .
Drosophila har totalt 9 tollfamiljer och 6 spz -familjegener som interagerar med varandra i olika grad.
TLR2
TLR2 har också betecknats som CD282 (differentieringskluster 282).
TLR3
TLR3 använder inte den MyD88-beroende vägen. Dess ligand är retroviralt dubbelsträngat RNA ( dsRNA ), som aktiverar den TRIF- beroende signalvägen. För att utforska rollen av denna väg i retroviral omprogrammering framställdes knock-down-tekniker för TLR3 eller TRIF, och resultaten visade att endast TLR3-vägen krävs för fullständig induktion av målgenuttryck av retrovirusexpressionsvektorn. Detta retrovirala uttryck av fyra transkriptionsfaktorer ( Okt4 , Sox2 , Klf4 och c-Myc ; OSKM) inducerar pluripotens i somatiska celler. Detta stöds av studie, som visar att effektiviteten och mängden av human iPSC-generering, med användning av retrovirala vektorer, reduceras genom knockdown av vägen med peptidhämmare eller shRNA- knockdown av TLR3 eller dess adapterprotein TRIF. Sammantaget orsakar stimulering av TLR3 stora förändringar i kromatinombyggnad och nukleär omprogrammering, och aktivering av inflammatoriska vägar krävs för dessa förändringar, induktion av pluripotensgener och generering av humaninducerade pluripotenta stamcellskolonier (iPSC).
TLR11
Som noterats ovan uttrycker humana celler inte TLR11 , men mössceller gör det. Musspecifik TLR11 känner igen uropatogen E.coli och den apicomplexan parasiten Toxoplasma gondii . Med Toxoplasma är dess ligand proteinprofilin och liganden för E. coli är flagellin . Flagellinet från enteropatogenen Salmonella känns också igen av TLR11.
Eftersom mus TLR11 kan känna igen Salmonella effektivt, infekteras inte normala möss av oral Salmonella Typhi , som orsakar mat- och vattenburen gastroenterit och tyfoidfeber hos människor. TLR11-bristiga knockoutmöss , å andra sidan, är effektivt infekterade. Som ett resultat kan denna knockout-mus fungera som en sjukdomsmodell för mänsklig tyfoidfeber.
Sammanfattning av kända däggdjurs-TLR
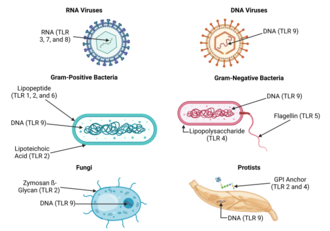
Tullliknande receptorer binder och aktiveras av olika ligander, som i sin tur sitter på olika typer av organismer eller strukturer. De har också olika adaptrar för att reagera på aktivering och är ibland placerade på cellytan och ibland till interna cellfack . Dessutom uttrycks de av olika typer av leukocyter eller andra celltyper :
| Receptor | Ligand(er) | Ligandplacering | Adapter(ar) | Plats | Celltyper |
|---|---|---|---|---|---|
| TLR 1 | flera triacyllipopeptider | Bakteriellt lipoprotein | MyD88 /MAL | cellytan |
|
| TLR 2 | flera glykolipider | Bakteriella peptidoglykaner | MyD88/MAL | cellytan |
|
| flera lipopeptider och proteolipider | Bakteriella peptidoglykaner | ||||
| lipoteikoinsyra | Gram-positiva bakterier | ||||
| HSP70 | Värdceller | ||||
| zymosan ( beta-glukan ) | Svampar | ||||
| Många andra | |||||
| TLR 3 | dubbelsträngat RNA , poly I:C | virus | TRIF | cellfack |
|
| TLR 4 | lipopolysackarid | Gramnegativa bakterier | MyD88/MAL/ TRIF /TRAM | cellytan |
|
| flera värmechockproteiner | Bakterier och värdceller | ||||
| fibrinogen | värdceller | ||||
| heparansulfatfragment _ | värdceller | ||||
| hyaluronsyrafragment _ | värdceller | ||||
| nickel | |||||
| Olika opioidläkemedel _ | |||||
| TLR 5 | Bakteriell flagellin | Bakterie | MyD88 | cellytan |
|
| Profilin | Toxoplasma gondii | ||||
| TLR 6 | multipel diacyl lipopeptider | Mykoplasma | MyD88/MAL | cellytan |
|
| TLR 7 | imidazokinolin | små syntetiska föreningar | MyD88 | cellfack |
|
| loxoribine (en guanosin- analog) | |||||
| bropirimin | |||||
| resiquimod | |||||
| enkelsträngat RNA | RNA-virus | ||||
| TLR 8 | små syntetiska föreningar; enkelsträngat viralt RNA, fagocyterat bakteriellt RNA(24) | MyD88 | cellfack |
|
|
| TLR 9 | ometylerat CpG-oligodeoxinukleotid- DNA | Bakterier, DNA-virus | MyD88 | cellfack |
|
| TLR 10 | triacylerade lipopeptider | okänd | cellytan |
|
|
| TLR 11 | Profilin | Toxoplasma gondii | MyD88 | cellfack |
|
| Flagellin | Bakterier ( E. coli , Salmonella ) | ||||
| TLR 12 | Profilin | Toxoplasma gondii | MyD88 | cellfack |
|
| TLR 13 | bakteriell ribosomal RNA-sekvens "CGGAAAGACC" (men inte den metylerade versionen) | Virus, bakterier | MyD88, TAK-1 | cellfack |
|
Ligander
På grund av specificiteten hos tollliknande receptorer (och andra medfödda immunreceptorer) kan de inte lätt förändras under utvecklingens gång, dessa receptorer känner igen molekyler som ständigt är förknippade med hot (dvs patogen eller cellstress) och är mycket specifika för dessa hot (dvs. kan inte förväxlas med självmolekyler som normalt uttrycks under fysiologiska förhållanden). Patogenassocierade molekyler som uppfyller detta krav anses vara kritiska för patogenens funktion och svåra att förändra genom mutation; de sägs vara evolutionärt bevarade. Något konserverade egenskaper hos patogener inkluderar bakteriella cellytelipopolysackarider (LPS), lipoproteiner , lipopeptider och lipoarabinomannan ; proteiner såsom flagellin från bakteriella flageller ; dubbelsträngat RNA av virus; eller de ometylerade CpG- öarna av bakteriellt och viralt DNA ; och även av CpG-öarna som finns i promotorerna för eukaryot DNA; samt vissa andra RNA- och DNA-molekyler. För de flesta av TLRs ligandigenkänningsspecificitet nu fastställts genom geninriktning (även känd som "gen knockout"): en teknik genom vilken individuella gener kan raderas selektivt i möss. Se tabellen ovan för en sammanfattning av kända TLR-ligander.
Endogena ligander
Det stereotypa inflammatoriska svaret som provoceras av tollliknande receptoraktivering har föranlett spekulationer om att endogena aktivatorer av tollliknande receptorer kan delta i autoimmuna sjukdomar. TLR har misstänkts binda till värdmolekyler inklusive fibrinogen (involverad i blodkoagulering ), värmechockproteiner (HSPs), HMGB1 , extracellulära matriskomponenter och själv-DNA (det bryts normalt ned av nukleaser, men under inflammatoriska och autoimmuna tillstånd kan det bildas ett komplex med endogena proteiner, blir resistenta mot dessa nukleaser och får tillgång till endosomala TLR som TLR7 eller TLR9). Dessa endogena ligander produceras vanligtvis som ett resultat av icke-fysiologisk celldöd.
Signal
TLRs tros fungera som dimerer . Även om de flesta TLR:er verkar fungera som homodimerer , bildar TLR2 heterodimerer med TLR1 eller TLR6, varvid varje dimer har olika ligandspecificitet. TLR kan också bero på andra co-receptorer för full ligandkänslighet, såsom i fallet med TLR4:s igenkänning av LPS , vilket kräver MD-2. CD14 och LPS-bindande protein ( LBP ) är kända för att underlätta presentationen av LPS till MD-2.
En uppsättning endosomala TLR:er innefattande TLR3, TLR7, TLR8 och TLR9 känner igen nukleinsyra som härrör från virus såväl som endogena nukleinsyror i samband med patogena händelser. Aktivering av dessa receptorer leder till produktion av inflammatoriska cytokiner såväl som typ I-interferoner ( interferon typ I ) för att hjälpa till att bekämpa virusinfektion.
Adapterproteinerna och kinaserna som förmedlar TLR-signalering har också målinriktats. Dessutom har slumpmässig mutagenes med ENU använts för att dechiffrera TLR-signalvägarna. När de aktiveras rekryterar TLR adaptermolekyler i cellernas cytoplasma för att sprida en signal. Fyra adaptermolekyler är kända för att vara involverade i signalering. Dessa proteiner är kända som MyD88 , TIRAP (även kallad Mal), TRIF och TRAM (TRIF-relaterad adaptermolekyl).
TLR-signalering är uppdelad i två distinkta signalvägar, den MyD88-beroende och TRIF-beroende vägen.
MyD88-beroende väg
Det MyD88-beroende svaret inträffar vid dimerisering av TLR och används av alla TLR utom TLR3. Dess primära effekt är aktivering av NFκB och mitogenaktiverat proteinkinas . Ligandbindning och konformationsförändring som sker i receptorn rekryterar adapterproteinet MyD88, en medlem av TIR -familjen. MyD88 rekryterar sedan IRAK4 , IRAK1 och IRAK2 . IRAK-kinaser fosforylerar och aktiverar sedan proteinet TRAF6 , vilket i sin tur polyubiquinerar proteinet TAK1, såväl som sig självt för att underlätta bindningen till IKK-β . Vid bindning fosforylerar TAK1 IKK-β, som sedan fosforylerar IκB vilket orsakar dess nedbrytning och tillåter NFκB att diffundera in i cellkärnan och aktivera transkription och efterföljande induktion av inflammatoriska cytokiner.
TRIF-beroende väg
Både TLR3 och TLR4 använder den TRIF-beroende vägen, som utlöses av dsRNA respektive LPS. För TLR3 leder dsRNA till aktivering av receptorn och rekryterar adaptern TRIF . TRIF aktiverar kinaserna TBK1 och RIPK1 , vilket skapar en gren i signalvägen. TRIF/TBK1-signalkomplexet fosforylerar IRF3 och tillåter dess translokation till kärnan och produktion av interferon typ I. Samtidigt orsakar aktivering av RIPK1 polyubiquitinering och aktivering av TAK1- och NFκB-transkription på samma sätt som den MyD88-beroende vägen.
TLR-signalering leder i slutändan till induktion eller undertryckande av gener som orkestrerar det inflammatoriska svaret. Sammanlagt aktiveras tusentals gener av TLR-signalering, och tillsammans utgör TLR:erna en av de mest pleiotropa men ändå hårt reglerade gateways för genmodulering.
TLR4 är den enda TLR som använder alla fyra adaptrarna. Komplex bestående av TLR4, MD2 och LPS rekryterar TIR-domän-innehållande adaptrar TIRAP och MyD88 och initierar därmed aktivering av NFκB (tidig fas) och MAPK. TLR4-MD2-LPS-komplexet genomgår sedan endocytos och i endosom bildar det ett signalkomplex med TRAM- och TRIF-adaptrar. Denna TRIF-beroende väg leder återigen till IRF3-aktivering och produktion av typ I-interferoner, men den aktiverar också NFκB-aktivering i sen fas. Både sen och tidig fasaktivering av NFκB krävs för produktion av inflammatoriska cytokiner.
Medicinsk relevans
Imiquimod (används huvudsakligen inom dermatologi ) är en TLR7-agonist och dess efterföljare resiquimod är en TLR7- och TLR8-agonist. Nyligen har resiquimod utforskats som ett medel för cancerimmunterapi, som verkar genom stimulering av tumörassocierade makrofager.
Flera TLR-ligander är i klinisk utveckling eller testas i djurmodeller som vaccinadjuvans , med den första kliniska användningen på människor i ett rekombinant herpes zoster-vaccin 2017, som innehåller en monofosforyllipid A-komponent.
TLR7-budbärar-RNA-uttrycksnivåer hos mjölkdjur i ett naturligt utbrott av mul- och klövsjuka har rapporterats.
TLR4 har visat sig vara viktigt för de långsiktiga biverkningarna av opioider . Dess aktivering leder till nedströms frisättning av inflammatoriska modulatorer inklusive TNF-α och IL-1β , och konstant lågnivåfrisättning av dessa modulatorer tros minska effektiviteten av opioidläkemedelsbehandling med tiden och är involverad i opioidtolerans, hyperalgesi och allodyni . Morfininducerad TLR4-aktivering dämpar smärtdämpning av opioider och ökar utvecklingen av opioidtolerans och -beroende , drogmissbruk och andra negativa biverkningar som andningsdepression och hyperalgesi. Läkemedel som blockerar verkan av TNF-α eller IL-1β har visat sig öka de smärtstillande effekterna av opioider och minska utvecklingen av tolerans och andra biverkningar, och detta har även påvisats med läkemedel som blockerar själva TLR4.
De "onaturliga" enantiomererna av opioidläkemedel såsom (+)-morfin och (+)-naloxon saknar affinitet för opioidreceptorer, producerar fortfarande samma aktivitet vid TLR4 som deras "normala" enantiomerer. Så "onaturliga" entianomerer av opioider som (+)-naloxon, kan användas för att blockera TLR4-aktiviteten hos opioidanalgetika utan att ha någon affinitet för μ-opioidreceptorn
Upptäckt
När mikrober först upptäcktes som orsaken till infektionssjukdomar, stod det omedelbart klart att flercelliga organismer måste kunna känna igen dem när de är infekterade och därmed kunna känna igen molekyler som är unika för mikrober. En stor mängd litteratur, som sträcker sig över större delen av förra seklet, vittnar om sökandet efter nyckelmolekylerna och deras receptorer. För mer än 100 år sedan Richard Pfeiffer , en student till Robert Koch , termen " endotoxin " för att beskriva ett ämne som produceras av gramnegativa bakterier som kan provocera fram feber och chock hos försöksdjur . Under decennierna som följde karakteriserades endotoxin kemiskt och identifierades som en lipopolysackarid (LPS) som produceras av de flesta gramnegativa bakterier. Denna lipopolysackarid är en integrerad del av det gramnegativa membranet och frisätts vid destruktion av bakterien. Andra molekyler (bakteriella lipopeptider , flagellin och ometylerat DNA ) visade sig i sin tur provocera fram värdsvar som normalt är skyddande. Dessa reaktioner kan dock vara skadliga om de är överdrivet långvariga eller intensiva. Det följde logiskt att det måste finnas receptorer för sådana molekyler, som kan uppmärksamma värden på närvaron av infektion, men dessa förblev svårfångade i många år. Tullliknande receptorer räknas nu bland nyckelmolekylerna som varnar immunsystemet för närvaron av mikrobiella infektioner.
Den prototypiska medlemmen av familjen, tollreceptorn (; Tl) i fruktflugan Drosophila melanogaster , upptäcktes 1985 av 1995 års nobelpristagare Christiane Nüsslein-Volhard och Eric Wieschaus och kollegor. Det var känt för sin utvecklingsfunktion vid embryogenes genom att etablera den dorsala - ventrala axeln. Den fick sitt namn efter Christiane Nüsslein-Volhards utrop från 1985, " Das ist ja toll ! " ("Det är fantastiskt!"), med hänvisning till den underutvecklade ventrala delen av en fruktflugalarv. Den klonades av Kathryn Andersons laboratorium 1988. År 1996 fann Jules A. Hoffmann och hans kollegor att toll hade en väsentlig roll i flugans immunitet mot svampinfektion , vilket den uppnådde genom att aktivera syntesen av antimikrobiella peptider.
Den första rapporterade mänskliga tollliknande receptorn beskrevs av Nomura och kollegor 1994, kartlades till en kromosom av Taguchi och kollegor 1996. Eftersom immunfunktionen hos toll i Drosophila då inte var känd, antogs det att TIL (nu känd som TLR1) kan delta i utvecklingen av däggdjur. Emellertid, 1991 (före upptäckten av TIL) observerades det att en molekyl med en tydlig roll i immunfunktionen hos däggdjur, interleukin- 1 (IL-1) receptorn, också hade homologi med drosophila toll; de cytoplasmatiska delarna av båda molekylerna var likartade.
1997 visade Charles Janeway och Ruslan Medzhitov att en tollliknande receptor som nu är känd som TLR4 kan, när den artificiellt ligeras med antikroppar, inducera aktiveringen av vissa gener som är nödvändiga för att initiera ett adaptivt immunsvar . TLR 4-funktionen som en LPS-avkännande receptor upptäcktes av Bruce A. Beutler och kollegor. Dessa arbetare använde positionskloning för att bevisa att möss som inte kunde svara på LPS hade mutationer som avskaffade funktionen hos TLR4. Detta identifierade TLR4 som en av nyckelkomponenterna i receptorn för LPS.
I sin tur avlägsnades de andra TLR-generna i möss genom geninriktning, till stor del i laboratoriet av Shizuo Akira och kollegor. Varje TLR tros nu upptäcka en diskret samling molekyler – några av mikrobiellt ursprung och vissa produkter av cellskador – och signalera närvaron av infektioner.
Växthomologer av vägtull upptäcktes av Pamela Ronald 1995 (ris XA21) och Thomas Boller 2000 ( Arabidopsis FLS2).
2011 tilldelades Beutler och Hoffmann Nobelpriset i medicin eller fysiologi för sitt arbete. Hoffmann och Akira fick Canada Gairdner International Award 2011.
Anteckningar och referenser
Se även
externa länkar
- Toll-Like+Receptors vid US National Library of Medicine Medical Subject Headings (MeSH)
- Toll+protein,+Drosophila vid US National Library of Medicine Medical Subject Headings (MeSH)
- TollML: Toll-like receptors and ligands databas vid universitetet i München
- Den avgiftsliknande receptorfamiljen av medfödda immunreceptorer (pdf)
- Toll-Like receptor Pathway
- BioScience-animationer