Dekompressions fysiologi
Fysiologin för dekompression är den aspekt av fysiologi som påverkas av exponering för stora förändringar i omgivande tryck, och involverar en komplex interaktion av gaslöslighet, partialtryck och koncentrationsgradienter, diffusion, bulktransport och bubbelmekanik i levande vävnader. Gas andas vid omgivningstryck och en del av denna gas löses upp i blodet och andra vätskor. Inert gas fortsätter att tas upp tills gasen som är löst i vävnaderna är i ett tillstånd av jämvikt med gasen i lungorna, ( se : " Mättnadsdykning "), eller så sänks det omgivande trycket tills de inerta gaserna lösts upp i vävnaderna befinner sig i en högre koncentration än jämviktstillståndet och börjar diffundera ut igen.
Absorptionen av gaser i vätskor beror på lösligheten av den specifika gasen i den specifika vätskan, koncentrationen av gas, vanligtvis uttryckt som partialtryck, och temperatur. I studien av dekompressionsteori undersöks beteendet hos gaser lösta i kroppsvävnaderna och modelleras för tryckvariationer över tid. När den är upplöst sker distributionen av den upplösta gasen genom perfusion , där lösningsmedlet (blodet) cirkuleras runt dykarens kropp, och genom diffusion , där upplöst gas kan spridas till lokala områden med lägre koncentration när det inte finns något bulkflöde av lösningsmedlet . Givet tillräckligt med tid vid ett specifikt partialtryck i andningsgasen kommer koncentrationen i vävnaderna att stabiliseras, eller mättas, med en hastighet som beror på den lokala lösligheten, diffusionshastigheten och perfusionen. Om koncentrationen av den inerta gasen i andningsgasen reduceras under den i någon av vävnaderna, kommer det att finnas en tendens för gas att återvända från vävnaderna till andningsgasen. Detta är känt som utgasning och inträffar under dekompression, när minskningen av omgivningstrycket eller en förändring av andningsgas minskar partialtrycket för den inerta gasen i lungorna.
De kombinerade koncentrationerna av gaser i en given vävnad kommer att bero på historien om tryck och gassammansättning. Under jämviktsförhållanden kommer den totala koncentrationen av lösta gaser att vara mindre än det omgivande trycket, eftersom syre metaboliseras i vävnaderna och den producerade koldioxiden är mycket mer löslig. Men under en minskning av omgivningstrycket kan tryckminskningshastigheten överstiga den hastighet med vilken gas kan elimineras genom diffusion och perfusion, och om koncentrationen blir för hög kan den nå ett stadium där bubbelbildning kan ske i den övermättade vävnader. När trycket av gaser i en bubbla överstiger de kombinerade yttre trycken av omgivande tryck och ytspänningen från gränsytan mellan bubbla och vätska, kommer bubblorna att växa, och denna tillväxt kan orsaka skador på vävnader. Symtom som orsakas av denna skada kallas tryckfallssjuka .
De faktiska hastigheterna för diffusion och perfusion, och lösligheten av gaser i specifika vävnader är inte allmänt kända och varierar avsevärt. Emellertid har matematiska modeller föreslagits som approximerar den verkliga situationen i större eller mindre utsträckning, och dessa modeller används för att förutsäga om symptomatisk bubbelbildning sannolikt kommer att inträffa för en given tryckexponeringsprofil. Effektiv dekompression kräver att dykaren stiger tillräckligt snabbt för att etablera en så hög dekompressionsgradient, i så många vävnader som möjligt, utan att provocera utvecklingen av symtomatiska bubblor. Detta underlättas av det högsta acceptabelt säkra syrepartialtrycket i andningsgasen och undvikande av gasförändringar som kan orsaka bildning eller tillväxt av motdiffusionsbubblor. Utvecklingen av scheman som är både säkra och effektiva har komplicerats av det stora antalet variabler och osäkerheter, inklusive personlig variation i respons under varierande miljöförhållanden och arbetsbelastning.
Löslighet
Löslighet är egenskapen hos en gas, flytande eller fast substans ( det lösta ämnet ) att hållas homogent dispergerat som molekyler eller joner i ett flytande eller fast medium ( lösningsmedlet ). I dekompressionsteorin är gasernas löslighet i vätskor av största vikt, eftersom det är bildningen av bubblor från dessa gaser som orsakar tryckfallssjuka.
Gasernas löslighet i vätskor påverkas av tre huvudfaktorer:
- Beskaffenheten av lösningsmedelsvätskan och det lösta ämnet
- Temperatur (gaser är mindre lösliga i vatten men kan vara mer lösliga i organiska lösningsmedel vid högre temperaturer.)
- Tryck (lösligheten av en gas i en vätska är proportionell mot partialtrycket av gasen på vätskan - Henrys lag ,
Närvaron av andra lösta ämnen i lösningsmedlet kan också påverka lösligheten.
Kroppsvävnader inkluderar vattenhaltiga och lipidkomponenter i varierande förhållanden, och lösligheten av de gaser som är involverade i dekompression i dessa vävnader kommer att variera beroende på deras sammansättning.
| Gas | Molekylvikt | Lipid/vattenlöslighetsförhållande |
|---|---|---|
| Väte | 2 | 3.1 |
| Helium | 4 | 1.7 |
| Neon | 20 | 2.07 |
| Kväve | 28 | 5.2 |
Diffusion
Diffusion är rörelsen av molekyler eller joner i ett medium när det inte finns något bruttomassflöde av mediet, och kan förekomma i gaser, vätskor eller fasta ämnen, eller vilken kombination som helst. Diffusion drivs av den kinetiska energin hos de spridande molekylerna - den är snabbare i gaser och långsammare i fasta ämnen jämfört med vätskor på grund av variationen i avstånd mellan kollisioner, och diffusion är snabbare när temperaturen är högre som molekylernas medelenergi. är bättre. Diffusion är också snabbare i mindre, lättare molekyler där helium är det extrema exemplet. Heliums diffusivitet är 2,65 gånger snabbare än kväve.
Partialtrycksgradienten, även känd som koncentrationsgradienten , kan användas som en modell för drivmekanismen för diffusion. Partialtrycksgradienten är variationen av partialtrycket (eller mer exakt, koncentrationen) av det lösta ämnet (upplöst gas) från en punkt till en annan i lösningsmedlet. De lösta molekylerna kommer slumpmässigt att kollidera med de andra närvarande molekylerna och tenderar med tiden att spridas ut tills fördelningen är statistiskt enhetlig. Detta har effekten att molekyler diffunderar från områden med högre koncentration (partialtryck) till områden med lägre koncentration, och diffusionshastigheten är proportionell mot koncentrationens förändringshastighet. Vävnader i vilka en inert gas är mer löslig kommer så småningom att utveckla ett högre innehåll av löst gas än vävnader där gasen är mindre löslig.
Inertgasupptag (Ingassing)
I detta sammanhang avser inert gas en gas som inte är metaboliskt aktiv . Atmosfäriskt kväve (N 2 ) är det vanligaste exemplet, och helium (He) är den andra inerta gasen som vanligtvis används i andningsblandningar för dykare .
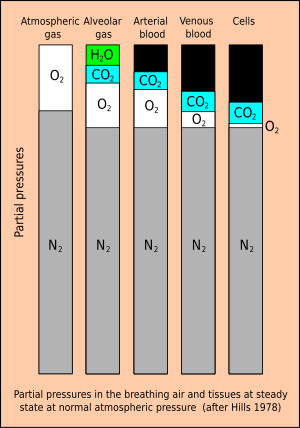
Atmosfäriskt kväve har ett partialtryck på cirka 0,78 bar vid havsnivån. Luft i alveoler späds ut av mättad vattenånga (H 2 O) och koldioxid (CO 2 ), en ämnesomsättningsprodukt som avges av blodet, och innehåller mindre syre (O 2 ) än atmosfärisk luft som en del av den tas upp av blodet för metabolt bruk. Det resulterande partialtrycket av kväve är cirka 0,758 bar.
Vid atmosfärstryck är kroppsvävnaderna därför normalt mättade med kväve vid 0,758 bar (569 mmHg). Vid ökat omgivande tryck på grund av djup eller habitattrycksättning fylls en dykares lungor med andningsgas vid det ökade trycket, och partialtrycken för de ingående gaserna kommer att ökas proportionellt.
- Till exempel: Vid 10 meter havsvatten (msw) kommer partialtrycket av kväve i luften att vara 1,58 bar.
De inerta gaserna från andningsgasen i lungorna diffunderar in i blodet i de alveolära kapillärerna ("flytta nedåt i tryckgradienten") och distribueras runt i kroppen av den systemiska cirkulationen i den process som kallas perfusion.
Perfusion
Perfusion är massflödet av blod genom vävnaderna. Upplösta material transporteras i blodet mycket snabbare än de skulle distribueras genom enbart diffusion (minutersordning jämfört med timmar).
Den lösta gasen i det alveolära blodet transporteras till kroppsvävnaderna av blodcirkulationen. Där diffunderar det genom cellmembranen och in i vävnaderna, där det så småningom kan nå jämvikt. Ju större blodtillförsel till en vävnad, desto snabbare kommer den att nå jämvikt med gas vid det nya partialtrycket.
Mättnad och övermättnad
Om tillförseln av gas till ett lösningsmedel är obegränsad, kommer gasen att diffundera in i lösningsmedlet tills det är så mycket upplöst att jämvikt uppnås och mängden som diffunderar tillbaka ut är lika med mängden som diffunderar in. Detta kallas mättnad .
Om det externa partialtrycket av gasen (i lungorna) sedan minskas, kommer mer gas att diffundera ut än in. Detta är ett tillstånd som kallas övermättnad . Gasen kommer inte nödvändigtvis att bilda bubblor i lösningsmedlet i detta skede, men övermättnad är nödvändig för bubblans tillväxt. En övermättad lösning av gaser i en vävnad kan bilda bubblor om lämpliga kärnbildningsställen finns. Övermättnad kan definieras som summan av alla gaspartialtryck i vätskan som överstiger det omgivande trycket i vätskan.
Vävnad halva gånger
Om ett exponentiellt upptag av gas antas, vilket är en bra approximation av experimentella värden för diffusion i icke-levande homogena material, är halvtid för en vävnad den tid det tar för vävnaden att ta upp eller frigöra 50 % av skillnaden i löst gaskapacitet vid ett ändrat partialtryck. För varje på varandra följande halvtid kommer vävnaden att ta upp eller frigöra hälften igen av den kumulativa skillnaden i sekvensen ½, ¾, 7/8, 15/16, 31/32, 63/64 etc. Antalet halva gånger som valts att anta full mättnad beror på dekompressionsmodellen och varierar vanligtvis från 4 (93,75 %) till 6 (98,44 %). Halvtider för vävnadsfack som används vid dekompressionsmodellering sträcker sig från 1 minut till minst 720 minuter.
- Till exempel: En 5 minuters vävnad kommer att vara 50 % mättad på 5 minuter, 75 % på 10 minuter, 87,5 % på 15 minuter och för praktiska ändamål mättad på cirka 30 minuter (98,44 % mättad vid 6 halvtider)
Ett specifikt vävnadsutrymme kommer att ha olika halveringstider för gaser med olika löslighet och diffusionshastighet. Denna modell kanske inte på ett adekvat sätt beskriver dynamiken för avgasning om gasfasbubblor är närvarande.
Avgasning av vävnader
Gas förblir löst i vävnaderna tills partialtrycket för den gasen i lungorna reduceras tillräckligt för att orsaka en koncentrationsgradient med blodet i en lägre koncentration än de relevanta vävnaderna. Ett sänkt partialtryck i lungorna kommer att resultera i att mer gas diffunderar ut ur blodet in i lunggasen och mindre från lunggasen till blodet. En liknande situation uppstår mellan blodet och varje vävnad. När koncentrationen i blodet sjunker under koncentrationen i den intilliggande vävnaden diffunderar gasen ut ur vävnaden in i blodet och transporteras sedan tillbaka till lungorna där den diffunderar in i lunggasen och elimineras sedan genom utandning. . Om omgivningstrycksreduktionen begränsas kommer denna desaturation att ske i den upplösta fasen, men om det omgivande trycket sänks tillräckligt kan bubblor bildas och växa, både i blod och andra övermättade vävnader.
När gasen i en vävnad har en koncentration där mer diffunderar ut än in, sägs vävnaden vara övermättad med den gasen i förhållande till de omgivande vävnaderna. Övermättnad kan också definieras som när det kombinerade partialtrycket av gaser lösta i en vävnad överstiger det totala omgivande trycket på vävnaden, och det finns en teoretisk möjlighet för bubblabildning eller tillväxt.
Inneboende omättnad
Det sker en metabolisk minskning av det totala gastrycket i vävnaderna. Summan av partialtrycken av gasen som dykaren andas måste nödvändigtvis balansera med summan av partialtrycken i lunggasen. I alveolerna har gasen fuktats med ett partialtryck på cirka 63 mbar (47 mmHg) och har fått cirka 55 mbar (41 mmHg) koldioxid från det venösa blodet. Syre har också diffunderat in i det arteriella blodet, vilket minskar partialtrycket av syre i alveolerna med cirka 67 mbar (50 mmHg) Eftersom det totala trycket i alveolerna måste balansera med omgivningstrycket, resulterar denna utspädning i ett effektivt partialtryck av kväve på cirka 758 mb (569 mmHg) i luft vid normalt atmosfärstryck.
Vid ett stabilt tillstånd, när vävnaderna har mättats av de inerta gaserna i andningsblandningen, minskar metaboliska processer partialtrycket för det mindre lösliga syret och ersätter det med koldioxid, som är betydligt mer lösligt i vatten. I cellerna i en typisk vävnad kommer partialtrycket av syre att sjunka till cirka 13 mbar (10 mmHg), medan partialtrycket för koldioxid kommer att vara cirka 65 mbar (49 mmHg). Summan av dessa partialtryck (vatten, syre, koldioxid och kväve) kommer till ungefär 900 mbar (675 mmHg), vilket är cirka 113 mbar (85 mmHg) mindre än andningsgasens totala tryck. Detta är ett betydande mättnadsunderskott, och det ger en buffert mot övermättnad och en drivkraft för att lösa upp bubblor.
Experiment tyder på att graden av omättnad ökar linjärt med trycket för en andningsblandning med fixerad sammansättning och minskar linjärt med fraktionen av inert gas i andningsblandningen. Som en konsekvens av detta är förutsättningarna för att maximera graden av omättnad en andningsgas med lägsta möjliga andel inert gas – det vill säga rent syre, vid högsta tillåtna partialtryck. Detta mättnadsunderskott kallas också för " syrefönstret ". eller partiell tryckvakans.
Kvarvarande inert gasvävnadsbelastning
När dykaren kommer upp till ytan efter dekompression finns en kvarvarande halt av inert gas fördelat mellan vävnaderna. Det finns det okända faktiska gasinnehållet och det modellerade gasinnehållet enligt dekompressionsalgoritmen. Kvarvarande gasobalans kommer att fortsätta att utjämnas mot andningsgasen, och för beräkningsändamål antas fortsätta att utjämnas i enlighet med algoritmen, normalt under antagande av atmosfärisk luft som andningsgas. Restgasbelastningen beräknas och modellvävnadsfacken uppdateras så att den kan användas som baslinje för repetitiva dyk. Det skulle också vara baslinjen för ytterligare dekompression om dykaren skulle stiga upp till en högre höjd. Syrgas eller nitroxandning efter dyk kommer att spola ut inerta gaser ur vävnaderna snabbare än luft, men detta beräknas normalt inte av dykdatorer. Minskad inert gasvävnadsbelastning minskar risken att utveckla DCS vid flygning eller på annat sätt utsättas för ett lägre omgivande tryck efter dykning.
Faktorer som påverkar upptag och eliminering av lösta gaser
Utbytet av lösta gaser mellan blod och vävnader kontrolleras av perfusion och i mindre utsträckning av diffusion, särskilt i heterogena vävnader. Fördelningen av blodflödet till vävnaderna är variabel och föremål för en mängd olika influenser. När flödet är lokalt högt domineras det området av perfusion och av diffusion när flödet är lågt. Fördelningen av flödet styrs av medelartärtrycket och det lokala kärlmotståndet, och artärtrycket beror på hjärtminutvolymen och det totala kärlmotståndet. Grundläggande kärlmotstånd styrs av det sympatiska nervsystemet, och metaboliter, temperatur och lokala och systemiska hormoner har sekundära och ofta lokaliserade effekter, som kan variera avsevärt med omständigheterna. Perifer kärlsammandragning i kallt vatten minskar den totala värmeförlusten utan att öka syreförbrukningen tills skakningar börjar, då syreförbrukningen kommer att öka, även om kärlsammandragningen kan bestå.
Andningsgassammansättning
Andningsgasens sammansättning under tryckexponering och dekompression är signifikant för inertgasupptagning och eliminering för en given tryckexponeringsprofil. Andningsgasblandningar för dykning kommer vanligtvis att ha en annan gasfraktion av kväve än luftens. Partialtrycket för varje komponentgas kommer att skilja sig från det för kväve i luft på ett givet djup, och upptag och eliminering av varje inert gaskomponent är proportionell mot det faktiska partialtrycket över tiden. De två främsta anledningarna till användningen av blandade andningsgaser är minskningen av kvävets partialtryck genom utspädning med syre, för att göra nitroxblandningar , för att minska kväveupptaget under tryckexponering och påskynda kväveelimineringen under dekompression, och ersättning av helium (och ibland annat gaser) för att kvävet ska minska de narkotiska effekterna och arbetet med att andas under högtrycksexponering. Beroende på proportionerna av helium och kväve kallas dessa gaser heliox om det inte finns kväve, eller trimix om det finns kväve och helium tillsammans med det essentiella syret.
De inerta gaserna som används som substitut för kväve har olika löslighets- och diffusionsegenskaper i levande vävnader än det kväve de ersätter. Till exempel är det vanligaste inertgasutspädningsmedlet som ersättning för kväve helium, som är betydligt mindre lösligt i levande vävnad, men som också diffunderar snabbare på grund av heliumatomens relativt lilla storlek och massa i jämförelse med kvävemolekylen .
Andningsgassammansättningen är mätbar, kvantifierbar och används i nuvarande dekompressionsalgoritmer. För dykning med öppen krets tillhandahålls den vanligtvis som användarinmatning, inklusive användarinmatning av gasbrytare. I slutna kretsrebreathers beräknas gassammansättningen ofta i realtid, med hjälp av användarinmatad utspädningskomposition som definierar förhållandet mellan kväve och helium och det uppmätta momentana syrepartialtrycket.
Kroppstemperatur och träning
Blodflödet till hud och fett påverkas av hud- och kärntemperatur, och vilande muskelperfusion styrs av själva muskelns temperatur. Under träning balanseras ökat flöde till de arbetande musklerna ofta av minskat flöde till andra vävnader, såsom njurar, mjälte och lever.
Blodflödet till musklerna är lägre i kallt vatten, men träning håller muskeln varm och flödet förhöjt även när huden är nedkyld. Blodflödet till fett ökar normalt under träning, men detta hämmas av nedsänkning i kallt vatten. Anpassning till kyla minskar den extrema vasokonstriktion som vanligtvis uppstår vid nedsänkning i kallt vatten.
Träning som ökar hjärtfrekvensen ökar den totala perfusionen, vilket kommer att öka transporthastigheten av inerta gaser till och från de mer perfunderade vävnaderna, och högre temperatur i vävnaderna kommer att öka diffusionshastigheten genom dessa vävnader. Det finns en avvägning under dekompression mellan mild träning som förbättrar eliminering av inert gas och ansträngande träning som utlöser bubbelbildning och tillväxt.
Variationer i perfusionsfördelning påverkar inte nödvändigtvis respiratoriskt inert gasutbyte, även om viss gas kan vara lokalt begränsad av förändringar i perfusion. Vila i en kall miljö kommer att minska inert gasutbyte från hud, fett och muskler, medan träning ökar gasutbytet där perfusionen ökar. Träning under dekompression kan minska dekompressionstiden och risken, förutsatt att det inte finns bubblor, men kan öka risken om det finns bubblor.
Inertgasutbyte är minst gynnsamt för dykaren som är varm och tränar på djupet under upptagningsfasen, och vilar och är kall under dekompression, och mest gynnsamt för dykaren som är sval och avslappnad på djupet under upptagningen, och varm med mild träning under dekompression.
Isobarisk motdiffusion
Isobarisk motdiffusion (ICD) är diffusion av gaser i motsatta riktningar som orsakas av en förändring i sammansättningen av den externa omgivande gasen eller andningsgasen utan förändring av det omgivande trycket. Under dekompression efter ett dyk kan detta inträffa när en förändring görs i andningsgasen, eller när dykaren rör sig in i en gasfylld miljö som skiljer sig från andningsgasen.
Även om det inte strikt sett är ett dekompressionsfenomen, är det en komplikation som kan uppstå under dekompression, och som kan resultera i bildning eller tillväxt av bubblor utan förändringar i miljötrycket. Två former av detta fenomen har beskrivits av Lambertsen:
Ytlig ICD (även känd som steady state isobarisk motdiffusion) uppstår när den inerta gasen som andas av dykaren diffunderar långsammare in i kroppen än den inerta gasen som omger kroppen.
Ett exempel på detta skulle vara att andas luft i en helioxmiljö. Heliumet i heliox diffunderar snabbt in i huden medan kvävet diffunderar långsammare från kapillärerna till huden och ut ur kroppen. Den resulterande effekten genererar övermättnad på vissa platser i de ytliga vävnaderna och bildandet av inerta gasbubblor.
Deep tissue ICD (även känd som transient isobarisk motdiffusion) uppstår när olika inerta gaser andas in av dykaren i följd. Den snabbt diffuserande gasen transporteras in i vävnaden snabbare än den långsammare diffuserande gasen transporteras ut ur vävnaden.
Detta kan inträffa när dykare byter från en kväveblandning till en heliumblandning (diffusiviteten för helium är 2,65 gånger snabbare än kväve), eller när mättnadsdykare som andas hydreliox byter till en helioxblandning.
Det finns en annan effekt som kan manifesteras som ett resultat av skillnaden i löslighet mellan inerta andningsgasutspädningsmedel, som uppträder i isobariska gasväxlar nära dekompressionstaket mellan en låglöslig gas, typiskt helium, och en gas med högre löslighet, typiskt kväve.
En dekompressionsmodell för innerörat av Doolette och Mitchell tyder på att en övergående ökning av gasspänningen efter en övergång från helium till kväve i andningsgas kan bero på skillnaden i gasöverföring mellan avdelningarna. Om transporten av kväve in i det vaskulära utrymmet genom perfusion överstiger avlägsnandet av helium genom perfusion, medan överföringen av helium till kärlrummet genom diffusion från perilymfa och endolymf överstiger motdiffusionen av kväve, kan detta resultera i en tillfällig ökning av total gasspänning , eftersom tillförseln av kväve överstiger avlägsnandet av helium, vilket kan resultera i bubbelbildning och tillväxt. Denna modell antyder att diffusion av gaser från mellanörat över det runda fönstret är försumbar. Modellen är inte nödvändigtvis tillämplig på alla vävnadstyper.
Lambertsen kom med förslag för att undvika ICD-problem under dykning:
- Om dykaren är omgiven av eller mättad med kväve bör de inte andas heliumrika gaser.
- Gasväxlingar som innebär att man går från heliumrika blandningar till kväverika blandningar skulle vara acceptabla, men förändringar från kväve till helium bör innefatta rekompression.
Doolette och Mitchells nyare studie av tryckfallssjuka i innerörat (IEDCS) visar dock att innerörat kanske inte är välmodellerat av vanliga (t.ex. Bühlmann) algoritmer. Doolette och Mitchell föreslår att ett byte från en heliumrik blandning till en kväverik blandning, vilket är vanligt vid teknisk dykning när man byter från trimix till nitrox vid uppstigning, kan orsaka en övergående övermättnad av inert gas i innerörat och resultera i IEDCS. De föreslår att andningsgasbyten från heliumrika till kväverika blandningar bör planeras noggrant antingen djupt (med vederbörlig hänsyn till kvävenarkos) eller ytligt för att undvika perioden med maximal övermättnad som ett resultat av dekompressionen. Omkopplare bör också göras under andning av det största inandade syrepartialtrycket som säkert kan tolereras med vederbörlig hänsyn till syretoxicitet.
En liknande hypotes för att förklara förekomsten av IEDCS vid byte från trimix till nitrox föreslogs av Steve Burton, som ansåg effekten av den mycket större lösligheten av kväve än helium för att producera övergående ökningar av det totala inertgastrycket, vilket kan leda till DCS under isobariska förhållanden.
Burton hävdar att effekten av att byta till Nitrox från Trimix med en stor ökning av kvävefraktionen vid konstant tryck har effekten av att öka den totala gasbelastningen i särskilt de snabbare vävnaderna, eftersom förlusten av helium mer än kompenseras av ökningen av kväve. Detta kan orsaka omedelbar bubbelbildning och tillväxt i de snabba vävnaderna. En enkel regel för att undvika ICD-problem vid gasväxling vid ett dekompressionstak föreslås:
- Eventuell ökning av gasfraktionen av kväve i dekompressionsgasen bör begränsas till 1/5 av minskningen av gasfraktionen av helium.
Denna regel har visat sig framgångsrikt undvika ICD-problem på hundratals djupa trimix-dyk.
Bubbelbildning, tillväxt och eliminering
Placeringen av mikrokärnor eller var bubblor initialt bildas är inte känd. Heterogen kärnbildning och tribonukleering anses vara den mest sannolika mekanismen för bubbelbildning. Homogen kärnbildning kräver mycket större tryckskillnader än vad som upplevs vid dekompression. Den spontana bildningen av nanobubblor på hydrofoba ytor är en möjlig källa till mikrokärnor, men det är ännu inte klart om dessa kan växa till symtomatiska dimensioner då de är mycket stabila.
Införlivandet av bubbelbildning och tillväxtmekanismer i dekompressionsmodeller kan göra modellerna mer biofysiska och möjliggöra bättre extrapolering.
Flödesförhållanden och perfusionshastigheter är dominerande parametrar i konkurrens mellan vävnads- och cirkulationsbubblor, och mellan flera bubblor, för löst gas för bubblans tillväxt.
Bubbelmekanik
Jämvikt mellan krafter på ytan krävs för att en bubbla ska existera. Dessa är:
- Omgivande tryck , utövat på utsidan av ytan, verkande inåt
- Tryck på grund av vävnadsförvrängning, även på utsidan och verkande inåt
- Vätskans ytspänning vid gränsytan mellan bubblan och omgivningen. Detta är längs ytan av bubblan, så resultatet verkar mot mitten av krökningen. Detta kommer att tendera att klämma ihop bubblan och är allvarligare för små bubblor eftersom det är en omvänd funktion av radien.
- De resulterande krafterna måste balanseras av trycket på insidan av bubblan. Detta är summan av partialtrycken för gaserna inuti på grund av nettodiffusionen av gas till och från bubblan.
- Kraftbalansen i bubblan kan modifieras av ett lager av ytaktiva molekyler som kan stabilisera en mikrobubbla vid en storlek där ytspänning på en ren bubbla skulle få den att kollapsa snabbt.
- Detta ytskikt kan variera i permeabilitet , så att om bubblan komprimeras kan den bli ogenomtränglig för diffusion vid tillräcklig kompression. Permeabiliteten kan variera beroende på den specifika gasen.
Om lösningsmedlet utanför bubblan är mättat eller omättat, kommer partialtrycket att vara lägre än i bubblan, och ytspänningen kommer att öka det inre trycket i direkt proportion till ytkrökningen, vilket ger en tryckgradient för att öka diffusionen ut ur bubblan , effektivt "pressar ut gasen ur bubblan", och ju mindre bubblan är desto snabbare kommer den att pressas ut. En gasbubbla kan bara växa vid konstant omgivande tryck om det omgivande lösningsmedlet är tillräckligt övermättat för att övervinna ytspänningen eller om ytskiktet runt bubblan ger tillräcklig reaktion för att övervinna ytspänningen.
Rena bubblor som är tillräckligt små kommer att kollapsa på grund av ytspänningen om övermättnaden är låg. Bubblor med semipermeabla ytor kommer antingen att stabiliseras vid en specifik radie beroende på trycket, ytskiktets sammansättning och övermättnaden, eller fortsätta att växa i det oändliga, om de är större än den kritiska radien.
Bubbla kärnbildning
Bubblbildning sker i blodet eller andra vävnader. Ett av de hypotetiska ställena för bubbelkärnbildning är i sprickor i makromolekyler, men de faktiska platserna för bubbelbildning i vävnader är inte kända.
Ett lösningsmedel kan bära en övermättad mängd gas i lösning. Huruvida det kommer ut ur lösningen i huvuddelen av lösningsmedlet för att bilda bubblor kommer att bero på ett antal faktorer. Något som minskar ytspänningen eller adsorberar gasmolekyler, eller lokalt minskar gasens löslighet, eller orsakar en lokal minskning av statiskt tryck i en vätska kan resultera i en bubbelkärnbildning eller tillväxt. Detta kan inkludera hastighetsförändringar och turbulens i vätskor och lokala dragbelastningar i fasta och halvfasta ämnen. Lipider och andra hydrofoba ytor kan minska ytspänningen (blodkärlsväggar kan ha denna effekt). Dehydrering kan minska gaslösligheten i en vävnad på grund av högre koncentration av andra lösta ämnen och mindre lösningsmedel för att hålla gasen.
En annan teori förutsätter att mikroskopiska bubbelkärnor alltid finns i vattenhaltiga medier, inklusive levande vävnader. Dessa bubbelkärnor är sfäriska gasfaser som är tillräckligt små för att förbli i suspension men ändå starka nog att motstå kollaps, deras stabilitet tillhandahålls av ett elastiskt ytskikt bestående av ytaktiva molekyler som motstår effekten av ytspänning.
Bubbeltillväxt
När en mikrobubbla väl bildats kan den fortsätta att växa om vävnaderna fortfarande är övermättade. När bubblan växer kan den förvränga den omgivande vävnaden och orsaka skador på celler och tryck på nerver vilket resulterar i smärta, eller kan blockera ett blodkärl, avbryta blodflödet och orsaka hypoxi i de vävnader som normalt perfunderas av kärlet.
Om det finns en bubbla eller ett föremål som samlar gasmolekyler kan denna samling av gasmolekyler nå en storlek där det inre trycket överstiger den kombinerade ytspänningen och det yttre trycket och bubblan kommer att växa. Om lösningsmedlet är tillräckligt övermättat kommer diffusionen av gas in i bubblan att överstiga den hastighet med vilken den diffunderar tillbaka till lösningen, och om detta övertryck är större än trycket på grund av ytspänningen kommer bubblan att fortsätta att växa. När en bubbla växer, minskar ytspänningen och det inre trycket sjunker, vilket gör att gasen diffunderar in snabbare och diffunderar ut långsammare, så att bubblan växer eller krymper i en positiv återkopplingssituation. Tillväxthastigheten minskar när bubblan växer eftersom ytan ökar med kvadraten av radien, medan volymen ökar som kuben av radien. Om det externa trycket minskas på grund av minskat hydrostatiskt tryck under uppstigningen kommer bubblan också att växa, och omvänt kommer ett ökat yttre tryck att få bubblan att krympa, men kanske inte göra att den elimineras helt om ett trycktåligt ytskikt existerar.
Ordningshypotesen för Variable Permeability Model anger att kärnor varken skapas eller helt elimineras under tryckcykeln, och den initiala ordningen enligt storlek bevaras. Därför bestäms varje bubbelantal av egenskaperna och beteendet hos en nominell "kritisk" kärna som är vid tröskeln för bubbelbildning - alla större kärnor kommer att bilda bubblor, och alla mindre kärnor kommer inte att göra det.
Bubbelfördelning
Dekompressionsbubblor verkar bildas mestadels i de systemiska kapillärerna där gaskoncentrationen är högst, ofta de som matar venerna som dränerar de aktiva extremiteterna. De bildas vanligtvis inte i artärerna förutsatt att minskningen av omgivande tryck inte är för snabb, eftersom arteriellt blod nyligen har haft möjlighet att släppa ut överskottsgas i lungorna. En del av bubblorna som förs tillbaka till hjärtat i venerna kan överföras till den systemiska cirkulationen via en patenterad foramen ovale hos dykare med denna septumdefekt, varefter det finns risk för ocklusion av kapillärer i vilken del av kroppen de än hamnar. i.
Det är också känt att bubblor bildas i andra vävnader, där de kan orsaka skador som leder till symtom på tryckfallssjuka. Denna skada orsakas sannolikt av mekanisk deformation och påfrestningar på cellerna snarare än lokal hypoxi, vilket är en antagen mekanism i fallet med gasemboli i kapillärerna.
Bubbla eliminering
Bubblor som förs tillbaka till hjärtat i venerna kommer normalt att passera in i hjärtats högra sida, och därifrån kommer de normalt in i lungcirkulationen och så småningom passera eller fastna i lungornas kapillärer, som finns runt alveoler och mycket nära andningsgasen, där gasen diffunderar från bubblorna genom kapillär- och alveolväggarna in i gasen i lungan. Om antalet lungkapillärer som blockeras av dessa bubblor är relativt litet kommer dykaren inte att visa symtom, och ingen vävnad kommer att skadas (lungvävnaderna syresätts tillräckligt genom diffusion).
Bubblorna som är tillräckligt små för att passera genom lungkapillärerna kan vara tillräckligt små för att lösas upp på grund av en kombination av ytspänning och diffusion till en sänkt koncentration i det omgivande blodet, även om kärnbildningsteorin för Variing Permeability Model antyder att de flesta bubblor passerar genom lungcirkulationen kommer att förlora tillräckligt med gas för att passera genom kapillärerna och återgå till den systemiska cirkulationen som återvunna men stabila kärnor.
Bubblor som bildas i vävnaderna måste elimineras in situ genom diffusion, vilket innebär en lämplig koncentrationsgradient.
Tryckfallssjuka och skador
Intravaskulära bubblor orsakar klumpar av röda blodkroppar, blodplättar förbrukas, vita blodkroppar aktiveras, vaskulär permeabilitet ökar. Gasen i en bubbla kommer i jämvikt med de omgivande vävnaderna och kommer därför att innehålla vattenånga, syre och koldioxid, såväl som den inerta gasen. Vaskulära bubblor verkar bildas vid den venösa änden av kapillärerna och passerar genom venerna till höger sida av hjärtat, och cirkuleras därefter till lungorna.
Problem på grund av vaskulära dekompressionsbubblor
Bubblor kan fångas i lungkapillärerna, vilket tillfälligt blockerar dem. Om detta är allvarligt kan symtomet som kallas " chokes " uppstå.
Om dykaren har en patenterad foramen ovale (PFO) eller en pulmonell shunt , kan bubblor passera genom den och passera lungkapillärerna för att komma in i artärblodet. Om dessa bubblor inte absorberas i den arteriella plasman och fastnar i systemiska kapillärer kommer de att blockera flödet av syresatt blod till vävnaderna som tillförs av dessa kapillärer, och dessa vävnader kommer att svältas på syre. Moon och Kisslo (1988) drog slutsatsen att "bevisen tyder på att risken för allvarlig neurologisk DCI eller tidig debut DCI ökar hos dykare med en vilande höger-till-vänster-shunt genom en PFO. Det finns för närvarande inga bevis för att PFO är relaterat till milda eller sena böjningar."
Extravaskulära bubblor
Bubblor kan bildas i andra vävnader såväl som i blodkärlen. Inert gas kan diffundera in i bubbelkärnor mellan vävnader. I det här fallet kan bubblorna förvränga och permanent skada vävnaden. Dessa bubblor kan också komprimera nerver när de växer, vilket orsakar smärta.
Extravaskulära eller autoktona bubblor bildas vanligtvis i långsamma vävnader som leder, senor och muskelslidor. Direkt expansion orsakar vävnadsskada, med frisättning av histaminer och deras associerade effekter. Biokemiska skador kan vara lika viktiga som eller viktigare än mekaniska effekter.
Dekompressionsstress
Biologisk stress är ett koncept utvecklat av Hans Selye och kan definieras som ett "allmänt patofysiologiskt svar, där liknande symtom och tecken utvecklas som svar på en mängd olika medel och tillstånd". Detta fenomen är också känt som det allmänna anpassningssyndromet . Dekompression är en stressfaktor, och dekompressionsstress är effekten på organismen av de fysiska och fysiologiska faktorer som är förknippade med dekompression. Även utan att några akuta tecken och symtom ger upphov till kan vaskulära gasbubblor vara en indikator på omfattningen av dekompressionsstress, och eftersom de flesta dyk där gasbubblor bildas endast ger minimala symtom, kan de vara användbara som en indikator på risken för skada i en speciellt dyk, och kan därför vara användbart för att utveckla säkrare procedurer.
Dekompressionsstress har också beskrivits som mängden inert gas löst i olika vävnader i hela kroppen, men detta är inte meningsfullt om det inte jämförs med den mängd som skulle vara stabil i dessa vävnader vid det aktuella omgivande trycket. Det är den kombinerade effekten av alla faktorer som påverkar bildandet av inerta gasbubblor i vävnaderna under och efter dekompression. Vissa av dessa faktorer är kända och kan mätas och kvantifieras, andra är kända, misstänkta eller hypotetiska, men inte mätbara eller kvantifierbara, och vissa kan fortfarande vara helt okända. Tryckfallsstress har nämnts som en drivkraft för bubbeltillväxt och en riskfaktor för symptomatisk tryckfallssjuka hos människor och dykande djur.
Faktorer som påverkar dekompressionsstress och risk
Dykprofilen har störst inflytande på nivån av dekompressionsstress och är den enklaste uppsättningen av faktorer att mäta och kvantifiera. Det är den primära generatorn av dekompressionsstress, och utan den finns ingen dekompressionsstress och DCS kan inte utvecklas.
Andra faktorer som påverkar dekompressionsrisken inkluderar syrekoncentration, koldioxidnivåer, kroppsposition, temperatur och temperaturfördelning, vasodilatorer och sammandragande medel, andning med positivt eller negativt tryck. och uttorkning som orsakar minskad blodvolym och ökad koncentration av lösta ämnen i det som finns kvar. Dessa faktorer påverkar transporten av lösta gaser genom diffusion och perfusion och påverkar därför hastigheten för upptag och eliminering.
Individuell känslighet för tryckfallssjuka har komponenter som kan hänföras till en specifik orsak och komponenter som verkar vara slumpmässiga. Den slumpmässiga komponenten gör successiva dekompressioner till ett dåligt test av känslighet. Fetma och höga serumlipidnivåer har i vissa studier inblandats som riskfaktorer, och risken tycks öka med åldern. En annan studie har också visat att äldre försökspersoner tenderade att bubbla mer än yngre försökspersoner av skäl som ännu inte är kända, men inga trender mellan vikt, kroppsfett eller kön och bubblor identifierades, och frågan om varför vissa människor är mer benägna att utveckla bubblor än andra är fortfarande oklart.
Dykprofil
Dykprofilen har störst inflytande på nivån av dekompressionsstress och är den enklaste uppsättningen av faktorer att mäta och kvantifiera. Det är den primära generatorn av dekompressionsstress, och utan den finns ingen dekompressionsstress och DCS kan inte utvecklas. Den senaste dykhistoriken påverkar mängden inert gasbelastning i vävnaderna i början av dyket, till vilken ytterligare gas tillsätts under dyket, vilket bidrar till den belastning som måste elimineras under dekompressionen. Dykmediets djup och densitet ger det omgivande trycket som driver gasning och avgasning. Tiden på djupet påverkar upptaget och elimineringen av inerta gaser genom diffusion och perfusion. Dekompressionsstopp ger den tid som krävs för avgasning för att minska koncentrationerna till nivåer som beräknas vara acceptabelt säkra, innan uppstigningen fortsätter. Partialtrycket för den inerta gaskomponenten i andningsgasen styr koncentrationsgradienten som driver diffusion in i och ut ur vävnaderna. Uppstigningshastighet styr hastigheten för minskning av omgivande tryck. Ytatmosfärstrycket är slutpunkten för dekompression i vatten, ett lägre atmosfärstryck kräver att mer gas elimineras under dekompression för att nå säkra vävnadsövermättnadsnivåer på ytan. Ytatmosfärstrycket är främst en funktion av höjden, men det finns också en liten påverkan från variationerna i barometertrycket på grund av meteorologisk påverkan.
Träning
Övningen som görs under ett dyk kan ses i tre aspekter: typen av övning, stadium av dyket där det är middag och träningens intensitet. Var och en av dessa parametrar är mycket varierande, vilket gör den kombinerade effekten komplex att utvärdera, eftersom samma typ av träning kan ha olika effekter beroende på när den inträffar och de fysiologiska effekter den har på den specifika dykaren. Generellt sett kommer träning att öka cirkulationen, vilket under dykets faser kommer att öka inertgasupptaget, vilket kommer att öka dekompressionsstressen vid uppstigning. Träning under avgasningsstadierna kommer att främja eliminering av inert gas, vilket minskar dekompressionsstress, men träning med högre intensitet vid en tid med hög dekompressionsstress kan öka lokal vävnadsstress tillräckligt för att främja bubbelbildning och tillväxt, särskilt i leder, där perfusionen är begränsad. Mängden och intensiteten av ansträngning som krävs är inte alltid helt under kontroll av dykaren, och påverkas av både skicklighet och omständigheter. Mätning av träningsintensitet på ett sätt som är användbart för inmatning i en dekompressionsalgoritm är svårt, och effekterna är dåligt förstådda. Puls, andningsfrekvens och andningsväxling kan indikera träningsintensitet, men var och en av dessa kan förväxlas med effekter oberoende av träningsintensitet, och de är förmodligen också huvudsakligen proxies för perfusion. Även om uppgifterna lätt skulle kunna samlas in, är det inte känt hur det skulle vara användbart. Vissa tillverkare har börjat mäta puls, men det finns ännu inte några dykdatorer som kan utvärdera träningsintensiteten på ett sätt som kan användas i en dekompressionsalgoritm på ett meningsfullt sätt. Träning före ett dyk kan också påverka sannolikheten för symtomatisk DCS, med effekterna förknippade med hur lång tid innan dyket övningen görs.
Termisk status
Den termiska statusen för en dykare kan påverka dekompressionsstatus, till stor del genom effekter på perfusion vid olika stadier av dyket. En dykare som är varm kommer att bli mer noggrann perfunderad än en kall dykare, och perfusion av speciella vävnader och organ kommer att påverka mängden inert gas som är tillgänglig för att lösas upp i dessa vävnader under upptagningsdelen av dyket, och kommer på liknande sätt att påverka transporten av överskott av löst gas till lungorna där den kan elimineras under dykets dekompressionsstadier. Vattentemperaturen är endast relevant som en faktor som påverkar dykarens kroppstemperatur och värmefördelning, och värmefördelningen i dykaren är främst relevant som en faktor som påverkar perfusionsfördelningen. Att hålla dykare varma under hela dyket kan resultera i högre antal venösa bubblor. Användning av varmvattendräkter kan öka förekomsten av DCS jämfört med passiv isolering från torrdräkter, och kylning efter dyk kan förlänga risken för att utveckla DCS. Systematiska tester har visat att tidpunkten för termisk status är viktig. Kroppsvärme, som främjar hög perfusion under inblandning, främjar hög inert gasbelastning, vilket ökar risken för dekompression. Kroppsvärme under dekompression, och den associerade höga perfusionen, främjar höga hastigheter av utgasning och minskar risken för dekompression. Det bästa fallet för att minimera dekompressionsrisken är låg perfusion associerad med lägre perifera temperaturer under ingasning och hög perfusion under dekompression, och det värsta fallet är för hög perfusion under insättning och låg perfusion av vävnader med hög gasbelastning under dekompression. Från och med 2016 finns det ingen effektiv mätning av kroppstemperaturfördelning som på ett användbart sätt kan förutsäga gasöverföringshastigheter in i eller ut ur vävnader baserat på temperaturfördelning eller effektiv perfusion, eller något bevisbaserat sätt att integrera temperaturmätning i dekompressionsalgoritmer.
Anlag
Predisposition är en kategori i vilken en rad faktorer av varierande och i vissa fall osäkra betydelse har grupperats. Vissa av dessa är inneboende för dykaren, andra är varierande och påverkas av vad dykaren gör. Flera av dem påverkar perfusionen. Ingen av dem är för närvarande (2022) kvantifierbar på ett sätt som objektivt kan mätas och integreras i en dekompressionsalgoritm.
- Hydrering är förmodligen en faktor, men effekterna är inte kvantitativt förstått. Viss forskning visar att uttorkning kan öka risken för DCS, men överdriven vätskeintag är också ett problem då det ökar risken för nedsänkningslungödem. Dessutom, eftersom uttorkning kan vara ett symptom eller en konsekvens av DCS, kan det finnas viss förvirring mellan orsak och verkan. Uttorkning kan påverka perfusionen och kan också påverka lösligheten av gaser i vävnaderna.
- Fysisk kondition är också en faktor som inte är kvantitativt förstådd. En dykare måste vara tillräckligt vältränad för att klara av dykningens normala krav och ha tillräcklig reservkapacitet för att hantera rimligen förutsebara oförutsedda händelser. Det finns också data som tyder på att högre konditionsnivåer är associerade med lägre risk för DCS. Försökspersoner med hög aerob kapacitet verkar producera lägre bubbelantal efter dekompression, vilket är kvalitativt förknippat med lägre dekompressionsstress.
- DCS-historik: En historia av återkommande tryckfallssjuka kan indikera en fysiologisk benägenhet för DCS, eller en beteendemässig tendens hos dykaren eller personer de dyker med (grupptryck eller kompisbeteende kan påverka beteendet hos andra i en grupp). Det kan vara möjligt genom att analysera dykhistoriken för individen att identifiera sätt att minska framtida risker, även om detta inte alltid är fallet, eftersom vissa träffar inte är mottagliga för säker förklaring.
- Ålder: Ökande ålder verkar öka mottagligheten för DCS, men det är inte klart vilken av effekterna av åldrande som faktiskt orsakar den ökade risken. Minskade nivåer av fysisk kondition och förändringar i hälsa och dykning kan alla vara proxy för en mer grundläggande fysiologisk förändring, såsom mindre effektiv perfusion, förändringar i vävnadsgaskapacitet eller förändrad gasöverföringseffektivitet i lungorna.
- Sex: Det finns vissa bevis från kammarvårdare att kvinnor löper något större risk under den första delen av menstruationscykeln, men detta stöds inte av bevis från dyklitteraturen. Detta kan bero på att de mer kontrollerade och repeterbara förhållandena i standardiserad kammarbehandlingsexponering är mer känsliga för små variationer i personlig mottaglighet, som går förlorade i bullret vid dykexponering.
- Cirkulation: Även om cirkulation helt klart är en faktor i dekompressionens fysiologi, eftersom perfusion anses vara en begränsande faktor vid transport av löst gas till och från vävnaderna, och i transporten och distributionen av kärlbubblor under dekompression, finns det få empiriska bevis för förändrad risk på grund av försämrad cirkulation på grund av tidigare skada, kroppspositionering eller till och med uttorkning. Förekomsten av ett patenterat foramen ovale har potential att tillåta venöst blod som innehåller dekompressionsbubblor att kringgå filtration av lungkapillärnätverket, och har identifierats som en riskfaktor för allvarlig DCS, men även om PFO-frekvensen är hög, är förekomsten av allvarlig DCS låg, och graden av öppenhet mycket varierande. PFO är inte heller den enda vägen för bubblor att nå den systemiska arteriella cirkulationen, eftersom de också kan shuntas i lungcirkulationen, och detta kan ökas genom träning.
- Biologisk hälsa: Olika faktorer som kan klassificeras som biologisk hälsa kan påverka dekompressionsstress. Vikten och mekanismen för sådana faktorer har inte fastställts, och rollerna kan vara mindre eller viktiga. Näringsstatus är viktig för den allmänna hälsan och påverkar den fysiska konditionen, så det kan påverka dekompressionssäkerheten. Höga kolesterolnivåer har visat sig vara statistiskt associerade med höga bubblor, men ingen orsaksmekanism har undersökts. Lite information finns tillgänglig om läkemedels effekter på dekompressionsrisken, men vissa kan på djupet påverka fysiologiska och mentala processer, så det är rimligt att anta att det kan finnas okända effekter på dekompressionsrisken. Det är svårt att mäta effekterna då det finns ett så brett utbud av läkemedel, doser och potentiella interaktioner mellan kombinationer av läkemedel. Genetisk predisposition och epigenetisk uttryck påverkar olika aspekter av fysiologi, och kan påverka känslighet och svar på dekompressionsstress, men detta har ännu inte studerats.
- Acklimatisering: Adaptiv förändring som svar på upprepad exponering kan ge en ökad eller minskad respons, i praktiken en sensibilisering eller desensibilisering mot närvaron av löst inert gas. Publicerade data är motstridiga, men detta kan vara en artefakt av beteende. En testserie utformad för att minska störande faktorer tyder på att relativt lägre bubbelantal sannolikt är över en serie liknande dykprofiler under på varandra följande dagar.
Beteendemässiga eller processuella faktorer
Baserat på observationer i fält har Pyle (2001) antagit en hypotes att vissa beteendefaktorer i slutet av djupa tekniska dyk kan påverka dekompressionsstress och risken att utveckla symtom kort efter att ha lämnat vattnet.
- Plötsligt fall i omgivande tryck under en uppstigning till ytan från ett 6m slutstopp på syrgas.
- En förskjutning från att andas syre vid det sista 6 m dekompressionsstoppet vid ett partialtryck på 1,6 bar till att andas luft vid ytan med ett partialtryck på 0,2 bar, skulle kunna ha vasodilaterande effekter under perioden direkt efter ytbeläggning.
- Den plötsliga förändringen av ansträngningsnivån från den ganska avslappnade dekompressionsperioden till den relativt tunga ansträngningen att klättra upp ur vattnet med tung utrustning eller simma i grova havsförhållanden.
- Den plötsliga effekten av att lämna vattnet på blodfördelningen när stödet av det hydrostatiska trycket tas bort i upprätt läge kan orsaka blodskifte tillbaka från kärnan till benen, vilket vänder på effekterna av nedsänkning i början av dyket.
- Det är vanligt att alla dessa fyra förändringar sker i mycket nära följd.
Mättnadsdekompression
Dekompression från mättnad är ett specialfall där vävnaderna alla är mättade med den maximala stabila inertgasbelastningen för kombinationen av omgivande tryck och andningsgasblandning. I denna situation kan det visas att den styrande vävnaden för dekompression alltid är den långsammaste vävnaden. Detta gör schemaberäkningen relativt enkel eftersom samma schema alltid är giltigt för varje given kombination av tryck och exponering av andningsgasblandningar, och samma schema kan följas för varje given andning som blandning, med utgångspunkt från det faktiska mättnadstrycket, även om schemat kan följas påverkas av att använda en annan gasblandning för dekompression. Detta görs ofta genom att använda ett högre partialtryck av syre under dekompression än under mättnadsexponeringen.
Mättnadsdekompression vid dykning
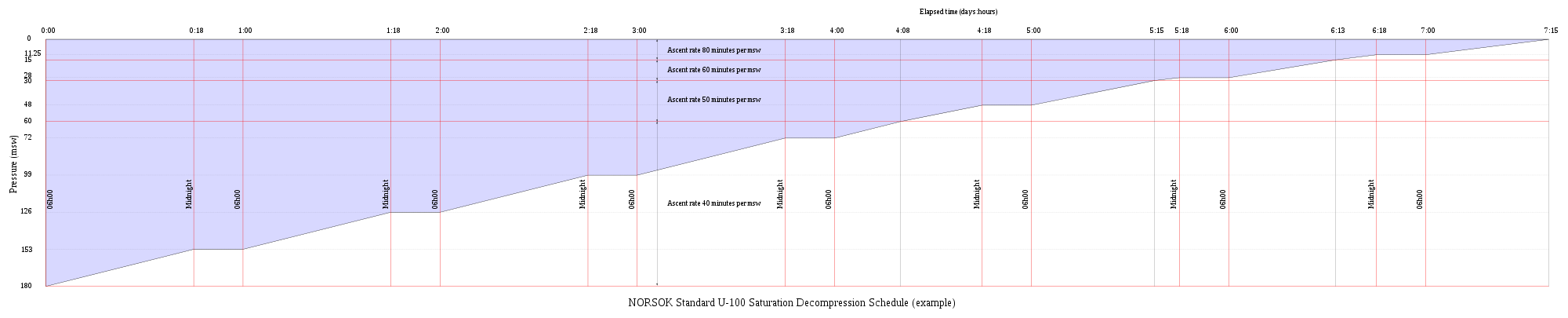
Mättnadsdekompression vid dykning är en fysiologisk övergångsprocess från ett stadigt tillstånd av full mättnad med inert gas vid förhöjt tryck till standardförhållanden vid normalt ytatmosfärstryck. Det är en lång process under vilken inerta gaser elimineras i en mycket låg hastighet begränsad av de långsammaste påverkade vävnaderna, och en avvikelse kan orsaka bildning av gasbubblor som kan ge tryckfallssjuka. De flesta operativa procedurer bygger på experimentellt härledda parametrar som beskriver en kontinuerlig långsam dekompressionshastighet, som kan bero på djup och gasblandning.
Vid mättnadsdykning anses alla vävnader vara mättade och dekompression som är säker för de långsammaste vävnaderna kommer teoretiskt att vara säker för alla snabbare vävnader i en parallell modell. Direkt uppstigning från luftmättnad vid cirka 7 msw producerar venösa gasbubblor men inte symtomatisk DCS. Djupare mättnadsexponeringar kräver dekompression till mättnadsscheman.
Den säkra hastigheten för dekompression från ett mättnadsdyk styrs av partialtrycket av syre i den inandade andningsgasen. Den inneboende omättnaden på grund av syrgasfönstret tillåter en relativt snabb initial fas av mättnadsdekompression i proportion till syrets partialtryck och styr sedan hastigheten för ytterligare dekompression begränsad av halvtiden för eliminering av inert gas från den långsammaste avdelningen. Vissa scheman för mättnadsdekompression tillåter dock inte att en dekompression börjar med en uppåtgående exkursion. Varken exkursionerna eller dekompressionsprocedurerna som används för närvarande (2016) har visat sig orsaka dekompressionsproblem isolerat, men det verkar finnas betydligt högre risk när exkursioner följs av dekompression innan icke-symptomatiska bubblor till följd av exkursioner har löst sig helt. Att börja tryckfalla medan bubblor är närvarande verkar vara den avgörande faktorn i många fall av annars oväntad tryckfallssjuka under rutinmässig mättnadsdekompression.
Tillämpning av en bubbelmodell 1985 möjliggjorde framgångsrik modellering av konventionella dekompressioner, höjddekompression, no-stop trösklar och mättnadsdyk med en inställning av fyra globala kärnbildningsparametrar. Forskning fortsätter om mättnadsdekompressionsmodellering och schematestning. Under 2015 användes ett koncept vid namn Extended Oxygen Window i preliminära tester för en modifierad mättnadsdekompressionsmodell. Denna modell tillåter en snabbare dekompressionshastighet i början av uppstigningen för att utnyttja den inneboende omättnaden på grund av metabolisk användning av syre, följt av en konstant hastighet begränsad av syrepartialtrycket i andningsgasen. Perioden med konstant dekompressionshastighet begränsas också av den tillåtna maximala syrefraktionen, och när denna gräns nås saktar dekompressionshastigheten ner igen när partialtrycket av syre minskas. Proceduren förblir experimentell från och med maj 2016. Målet är en acceptabelt säker minskning av den totala dekompressionstiden för ett givet mättnadsdjup och gasblandning.
Höjd och hypobarisk dekompression
Höjddekompression eller hypobarisk dekompression är minskningen av omgivande tryck under det normala intervallet för atmosfärstryck vid havsnivån. Höjddekompression är den naturliga konsekvensen av oskyddad höjning till höjd, medan hypobarisk dekompression beror på avsiktlig eller oavsiktlig frisättning av trycksättning av en tryckdräkt eller trycksatt fack, fordon eller livsmiljö, och kan vara kontrollerad eller okontrollerad , inklusive dekompression som förberedelse för rymden extravehicular aktivitet eller minskning av trycket i en hypobarisk kammare .
Höjddekompression kan uppstå som en dekompression från mättnad på lägre höjd, eller som dekompression från en utflykt till en lägre höjd, i fallet med människor som bor på hög höjd, som gör en kortvarig resa till låg höjd och återvänder, eller en person dekomprimering från ett dyk på höjd , vilket är ett specialfall av dykdekompression .
Plötsliga utflykter från havsnivån till höjder över 15 000 fot (4 600 m) utan syreförandning kan framkalla venösa gasbubblor. Hypobarisk dekompression kan i extrema fall leda till kokning av vätskor när trycket sänks under ångtrycket för vätskans temperatur. För vatten vid normal kroppstemperatur är denna höjd känd som Armstrong-gränsen .
Ultraljudsbubbeldetektering i dekompressionsforskning
för detektering av dopplerbubblor använder ultraljudssignaler som reflekteras från bubbelytor för att identifiera och kvantifiera gasbubblor som finns i venöst blod. Denna metod användes av Dr Merrill Spencer från Institute of Applied Physiology and Medicine i Seattle, som publicerade en rapport 1976 som rekommenderade att de då nuvarande gränserna för icke-dekompression skulle sänkas på grundval av att stora mängder venösa gasbubblor upptäcktes hos dykare. exponeras för US Navy:s no-decompression-gränser. Dessa icke-symptomatiska bubblor har blivit kända som "tysta bubblor", och tros innehålla kväve som frigörs från lösningen under uppstigningen. Annat tidigt arbete med dopplerdetektering av inerta gasbubblor vid dekompression gjordes av Alf O. Brubakk , vid Norwegian Underwater Institute. Dopplerdetektering av venösa bubblor har blivit ett viktigt verktyg i dekompressionsforskningen, dels för att den tillåter en icke-symptomatisk endpoint för experimentellt arbete, dels för att utrustningen har blivit relativt prisvärd för fältundersökningar av dykare som genomför vanliga fritids-, tekniska och professionella dykningar. Detektering av dopplerbubblor har också använts i mättnadsdykningsforskning.
Dopplersignaler för bubblor matas vanligtvis ut som en ljudsignal och kan graderas enligt Spencerskalan eller Kisman-Masurelskalan. Spencer-skalan utvecklades av Spencer och Johanson 1974 och känner igen 5 grader av bubbelsignal mot bakgrundsljuden av hjärtfunktion:
- Grad 0: Inga bubbelsignaler upptäckts
- Grad I: Enstaka bubbelsignaler upptäckts - Majoriteten av hjärtcyklerna är bubbelfria
- Grad II: Många, men mindre än hälften av hjärtcyklerna innehåller bubbelsignaler
- Grad III: Alla hjärtcykler innehåller bubbelsignaler, men de döljer inte signalerna för hjärtaktivitet
- Grad IV: Bubblsignalerna är kontinuerliga och skymmer ljuden av normal hjärtfunktion
Kisman-Masurel-skalan är liknande, och ger en mer subtil gradering av bubblor, men är svårare att bedöma skickligt. Spencerskalan har varit mer populär i praktiken. Betygskategorier är icke-linjära och kan inte beräknas som medelvärde.
Prekordial övervakning av lungartären är det vanliga övervakningsstället, eftersom det kombinerar allt blod som återvänder till kroppen innan det går till lungorna, så det är minst sannolikt att det missar bubblor från en perifer källa och är mest kompatibel med Spencer och KM-skalor, eftersom hjärtljud är tydligt hörbara. Andra platser som har använts inkluderar venen subclavia , halspulsådern , lårbensvenen och vena cava inferior . Protokoll för ultraljudsundersökning av dekompressionsbubblor är fortfarande under utveckling och kan variera mellan forskare.
Andra metoder för icke-invasiv bubbeldetektion inkluderar tvådimensionell ekokardiografi , men Doppler verkar vara känsligare och tar upp mindre bubblor.
Tvådimensionell avbildning kan ge en tvärsnittsvy längs ett enda plan av alla fyra kamrarna i hjärtat, och kan därför, till skillnad från Doppler, som bedömer blod före primärfiltrering av lungorna, även bedöma blod som kommer att cirkuleras systemiskt. Ekokardiografiutrustning har utvecklats från skrymmande laboratorieutrustning till bärbar batteridriven med tillräcklig upplösning lämplig för fältstudier. Transthorax ekokardiografi är lämplig för provtagning som används i dekompressionsstudier för att identifiera högreflekterande gasbubblor. Detektering av venösa gasbubblor med ultraljud är en känslig, men inte specifik, prediktor för negativa effekter av dekompression, liknande det publicerade sambandet mellan Doppler-detekterade bubblor och tryckfallssjuka.
Användbarheten av Doppler-detekterade bubblor i lungartärerna för att tillförlitligt förutsäga klinisk DCS är låg. Korrelationen mellan Doppler-detekterade intravaskulära bubblor och tryckfallssjuka är att nästan alla dykare som utvecklade DCS efter ett dyk producerade ett stort antal bubblor, men även grad 3 eller 4 bubblor kunde manifestera sig utan tecken eller symtom på DCS, och grad 0, 1 och 2 bubblor är förknippade med mycket låg risk. I en serie tester av Sawatsky förknippades grad 3 bubblor med en risk på 5 % och grad 4 med cirka 10 % risk. Bubblor kan uppstå efter exponeringar som har mycket goda säkerhetsdata. Användbarheten av bubbeldetektering är att bedöma relativ dekompressionsspänning. Värdet av bubbeldetektering hos icke-symptomatiska dykare är att detta kan användas som en säkrare tröskel för att bedöma acceptabel dekompressionsstress än förekomsten av kliniska symtom för att utvärdera dekompressionsalgoritmer. En frånvaro av detekterbara lungartärbubblor är en stark indikator på att eventuella kliniska tecken eller symtom som kan uppträda inte orsakas av DCS.
Se även
- Dekompressionsövningar – Tekniker och procedurer för säker dekompression av dykare
- Tryckfallssjuka – Störning orsakad av lösta gaser som kommer ut från lösningen
- Dekompression (dykning) – Tryckminskning och dess effekter under uppstigning från djupet
- Dekompressionsteori – Teoretisk modellering av dekompressionsfysiologi
- Ekvivalent luftdjup – Metod för att jämföra dekompressionskrav för luft och en given nitroxblandning
- Ekvivalent narkotiskt djup – Metod för att jämföra de narkotiska effekterna av en trimix dykgas med luft
- Historien om dekompressionsforskning och utveckling – Kronologisk lista över anmärkningsvärda händelser i dykdekompressionens historia.
- Hyperbariska behandlingsscheman – Dykdekompressionsbehandling
- Syrefönster – Fysiologisk effekt av syremetabolismen på den totala koncentrationen av löst gas i venöst blod
- Dekompressionsmodeller:
- Bühlmann dekompressionsalgoritm – Matematisk modell av vävnads inert gasupptag och frigöring med tryckförändring
- Haldanes dekompressionsmodell – Dekompressionsmodell utvecklad av John Scott Haldane
- Bubblamodell med reducerad gradient – Dekompressionsalgoritm
- Thalmann-algoritm – Matematisk modell för dykardekompression
- Termodynamisk modell för dekompression – Tidig modell där dekompression styrs av volymen gasbubblor som kommer ut ur lösningen
- Varierande permeabilitetsmodell – Dekompressionsmodell och algoritm baserad på bubbelfysik
Källor
- Hamilton, Robert W.; Thalmann, Edward D. (2003). "10.2: Dekompressionsövning". I Brubakk, Alf O.; Neuman, Tom S. (red.). Bennett och Elliotts dyknings fysiologi och medicin (5:e reviderade upplagan). USA: Saunders. s. 455–500. ISBN 0-7020-2571-2 . OCLC 51607923 .
-
Huggins, Karl E. (1992). "Dynamics of decompression workshop" . Kurs som undervisas vid University of Michigan . Arkiverad från originalet den 15 april 2013 . Hämtad 10 januari 2012 .
{{ citera journal }}: CS1 underhåll: olämplig URL ( länk ) - US Navy Diving Manual, 6:e revisionen . USA: US Naval Sea Systems Command. 2008 . Hämtad 15 juni 2008 .
- Wienke, Bruce R.; O'Leary, Timothy R. (13 februari 2002). "Bubblamodell med reducerad gradient: Dykalgoritm, bas och jämförelser" ( PDF) . Tampa, Florida: NAUI Technical Diving Operations . Hämtad 25 januari 2012 .
-
Yount, DE (1991). Hans-Jurgen, K.; Harper Jr., DE (red.). "Gelatin, bubblor och böjar" . International Pacifica Scientific Diving..., (Proceedings of the American Academy of Underwater Sciences elfte årliga Scientific Diving Symposium som hölls 25–30 september 1991. University of Hawaii, Honolulu, Hawaii) . Arkiverad från originalet den 13 januari 2013 . Hämtad 25 januari 2012 .
{{ citera journal }}: CS1 underhåll: olämplig URL ( länk )
Vidare läsning
-
Ball, R.; Himm, J.; Homer, LD; Thalmann, ED (1995). "Förklarar tidsförloppet för bubblans utveckling risken för tryckfallssjuka?" . Undervattensmedicin och hyperbarisk medicin . 22 (3): 263–280. ISSN 1066-2936 . PMID 7580767 . Arkiverad från originalet den 11 augusti 2011.
{{ citera journal }}: CS1 underhåll: unfit URL ( länk ) -
Gerth, Wayne A.; Doolette, David J. (2007). "VVal-18 och VVal-18M Thalmann Algorithm – Luftdekompressionstabeller och procedurer" . Navy Experimental Diving Unit, TA 01-07, NEDU TR 07-09 . Arkiverad från originalet den 12 maj 2013 . Hämtad 27 januari 2012 .
{{ citera journal }}: CS1 underhåll: olämplig URL ( länk ) - Gribble, M. de G. (1960); En jämförelse av höghöjds- och högtryckssyndromen vid tryckfallssjuka, Br. J. Ind. Med., 1960, 17, 181.
- Hills. B. (1966); En termodynamisk och kinetisk syn på tryckfallssjuka. Avhandling
- Lippmann, John; Mitchell, Simon (2005). Deeper into Diving (2:a upplagan). Melbourne, Australien: JL Publications. ISBN 0-9752290-1-X .
- Powell, Mark (2008). Deco för dykare . Southend-on-Sea: Aquapress. ISBN 978-1-905492-07-7 .