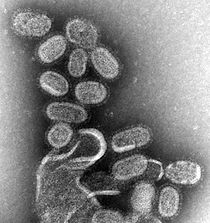
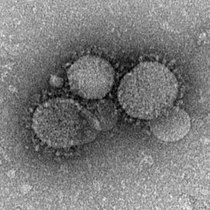
Emergent virus
Ett framväxande virus (eller framväxande virus ) är ett virus som antingen har dykt upp nyligen , särskilt ökar i förekomst / geografiskt utbredningsområde eller som har potential att öka inom en snar framtid. Nya virus är en ledande orsak till framväxande infektionssjukdomar och ökar folkhälsoutmaningar globalt, med tanke på deras potential att orsaka sjukdomsutbrott som kan leda till epidemier och pandemier . Förutom att orsaka sjukdomar kan framväxande virus också ha allvarliga ekonomiska konsekvenser. Nya exempel inkluderar SARS-relaterade coronavirus , som har orsakat SARS - utbrottet 2002-2004 ( SARS-CoV-1 ) och 2019-21-pandemin av COVID-19 ( SARS-CoV-2 ). Andra exempel inkluderar det humana immunbristviruset som orsakar HIV/AIDS ; de virus som är ansvariga för ebola ; influensaviruset H5N1 som är ansvarigt för fågelinfluensan ; och H1N1/09 , som orsakade svininfluensapandemin 2009 (en tidigare framväxande stam av H1N1 orsakade spanska sjukan 1918). Viral uppkomst hos människor är ofta en konsekvens av zoonos , som innebär att en virussjukdom går över olika arter till människor från andra djur. Eftersom zoonotiska virus finns i djurreservoarer är de mycket svårare att utrota och kan därför etablera ihållande infektioner i mänskliga populationer.
Nya virus ska inte förväxlas med virus som återkommer eller nyupptäckta virus. Ett virus som återuppstår anses allmänt vara ett tidigare upptäckt virus som håller på att återuppstå, till exempel mässling . Ett nyligen upptäckt virus är ett tidigare okänt virus som hade cirkulerat i arten som endemiska eller epidemiska infektioner. Nyligen upptäckta virus kan ha undgått klassificering eftersom de inte lämnade några distinkta ledtrådar och/eller inte kunde isoleras eller förökas i cellkultur . Exempel inkluderar humant rhinovirus (en ledande orsak till vanliga förkylningar som först identifierades 1956), hepatit C (identifierades så småningom 1989) och humant metapneumovirus (beskrivs först 2001, men tros ha cirkulerat sedan 1800-talet). Eftersom upptäckten av sådana virus är teknikdriven kommer antalet rapporterade sannolikt att öka.
Zoonos
Med tanke på sällsyntheten av spontan utveckling av nya virusarter är den vanligaste orsaken till framväxande virus hos människor zoonos . Detta fenomen beräknas stå för 73 % av alla nya eller återkommande patogener , med virus som spelar en oproportionerligt stor roll. RNA-virus är särskilt frekventa och står för 37 % av nya och återkommande patogener. Ett brett spektrum av djur - inklusive vilda fåglar, gnagare och fladdermöss - är förknippade med zoonotiska virus. Det är inte möjligt att förutsäga specifika zoonotiska händelser som kan vara associerade med en viss djurreservoar vid en given tidpunkt.
Zoonotisk spridning kan antingen resultera i självbegränsade "återvändsgränd"-infektioner, där ingen ytterligare överföring från människa till människa inträffar (som med rabiesvirus), eller i infektiösa fall, där den zoonotiska patogenen kan upprätthålla människa-människa överföring (som med ebolavirus ). Om det zoonotiska viruset kan upprätthålla framgångsrik överföring från människa till människa kan ett utbrott inträffa. Vissa spillover-händelser kan också resultera i att viruset anpassar sig uteslutande för mänsklig infektion (som inträffade med HIV-viruset ), i vilket fall människor blir en ny reservoar för patogenen.
Ett framgångsrikt zoonotiskt "hopp" beror på mänsklig kontakt med ett djur som hyser en virusvariant som kan infektera människor. För att övervinna begränsningar i värdområdet och upprätthålla effektiv överföring från människa till människa, kommer virus som härrör från en djurreservoar normalt att genomgå mutation , genetisk rekombination och omsortering . På grund av deras snabba replikation och höga mutationshastigheter är det mer sannolikt att RNA-virus framgångsrikt anpassar sig för invasion av en ny värdpopulation.
Exempel på animaliska källor
Fladdermöss
Även om fladdermöss är viktiga medlemmar i många ekosystem, är de också ofta inblandade som frekventa källor till nya virusinfektioner. Deras immunsystem har utvecklats på ett sådant sätt att de undertrycker alla inflammatoriska svar på virusinfektioner, vilket gör det möjligt för dem att bli toleranta värdar för utvecklande virus, och följaktligen tillhandahålla stora reservoarer av zoonotiska virus. De är associerade med fler zoonotiska virus per värdart än något annat däggdjur, och molekylära studier har visat att de är de naturliga värdarna för flera högprofilerade zoonotiska virus, inklusive allvarliga akuta respiratoriska syndromrelaterade koronavirus och Ebola / Marburg hemorragisk feber filovirus . När det gäller deras potential för spillover-händelser har fladdermöss tagit över den ledande rollen som tidigare tilldelats gnagare. Virus kan överföras från fladdermöss via flera mekanismer, inklusive bett, aerosolisering av saliv (t.ex. vid ekolokalisering ) och avföring/urin.
På grund av sin distinkta ekologi /beteende är fladdermöss naturligt mer mottagliga för virusinfektion och överföring. Flera fladdermusarter (t.ex. brunfladdermöss) samlas i trånga sovplatser, vilket främjar virusöverföring inom och mellan arter. Dessutom, eftersom fladdermöss är utbredd i stadsområden, inkräktar människor ibland på deras livsmiljöer som är förorenade med guano och urin. Deras förmåga att flyga och migrationsmönster gör också att fladdermöss kan sprida sjukdomar över ett stort geografiskt område, samtidigt som de får nya virus. Dessutom upplever fladdermöss ihållande virusinfektioner som tillsammans med sin extrema livslängd (vissa fladdermusarter har en livslängd på 35 år), hjälper till att upprätthålla virus och överföra dem till andra arter. Andra fladdermössegenskaper som bidrar till deras styrka som virala värdar inkluderar: deras matval, torpor / dvalevanor och mottaglighet för återinfektion.
Drivrutiner för viral uppkomst
Viral uppkomst är ofta en konsekvens av både naturen och mänsklig aktivitet . I synnerhet ekologiska förändringar i hög grad underlätta uppkomsten och återuppkomsten av zoonotiska virus. Faktorer som avskogning , återplantering av skog , fragmentering av livsmiljöer och bevattning kan alla påverka hur människor kommer i kontakt med vilda djurarter och följaktligen främja uppkomsten av virus. Dessutom klimatförändringar påverka ekosystem och vektorfördelning , vilket i sin tur kan påverka uppkomsten av vektorburna virus. Andra ekologiska förändringar - till exempel artintroduktion och förlust av rovdjur - kan också påverka virusuppkomst och prevalens. Vissa jordbruksmetoder , till exempel intensivering av boskap och olämplig hantering/bortskaffande av husdjursavföring, är också förknippade med en ökad risk för zoonos.
Virus kan också uppstå på grund av etableringen av mänskliga populationer som är sårbara för infektion. Till exempel kan ett virus uppstå efter förlust av korsskyddande immunitet , vilket kan uppstå på grund av förlust av ett vild virus eller avslutande av vaccinationsprogram . Välutvecklade länder har också högre andelar åldrande medborgare och fetmarelaterade sjukdomar , vilket betyder att deras befolkningar kan vara mer immunsupprimerade och därför löpa risk för infektion. Som kontrast kan fattigare länder ha immunförsvagade befolkningar på grund av undernäring eller kronisk infektion; Dessa länder kommer sannolikt inte heller att ha stabila vaccinationsprogram. Dessutom kan förändringar i mänsklig demografi – till exempel födseln och/eller migrationen av immunologiskt naiva individer – leda till utvecklingen av en mottaglig population som möjliggör storskalig virusinfektion.
Andra faktorer som kan främja viral uppkomst inkluderar globalisering ; i synnerhet internationell handel och mänskliga resor/ migrering kan leda till att virus introduceras i nya områden. Dessutom, eftersom tätbefolkade städer främjar snabb överföring av patogener, kan okontrollerad urbanisering (dvs. ökad rörelse och bosättning av individer i stadsområden ) främja viral uppkomst. Djurvandring kan också leda till uppkomsten av virus, vilket var fallet för West Nile-viruset som spreds av migrerande fågelpopulationer. Dessutom kan mänskliga metoder för livsmedelsproduktion och -konsumtion också bidra till risken för virusuppkomst. Särskilt våta marknader (dvs. marknader för levande djur) är en idealisk miljö för virusöverföring, på grund av den höga tätheten av människor och vilda/uppfödda djur som finns närvarande. Konsumtion av buskkött är också förknippat med patogenuppkomst.
Förebyggande
Kontroll och förebyggande av zoonotiska sjukdomar beror på lämplig global övervakning på olika nivåer, inklusive identifiering av nya patogener, folkhälsoövervakning (inklusive serologiska undersökningar ) och analys av riskerna för överföring. Komplexiteten hos zoonotiska händelser runt om i världen förutsätter en tvärvetenskaplig strategi för förebyggande. One Health Model har föreslagits som en global strategi för att förhindra uppkomsten av zoonotiska sjukdomar hos människor, inklusive nya virussjukdomar. One Health-konceptet syftar till att främja hälsan hos djur, människor och miljön, både lokalt och globalt, genom att främja förståelse och samarbete mellan utövare av olika sammanhängande discipliner, inklusive vilda biologi , veterinärvetenskap , medicin , jordbruk , ekologi , mikrobiologi , epidemiologi och biomedicinsk teknik .
Virulens hos nya virus
Eftersom värdar är immunologiskt naiva mot patogener som de inte har stött på tidigare, är emergenta virus ofta extremt virulenta när det gäller deras förmåga att orsaka sjukdom. Deras höga virulens beror också på bristande anpassning till den nya värden; virus utövar normalt ett starkt selektionstryck på immunsystemen hos sina naturliga värdar, vilket i sin tur utövar ett starkt selektionstryck på virus. Denna samevolution innebär att den naturliga värden kan hantera infektion. Men när viruset hoppar till en ny värd (t.ex. människor) kan den nya värden inte hantera infektion på grund av brist på samevolution, vilket resulterar i oöverensstämmelse mellan värdimmunoeffektorer och virusimmunmodulatorer . [ citat behövs ]
Dessutom, för att maximera överföringen, genomgår virus ofta naturligt attenuering (dvs. virulensen minskar) så att infekterade djur kan överleva tillräckligt länge för att infektera andra djur mer effektivt. Men eftersom dämpningen tar tid att uppnå kommer nya värdpopulationer initialt inte att dra nytta av detta fenomen. Dessutom, eftersom zoonotiska virus också naturligt finns i djurreservoarer , är deras överlevnad inte beroende av överföring mellan nya värdar; detta betyder att framväxande virus är ännu mer osannolikt att försvagas i syfte att uppnå maximal överföring, och de förblir virulenta. [ citat behövs ]
Även om framväxande virus ofta är mycket virulenta, begränsas de av flera värdfaktorer inklusive: medfödd immunitet , naturliga antikroppar och receptorspecificitet . Om värden tidigare har infekterats av en patogen som liknar det framträdande viruset, kan värden också dra nytta av korsskyddande immunitet . [ citat behövs ]
Exempel på nya virus
Influensa A
Influensa är en mycket smittsam luftvägsinfektion, som drabbar cirka 9 % av världens befolkning och orsakar 300 000 till 500 000 dödsfall årligen. Baserat på deras kärnproteiner klassificeras influensavirus i typerna A, B, C och D. Även om både influensa A och B kan orsaka epidemier hos människor, har influensa A också en pandemipotential och en högre mutationsfrekvens, och är därför mest betydelsefull för allmänheten hälsa.
Influensa A-virus klassificeras vidare i undertyper, baserat på kombinationerna av ytglykoproteinerna hemagglutinin ( HA) och neuraminidas (NA). Den primära naturliga reservoaren för de flesta subtyper av influensa A är vilda vattenlevande fåglar; Men genom en serie mutationer har en liten delmängd av dessa virus anpassats för infektion av människor (och andra djur). En nyckelfaktor för huruvida en viss subtyp av influensa A kan infektera människor är dess bindningsspecificitet. Aviär influensa A binder företrädesvis till cellytreceptorer med en terminal α2,3-kopplad sialinsyra , medan human influensa A preferentiellt binder till cellytereceptorer med en terminal α2,6-kopplad sialinsyra. Via mutation har vissa aviär influensa A-virus framgångsrikt ändrat sin bindningsspecificitet från α2,3- till α2,6-kopplad sialinsyra. Men för att uppstå hos människor måste fågelinfluensa A-virus också anpassa sina RNA-polymeraser för funktion i däggdjursceller, samt mutera för stabilitet i de sura luftvägarna hos människor.
Efter anpassning och värdbyte har influensa A-virus potential att orsaka epidemier och pandemier hos människor. Mindre förändringar i HA- och NA-strukturen ( antigendrift ) förekommer ofta, vilket gör att viruset kan orsaka upprepade utbrott (dvs. säsongsinfluensa ) genom att undvika immunigenkänning. Stora förändringar i HA- och NA-strukturen ( antigenskifte ), som orsakas av genetisk omsortering mellan olika subtyper av influensa A (t.ex. mellan subtyper av människa och djur), kan istället orsaka stora regionala/globala pandemier . På grund av uppkomsten av antigeniskt olika influensa A-stammar hos människor inträffade fyra pandemier bara under 1900-talet.
Dessutom, även om djurinfluensa A-virus (t.ex. svininfluensa ) skiljer sig från mänskliga influensavirus, kan de fortfarande orsaka zoonotisk infektion hos människor. Dessa infektioner förvärvas till stor del efter direktkontakt med infekterade djur eller kontaminerade miljöer, men resulterar inte i effektiv överföring från människa till människa; exempel på detta inkluderar H5N1-influensa och H7N9-influensa .
SARS-CoV
År 2002 uppstod en högpatogen SARS-CoV (Severe Acute Respiratory Syndrome Coronavirus) stam från en zoonotisk reservoar; cirka 8 000 människor smittades över hela världen, och dödligheten närmade sig 50 % eller mer hos äldre. Eftersom SARS-CoV är mest smittsam efter symtom, stoppade införandet av strikta folkhälsoåtgärder effektivt pandemin. Den naturliga reservoarvärden för SARS-CoV tros vara hästskofladdermöss , även om viruset också har identifierats hos flera små köttätare (t.ex. palmcivetter och mårdhundar ) . Uppkomsten av SARS-CoV tros ha underlättats av kinesiska våta marknader, där civets som var positiva för viruset fungerade som mellanvärdar och överförde SARS-CoV till människor (och andra arter). Men nyare analys tyder på att SARS-CoV kan ha hoppat direkt från fladdermöss till människor, med efterföljande korsöverföring mellan människor och civets.
För att infektera celler använder SARS-CoV spikeytglykoproteinet för att känna igen och binda till värd ACE-2, som den använder som en cellulär ingångsreceptor; utvecklingen av denna egenskap var avgörande för att göra det möjligt för SARS-CoV att "hoppa" från fladdermöss till andra arter.
MERS-CoV
Först rapporterades 2012, MERS-CoV (Middle East Respiratory Syndrome Coronavirus) markerar den andra kända introduktionen av ett högpatogent coronavirus från en zoonotisk reservoar till människor. Falldödligheten för detta framväxande virus är cirka 35 %, med 80 % av alla fall rapporterade av Saudiarabien. Även om MERS-CoV sannolikt har sitt ursprung i fladdermöss, dromedarkameler varit inblandade som troliga mellanvärdar. MERS-CoV tros ha cirkulerat i dessa däggdjur i över 20 år, och man tror att nya kameluppfödningsmetoder drev spridningen av MERS-CoV till människor. Studier har visat att människor kan infekteras med MERS-CoV via direkt eller indirekt kontakt inom infekterade dromedarkameler, medan överföring från människa till människa är begränsad.
MERS-CoV får cellulärt inträde genom att använda ett spikeytprotein för att binda till värdens DPP4 -ytreceptor; kärnsubdomänen för detta spikeytprotein delar likheter med SARS-CoV, men dess receptorbindande subdomän (RBSD) skiljer sig signifikant.
Bluetongue sjukdom

Bluetongue sjukdom är en icke-smittsam vektorburen sjukdom som orsakas av bluetonguevirus, som drabbar arter av idisslare (särskilt får ). Klimatförändringar har varit inblandade i uppkomsten och den globala spridningen av denna sjukdom, på grund av dess inverkan på vektorfördelningen. Den naturliga vektorn för blåtungaviruset är den afrikanska myggen C. imicola , som normalt är begränsad till Afrika och det subtropiska Asien. Den globala uppvärmningen har emellertid utökat det geografiska området för C. imicola , så att det nu överlappar med en annan vektor ( C. pulcaris eller C. obsoletus ) med ett mycket mer norrut geografiskt område. Denna förändring gjorde det möjligt för bluetongueviruset att hoppa vektor, vilket orsakade en spridning norrut av bluetonguesjukdomen till Europa.
Se även
- Biosäkerhet
- Ny infektionssjukdom
- Historik om nya infektionssjukdomar
- Biosäkerhet för laboratorier
- Viral kvasiart
Vidare läsning
- Artika IM, Ma'roef CN (maj 2017). "Laboratoriebiosäkerhet för hantering av nya virus" . Asian Pacific Journal of Tropical Biomedicine . 7 (5): 483–491. doi : 10.1016/j.apjtb.2017.01.020 . PMC 7103938 . PMID 32289025 .
externa länkar
- "Uppkommande virus" . MikrobiologiBytes . 2007. Arkiverad från originalet 2007-02-24.
- "Nationellt centrum för nya och zoonotiska infektionssjukdomar (NCEZID)" . 19 november 2021.