Klorovirus
| Klassificering av | |
|---|---|
| klorovirusvirus | |
| (orankad): | Virus |
| Rike : | Varidnaviria |
| Rike: | Bamfordvirae |
| Provins: | Nucleocytoviricota |
| Klass: | Megaviricetes |
| Beställa: | Algavirales |
| Familj: | Phycodnaviridae |
| Släkte: | Klorovirus |
Chlorovirus , även känt som Chlorella-virus, är ett släkte av gigantiska dubbelsträngade DNA-virus , i familjen Phycodnaviridae . Detta släkte finns globalt i sötvattensmiljöer där sötvattenmikroskopiska alger fungerar som naturliga värdar. Det finns 19 arter i detta släkte.
Klorovirus upptäcktes 1981 av Russel H. Meints, James L. Van Etten, Daniel Kuczmarski, Kit Lee och Barbara Ang medan de försökte odla Chlorella- liknande alger. Under den försökte processen upptäcktes viruspartiklar i cellerna 2 till 6 timmar efter att de initialt isolerats, följt av lysering efter 12 till 20 timmar. Detta virus kallades från början HVCV (Hydra viridis Chlorella-virus) eftersom det först visade sig infektera Chlorella-liknande alger.
Även om den är relativt ny för virologer och därför inte har studerats i stor omfattning, har en art, Chlorovirus ATCV-1 , som vanligtvis finns i sjöar, nyligen visat sig infektera människor. Nya studier som fokuserar på effekter av infektion i musmodeller dyker också upp för närvarande.
Taxonomi
Klorovirus är ett släkte av gigantiska dubbelsträngade DNA (dsDNA)-virus i familjen Phycodnaviridae och Baltimore grupp 1: dsDNA-virus . Släktet innehåller följande arter:
- Acanthocystis turfacea chlorella virus 1
- Hydra viridis Chlorella virus 1
- Paramecium bursaria Chlorella virus 1
- Paramecium bursaria Chlorella virus A1
- Paramecium bursaria Chlorella virus AL1A
- Paramecium bursaria Chlorella virus AL2A
- Paramecium bursaria Chlorella virus BJ2C
- Paramecium bursaria Chlorella virus CA4A
- Paramecium bursaria Chlorella virus CA4B
- Paramecium bursaria Chlorella virus IL3A
- Paramecium bursaria Chlorella virus NC1A
- Paramecium bursaria Chlorella virus NE8A
- Paramecium bursaria Chlorella virus NY2A
- Paramecium bursaria Chlorella virus NYs1
- Paramecium bursaria Chlorella virus SC1A
- Paramecium bursaria Chlorella virus XY6E
- Paramecium bursaria Chlorella virus XZ3A
- Paramecium bursaria Chlorella virus XZ4A
- Paramecium bursaria Chlorella virus XZ4C
Ekologi
Klorovirus är utbrett i sötvattensmiljöer i alla delar av världen och har isolerats från sötvattenkällor i Europa , Asien , Australien , samt Nord- och Sydamerika . Naturliga värdar av klorovirus inkluderar olika typer av encelliga eukaryota Chlorella -liknande alger, med individuella virusarter som vanligtvis endast infekterar inom en distinkt stam. Dessa algvärdar är kända för att etablera endosymbiotiska relationer med större protister, såsom Paramecium bursaria (en medlem av ciliates ), Acanthocystis turfacea (en centroheliozoan ) och Hydra viridis (medlem av hydrozoa ). Medan en enskild protist kan hysa upp till flera hundra algceller vid varje given tidpunkt, är fritt flytande alger mycket mottagliga för klorovirus, vilket indikerar att sådan endosymbios tjänar till att ge resistens mot infektion.
Klorovirustitrar varierar beroende på säsong och plats, men varierar vanligtvis mellan 1 och 100 PFU/mL, även om höga förekomster av upp till 100 000 PFU/mL kan förekomma i vissa miljöer. På grund av den rika genetiska mångfalden och höga specialisering hos enskilda arter med avseende på smittspridning, är variationer i deras ekologi inte ovanliga, vilket resulterar i unika rums-temporala mönster, som i slutändan beror på livsstilen och värdens natur. Som sådan framhävde tidigare undersökningsdata två framträdande säsongstoppar för både Chlorella variabilis NC64A- och Chlorella variabilis Syngen-virus - den ena på senhösten och den andra under sen vår till mitten av sommaren - vilket sannolikt tillskrivs det faktum att de delar en värdarter. Omvänt Chlorella heliozoae SAG-virus vid olika tidpunkter på året och uppvisade generellt mer variation i titrar, jämfört med NC64A- och Syngen-virus. Dessutom visade studier att klorovirus uppvisar en viss motståndskraft som svar på minskade temperaturer som observerats under vintersäsongen, kännetecknad av närvaron av smittsamma partiklar under islager i en damm för dagvattenhantering i Ontario, Kanada . Vidare beskriver DeLong et al. (2016) föreslår att predation av små kräftdjur kan spela en indirekt roll i titerfluktuationer, eftersom nedbrytning av protistceller som passerar genom matsmältningskanalen resulterar i frigörande av ett stort antal encelliga alger som blir mottagliga för virusinfektion på grund av störningar av endosymbios. Sammantaget beror säsongsbetonad förekomst av klorovirus inte bara på värdarten, utan också på förekomsten av andra mikroorganismer, allmän näringsstatus och ekologiska förhållanden.
Tillsammans kan klorovirus förmedla globala biogeokemiska cykler genom omsättning av växtplankton . Chlorella , i samtidig förekomst med andra typer av mikroskopiska alger som Microcystis aeruginosa , är kända för att orsaka giftiga algblomningar som vanligtvis varar från februari till juni på norra halvklotet, vilket resulterar i syrebrist och dödsfall av större organismer i sötvattensmiljöer. Lytisk infektion av encelliga alger av klorovirus resulterar i att algblomningen upphör och efterföljande frigöring av kol, kväve och fosfor som fångas i cellerna, transporterar dem till lägre trofiska nivåer och, i slutändan, bränsle till näringskedjan.
Strukturera
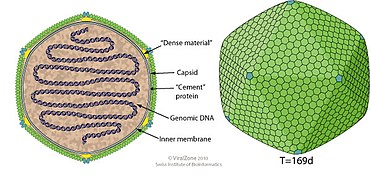
Virus i släktet Chlorovirus är omslutna, med icosaedriska och sfäriska geometrier och T=169 ( trianguleringsnummer ) symmetri. Diametern är cirka 100-220 nm. Genomerna är linjära, vanligtvis enkelkopia, sammansatta av dsDNA (dubbelsträngat DNA) och cirka 330 kb långa. dsDNA stängs med en hårnålsstrukturterminal. Genomer har också ofta flera hundra öppna läsramar . Som en grupp kodar klorovirus från 632 proteinfamiljer; dock har varje enskilt virus endast 330 till 416 proteinkodande gener. Som en del av DNA-modifieringssystemen har klorovirus metylerade baser i specifika delar av sin DNA-sekvens. Vissa klorovirus innehåller också introner och inteiner , även om detta är sällsynt inom släktet.
Paramecium bursaria Chlorella virus 1 (PBCV-1) har en diameter på 190 nm och en femfaldig axel. Det ena ansiktet har en utstickande spik, vilket är den första delen av viruset som kommer i kontakt med sin värd. Den yttre kapsiden täcker ett enkel lipiddubbelskiktsmembran, som erhålls från värdens endoplasmatiska retikulum . Vissa kapsomerer på det yttre skalet har fibrer som sträcker sig bort från viruset för att hjälpa till med värdfästningen.
| Släkte | Strukturera | Symmetri | Capsid | Genomiskt arrangemang | Genomisk segmentering |
|---|---|---|---|---|---|
| Klorovirus | Icosahedral | T=169 | Kuvert | Linjär | Endelad |
Värdar
Klorovirus infekterar vissa encelliga, eukaryota chlorellaliknande grönalger, kallade zoochlorellae , och är mycket art- och till och med stamspecifika. Dessa zoochlorellae etablerar vanligen endosymbiotiska relationer med protozoen Paramecium bursaria , coelenteraten Hydra viridis , heliozoon Acanthocystis turfacea och andra sötvattens- och marina ryggradslösa djur och protozoer. Virusen kan inte infektera zoochlorellae när de är i sin symbiotiska fas, och det finns inga bevis för att zoochlorellae växer fria från sina värdar i inhemska vatten. Klorovirus har också nyligen visat sig infektera människor, vilket leder till studier på infektioner även hos möss.
Livscykel

Viral replikation är nukleo-cytoplasmatisk. Replikation följer DNA-strängförskjutningsmodellen , och DNA-mallrad transkription är metoden för transkription. Viruset lämnar värdcellen genom lysering via lytiska fosfolipider, med passiv diffusion som mekanismen bakom överföringsvägar. [ citat behövs ]
I tredimensionella återskapanden av PBCV-1 ser man att spiken först kommer i kontakt med värdens cellvägg och får hjälp av fibrer för att säkra viruset till värden. Bindningen av PBCV-1 till dess receptor är mycket specifik och en stor källa till begränsningar med avseende på virusvärdens intervall. Virusassocierade enzymer tillåter värdcellväggen att brytas ned, och det virala inre membranet smälter samman med värdmembranet. Denna fusion möjliggör överföring av viralt DNA och virionassocierade proteiner till värdcellen och utlöser även depolarisering av värdmembranet. Detta inträffar förmodligen på grund av en viruskodad K+-kanal . Studier förutspår att denna kanal finns i viruset och fungerar som ett inre membran som frisätter K+ från cellen, vilket kan hjälpa till med utstötningen av viralt DNA och proteiner från den virala cellen till dess värd. Depolariseringen av värdens cellmembran tros också förhindra sekundär infektion från ett annat virus eller sekundära transportörer.
Eftersom PBCV-1 inte har en RNA-polymerasgen , flyttar dess DNA och virusassocierade proteiner till kärnan där transkriptionen börjar 5–10 minuter efter infektion. Denna snabba transkription tillskrivs någon komponent som underlättar denna överföring eller viralt DNA till kärnan. Denna komponent antas vara en produkt av PBCV-a443r- genen, som erhåller strukturer som liknar proteiner involverade i nukleär handel med däggdjursceller.
Värdens transkriptionshastigheter minskar i denna tidiga fas av infektion, och värdtranskriptionsfacilitatorer omprogrammeras för att transkribera det nya virala DNA:t. Minuter efter infektion börjar värdens kromosomala DNA-nedbrytning. Detta antas ske genom PBCV-1-kodade och paketerade DNA- restriktionsendonukleaser . Nedbrytning av värdens kromosomala DNA hämmar värdtranskription. Detta resulterar i att 33-55 % av de polyadenylerade mRNA:erna i den infekterade cellen är av viralt ursprung 20 minuter efter initial infektion.
Viral DNA-replikation initieras efter 60 till 90 minuter, som sedan följs av transkription av sena gener i värdcellen. Ungefär 2–3 timmar efter infektion börjar sammansättningen av viruskapsider. Detta inträffar inom lokaliserade regioner av cytoplasman, där viruskapsiderna blir framträdande 3–4 timmar efter initial infektion. 5–6 timmar efter PBCV-1-infektion fylls värdcellens cytoplasma med infektiösa avkommaviruspartiklar. Kort därefter (6–8 timmar efter infektion) frisätter lokal lysis av värdcellen avkomma. ~1000 partiklar frigörs från varje infekterad cell, varav ~30% bildar plack .
Effekter av infektion
Hos alger infekterade med Clorovirus blir resultatet lysis och därmed död. Som sådana är klorovirus en viktig mekanism för att avsluta algblomningen och spelar en viktig roll i tillförseln av näringsämnen till vattenpelaren ( se avsnittet Ekologi för mer information) . Klorovirus kan också ändra väggstrukturen hos infekterade celler. Vissa klorovirus innehåller chitinsyntas -gener (CHS) medan andra innehåller hyaluronansyntas- gener (HAS), som utlöser bildningen av kitinkänsliga fibrer respektive hyaluronankänsliga fibrer. Även om funktionen för att producera en fibrös matta inte är definitivt känd, antas det att fibrerna kan: hindra upptaget av den infekterade cellen av symbiotiska protozoer, som orsakar nedbrytningen av den lyserade cellen; infektera en annan värd som tar upp de fibertäckta algerna; eller gå med andra infekterade och fibertäckta celler. Förmågan att koda för enzymer som utlöser syntesen av hyaluronan (hyaluronsyra) finns i inga andra virus.
Nyligen har klorovirus ATCV-1 DNA hittats i humana orofaryngeala prover. Innan detta var det inte känt att klorovirus kunde infektera människor, så det finns begränsad kunskap om infektioner hos människor. Människor som visade sig vara smittade hade försenat minne och minskad uppmärksamhet. Människor som befunnits vara infekterade med ATCV-1 visade en minskad visuell bearbetningsförmåga och minskad visuell motorhastighet. Detta ledde till en övergripande nedgång i förmågan att utföra uppgifter baserade på vision och rumsliga resonemang.
Studier som infekterar möss med ACTV-1 har utförts efter upptäckten att klorovirus kan infektera människor. Studierna som utförts på infekterade möss visar förändringar i Cdk5-vägen , vilket hjälper till med inlärning och minnesbildning, samt förändringar i genuttrycket i dopaminvägen . Vidare visade sig infekterade möss vara mindre sociala och interagera mindre med nyligen introducerade sällskapsmöss än kontrollgruppen. Infekterade möss tillbringade också längre tid i en ljusexponerad del av en testkammare, där kontrollmössen tenderade att föredra den mörka sidan och undvek ljuset. Detta indikerar en minskning av ångest med ACTV-1-infektion. Testmössen kunde också sämre känna igen ett objekt som hade flyttats från sin tidigare plats, vilket visade en minskning av det rumsliga referensminnet. Liksom hos människor finns det en minskning av synens rumsliga uppgiftsförmåga. Inom hippocampus (hjärnområdet som är ansvarigt för minne och inlärning) inträffar förändringar i genuttryck, och infektion ger en förändring i vägarna för immuncellers funktion och antigenbearbetning . Det har föreslagits att detta möjligen indikerar ett immunsystemsvar på ACTV-1-viruset som orsakar inflammation som kan vara orsaken till de kognitiva försämringarna. Symtomen som presenteras kan också tyda på hippocampus och mediala prefrontala cortexinterferens från ACTV-1-infektion.
Evolution
Klorovirus, såväl som de återstående medlemmarna av familjen Phycodnaviridae, anses vara en del av den bredare gruppen av mikrober som kallas nukleocytoplasmatiska stora DNA-virus (NCLDV). Även om phycodnavirus är genetiskt olika och infekterar olika värdar, uppvisar de höga nivåer av likhet på strukturell nivå med varandra och andra NCLDVs. Fylogenetisk analys av huvudkapsidproteinet inom gruppen indikerar stor sannolikhet för nära släktskap, såväl som tidigare avvikelser från en enda gemensam förfader, som tros vara ett litet DNA-virus. Dessutom tyder studier på att genomgigantism, karakteristisk för alla klorovirus, är en egenskap som utvecklades tidigt i historien om NCLDV, och efterföljande anpassningar till respektive värdar och särskilda livsmiljöer resulterade i mutationer och genförlusthändelser, som i slutändan formade alla för närvarande existerande klorovirus arter.
Genomsekvensering och funktionell screening av proteiner från PBCV-1 och ATCV-1 avslöjade ett stort antal horisontellt överförda gener , vilket indikerar en lång historia av samevolution med den encelliga värden och lateral genöverföring med andra till synes orelaterade organismer. Vidare visade sig båda virusen koda för flera så kallade "progenitor-enzymer", som är mindre, men mindre specialiserade än deras moderna analoger. Till exempel visades ett av de sockermanipulerande enzymerna i PBCV-1 ( GDP-d-mannose 4,6-dehydratas eller GMD ) mediera katalys av inte bara uttorkningen av GDP-d-mannos , utan också minskning av sockret molekyl som produceras i den initialt förutsagda processen. Sådan dubbel funktionalitet är ovanlig bland de för närvarande existerande sockermanipulerande enzymerna, och antyder möjligen den urgamla naturen hos PBCV-1 GMD.
Infektionscykelstudier i PBCV-1 visade att viruset är beroende av en unik kapsidglykosyleringsprocess oberoende av värdens ER- eller Golgi -maskineri. Denna egenskap har ännu inte observerats i något annat virus som för närvarande är känt för vetenskapen och representerar potentiellt en uråldrig och bevarad väg, som kunde ha utvecklats före eukaryogenesen , som uppskattades inträffa för cirka 2,0-2,7 miljarder år sedan.
Nya upptäckter angående närvaro av DNA-sekvenser homologa med ATCV-1 i det humana orofaryngeala viromet, såväl som de efterföljande studierna som visar framgångsrik infektion av däggdjursmodeller med ATCV-1, pekar också på sannolikheten för forntida evolutionär historia av klorovirus, som besitter strukturella egenskaper och använder molekylära mekanismer som potentiellt möjliggör replikering inom olika djurvärdar.