Yersinia pestis
|
|
| Yersinia pestis | |
|---|---|
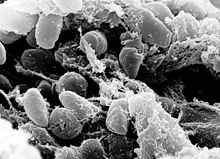
| En svepelektronmikrofotografi som visar en massa Yersinia pestis -bakterier i förtarmen på en infekterad loppa Vetenskaplig | |
| klassificering | |
| Domän: | Bakterie |
| Provins: | Pseudomonadota |
| Klass: | Gammaproteobakterier |
| Beställa: | Enterobacterales |
| Familj: | Yersiniaceae |
| Släkte: | Yersinia |
| Arter: |
Y. pestis
|
| Binomialt namn | |
|
Yersinia pestis (Lehmann & Neumann, 1896) van Loghem, 1944 |
|
| Synonymer | |
|
|
Yersinia pestis ( Y. pestis ; tidigare Pasteurella pestis ) är en gramnegativ , icke-rörlig , coccobacillus - bakterie utan sporer som är släkt med både Yersinia pseudotuberculosis och Yersinia enterocolitica . Det är en fakultativ anaerob organism som kan infektera människor via den orientaliska råttloppan ( Xenopsylla cheopis ) . Det orsakar sjukdomen pest , som orsakade den första pestpandemin och digerdöden , den dödligaste pandemin i historien. Pest har tre huvudsakliga former: pneumonisk , septikemisk och böld . Yersinia pestis är en parasit av sin värd, råttloppan , som också är en parasit hos råttor, därför är Y. pestis en hyperparasit .
Y. pestis upptäcktes 1894 av Alexandre Yersin , en schweizisk/fransk läkare och bakteriolog från Pasteur Institute , under en pestepidemi i Hong Kong . Yersin var medlem av Pasteurs tankeskola. Kitasato Shibasaburō , en japansk bakteriolog som praktiserade Kochs metodik , var också vid den tiden engagerad i att hitta orsaken till pesten. Emellertid kopplade Yersin faktiskt ihop pesten med en bacill, som ursprungligen hette Pasteurella pestis ; det döptes om till Yersinia pestis 1944.
Varje år rapporteras fortfarande mellan tusen och två tusen fall av pesten till Världshälsoorganisationen . Med korrekt antibiotikabehandling är prognosen för offren mycket bättre än innan antibiotika utvecklades . En fem- till sexfaldig ökning av fall inträffade i Asien under tiden för Vietnamkriget , möjligen på grund av störningar av ekosystem och närmare närhet mellan människor och djur. Pesten är nu vanligt förekommande i Afrika söder om Sahara och Madagaskar, områden som nu står för över 95 % av de rapporterade fallen. Pesten har också en skadlig effekt på icke-mänskliga däggdjur; i USA inkluderar dessa den svartsvansade präriehunden och den utrotningshotade svartfotade illern .
Allmänna funktioner
Y. pestis är en icke-rörlig coccobacillus , en fakultativ anaerob bakterie med bipolär färgning (som ger den ett säkerhetsnålsutseende ) som producerar ett antifagocytiskt slemlager. I likhet med andra Yersinia- arter testar den negativt för ureas , laktosfermentering och indol . Dess närmaste släktingar är den gastrointestinala patogenen Yersinia pseudotuberculosis och, mer avlägset, Yersinia enterocolitica . [ citat behövs ]
Genom och proteom
Genom
Flera kompletta genomsekvenser finns tillgängliga för olika stammar och underarter av Y. pestis : stam KIM (av biovar Y. p. medievalis ) och stam CO92 (av biovar Y. p. orientalis , erhållen från ett kliniskt isolat i USA) . 2006 färdigställdes genomsekvensen för en stam av biovar Antiqua . Vissa stammar är icke-patogena, såsom stam 91001 , vars sekvens publicerades 2004.
| KIM | CO92 | 91001 | |
|---|---|---|---|
| längd (bp) | 4 600 755 | 4,653,728 | 4,595,065 |
| proteiner som kodas | 4,198 | 4 012 | 4 037 |
| pseudogener | 54 | 149 | 141 |
| tRNA | 73 | 70 | 72 |
Plasmider
Liksom Y. pseudotuberculosis och Y. enterocolitica är Y. pestis värd för plasmiden pCDl . Den är också värd för två andra plasmider, pPCP1 (även kallad pPla eller pPst) och pMT1 (även kallad pFra) som inte bärs av de andra Yersinia- arterna. pFra kodar för ett fosfolipas D som är viktigt för Y. pestis förmåga att överföras av loppor. pPla kodar för ett proteas , Pla, som aktiverar plasmin i mänskliga värdar och är en mycket viktig virulensfaktor för pneumonisk pest. Tillsammans kodar dessa plasmider, och en patogenisk ö som kallas HPI, för flera proteiner som orsakar patogenesen som Y. pestis är känd för. Dessa virulensfaktorer krävs bland annat för bakteriell vidhäftning och injektion av proteiner i värdcellen, invasion av bakterier i värdcellen (via ett typ III-utsöndringssystem ) och förvärv och bindning av järn som skördats från röda blodkroppar ( av sideroforer ). Y. pestis tros härstamma från Y. pseudotuberculosis och skiljer sig endast i närvaro av specifika virulensplasmider. [ citat behövs ]
Proteom
En omfattande och jämförande proteomikanalys av Y. pestis -stam KIM utfördes 2006. Analysen fokuserade på övergången till ett tillväxttillstånd som efterliknar tillväxt i värdceller. [ citat behövs ]
Litet icke-kodande RNA
Många bakteriella små icke-kodande RNA har identifierats för att spela regulatoriska funktioner. Vissa kan reglera virulensgenerna. Några 63 nya förmodade sRNA identifierades genom djup sekvensering av Y. pestis sRNA-om. Bland dem var Yersinia -specifik (även närvarande i Y. pseudotuberculosis och Y. enterocolitica ) Ysr141 ( Yersinia small RNA 141). Ysr141 sRNA visades reglera syntesen av effektorproteinet YopJ av typ III sekretionssystem (T3SS). Yop-Ysc T3SS är en kritisk komponent av virulens för Yersinia -arter. Många nya sRNA identifierades från Y. pestis odlad in vitro och i de infekterade lungorna hos möss, vilket tyder på att de spelar roll i bakteriell fysiologi eller patogenes. Bland dem sR035 att paras ihop med SD-regionen och transkriptionsinitieringsstället för en värmekänslig regulator ymoA, och sR084 förutspådde att paras med päls , järnupptagsregulator .
Patogenes och immunitet

I de urbana och sylvatiska (skogs-) cyklerna av Y. pestis sker det mesta av spridningen mellan gnagare och loppor. I den sylvatiska cykeln är gnagaren vild, men i stadscykeln är gnagaren i första hand brunråttan ( Rattus norvegicus ) . Dessutom Y. pestis spridas från stadsmiljön och tillbaka. Överföring till människor sker vanligtvis genom bett av infekterade loppor. Om sjukdomen har utvecklats till lungform kan människor sprida bakterien till andra genom hosta, kräkningar och eventuellt nysningar. [ citat behövs ]
Däggdjur som värdar
Flera arter av gnagare fungerar som huvudreservoar för Y. pestis i miljön. I stäpperna tros den naturliga reservoaren huvudsakligen vara murmeldjuren . I västra USA tros flera arter av gnagare bibehålla Y. pestis . Den förväntade sjukdomsdynamiken har dock inte hittats hos någon gnagare. Flera arter av gnagare är kända för att ha ett varierande motstånd, vilket kan leda till en asymtomatisk bärarstatus . Bevis tyder på att loppor från andra däggdjur har en roll i utbrott av mänsklig pest.
Bristen på kunskap om dynamiken hos pesten hos däggdjursarter gäller även bland mottagliga gnagare som präriehunden med svartsvans ( Cynomys ludovicianus ) , där pesten kan orsaka kolonikollaps, vilket resulterar i en massiv effekt på präriens näringsnät. Transmissionsdynamiken hos präriehundar följer dock inte dynamiken hos blockerade loppor; kadaver, oblockerade loppor eller annan vektor kan möjligen vara viktig istället.
CO92-stammen isolerades från en patient som dog av lunginflammation och som fick infektionen från en infekterad katt .
I andra regioner i världen är reservoaren för infektionen inte tydligt identifierad, vilket komplicerar förebyggande och tidiga varningsprogram. Ett sådant exempel sågs i ett utbrott 2003 i Algeriet .
Loppor som vektor
Överföringen av Y. pestis av loppor är väl karakteriserad. Initialt förvärv av Y. pestis av vektorn sker under utfodring av ett infekterat djur. Flera proteiner bidrar sedan till underhållet av bakterierna i loppens matsmältningskanal, bland dem heminlagringssystemet och Yersinia murint toxin (Ymt). Även om Ymt är mycket giftigt för gnagare och en gång troddes vara producerat för att säkerställa återinfektion av nya värdar, är det väsentligt för kolonisering av loppor och för överlevnaden av Y. pestis i loppor.
Heminlagringssystemet spelar en viktig roll i överföringen av Y. pestis tillbaka till en däggdjursvärd. Medan de finns i insektsvektorn, inducerar proteiner som kodas av heminlagringssystemets genetiska loci biofilmbildning i proventriculus , en ventil som förbinder mellantarmen med matstrupen . Närvaron av denna biofilm verkar sannolikt krävas för stabil infektion av loppan. Aggregation i biofilmen hämmar utfodring, eftersom en massa av koagulerat blod och bakterier bildas (kallas "Bacots block" efter entomologen AW Bacot , den första som beskrev detta fenomen). Överföring av Y. pestis sker under loppans meningslösa försök att föda. Intaget blod pumpas in i matstrupen, där det avlägsnar bakterier som sitter fast i proventriculus, som återuppstår i värdens cirkulationssystem.
Hos människor och andra mottagliga värdar
Patogenes på grund av Y. pestis -infektion hos däggdjursvärdar beror på flera faktorer, inklusive en förmåga hos dessa bakterier att undertrycka och undvika normala immunsystemsvar såsom fagocytos och antikroppsproduktion . Loppbett gör att bakterierna kan passera hudbarriären. Y. pestis uttrycker en plasminaktivator som är en viktig virulensfaktor för pneumonisk pest och som kan brytas ned på blodproppar för att underlätta systematisk invasion. Många av bakteriernas virulensfaktorer är antifagocytiska till sin natur. Två viktiga antifagocytiska antigener , benämnda F1 (fraktion 1) och V eller LcrV , är båda viktiga för virulens . Dessa antigener produceras av bakterien vid normal mänsklig kroppstemperatur. Dessutom Y. pestis och producerar F1- och V-antigener medan den finns i vita blodkroppar som monocyter , men inte i neutrofiler . Naturlig eller inducerad immunitet uppnås genom produktion av specifika opsoniska antikroppar mot F1- och V-antigener; antikroppar mot F1 och V inducerar fagocytos av neutrofiler.
Dessutom tillåter typ III-sekretionssystemet (T3SS) Y. pestis att injicera proteiner i makrofager och andra immunceller. Dessa T3SS-injicerade proteiner, kallade Yersinia yttre proteiner (Yops), inkluderar Yop B/D, som bildar porer i värdcellsmembranet och har kopplats till cytolys . YopO, YopH , YopM, YopT, YopJ och YopE injiceras i värdcellers cytoplasma av T3SS i poren som delvis skapas av YopB och YopD. De injicerade Yops begränsar fagocytos och cellsignaleringsvägar som är viktiga i det medfödda immunsystemet, som diskuteras nedan. Dessutom kan vissa Y. pestis -stammar störa immunsignalering (t.ex. genom att förhindra frisättning av vissa cytokiner ). [ citat behövs ]
Y. pestis förökar sig inuti lymfkörtlarna , där den kan undvika förstörelse av celler i immunsystemet, såsom makrofager . Y. pestis förmåga att hämma fagocytos gör att den växer i lymfkörtlar och orsakar lymfadenopati . YopH är ett proteintyrosinfosfatas som bidrar till Y. pestis förmåga att undvika immunsystemets celler. I makrofager har YopH visats defosforylera p130Cas , Fyb ( FYN- bindande protein) SKAP-HOM och Pyk , ett tyrosinkinas homologt med FAK . YopH binder också p85-subenheten av fosfoinositid 3-kinas , Gab1 , Gab2 - adapterproteinerna och Vav- guanin-nukleotidutbytesfaktorn . [ citat behövs ]
YopE fungerar som ett GTPase-aktiverande protein för medlemmar av Rho-familjen av GTPaser såsom RAC1 . YopT är ett cysteinproteas som hämmar RhoA genom att ta bort isoprenylgruppen , vilket är viktigt för att lokalisera proteinet till cellmembranet . YopE och YopT har föreslagits att fungera för att begränsa YopB/D-inducerad cytolys. Detta kan begränsa funktionen av YopB/D för att skapa porerna som används för Yop-insättning i värdceller och förhindra YopB/D-inducerad brott av värdceller och frisättning av cellinnehåll som skulle attrahera och stimulera immunsystemsvar. [ citat behövs ]
YopJ är ett acetyltransferas som binder till en konserverad α-helix av MAPK-kinaser . YopJ acetylerar MAPK-kinaser vid seriner och treoniner som normalt fosforyleras under aktivering av MAP-kinaskaskaden . YopJ aktiveras i eukaryota celler genom interaktion med målcellsfytinsyra ( IP6) . Denna störning av värdcellproteinkinasaktivitet orsakar apoptos av makrofager, och detta föreslås vara viktigt för etablering av infektion och för undvikande av värdens immunsvar. YopO är ett proteinkinas även känt som Yersinia proteinkinas A (YpkA). YopO är en potent inducerare av human makrofagapoptos.
Det har också föreslagits att en bakteriofag – Ypφ – kan ha varit ansvarig för att öka virulensen hos denna organism.
Beroende på vilken form av pesten som infekterar individen, utvecklar pesten en annan sjukdom; dock påverkar pesten totalt sett värdcellens förmåga att kommunicera med immunsystemet, vilket hindrar kroppen från att föra fagocytiska celler till infektionsområdet.
Y. pestis är en mångsidig mördare. Förutom gnagare och människor är det känt att ha dödat kameler, höns och grisar. Tamhundar och katter är också mottagliga för pest, men katter är mer benägna att utveckla sjukdomar när de blir smittade. I båda liknar symtomen de som upplevs av människor och kan vara dödliga för djuret. Människor kan exponeras genom att komma i kontakt med ett infekterat djur (dött eller levande), eller andas in smittsamma droppar som en sjuk hund eller katt har hostat upp i luften.
Immunitet
Ett formalin -inaktiverat vaccin fanns tillgängligt i USA för vuxna 1993 med hög risk att drabbas av pesten tills det avlägsnades från marknaden av Food and Drug Administration . Det var av begränsad effektivitet och kunde orsaka allvarlig inflammation . Experiment med genteknik av ett vaccin baserat på F1- och V-antigener pågår och visar lovande. Bakterier som saknar antigen F1 är emellertid fortfarande virulenta och V-antigenerna är tillräckligt variabla så att vacciner sammansatta av dessa antigener kanske inte är helt skyddande. United States Army Medical Research Institute of Infectious Diseases har funnit att ett experimentellt F1/V-antigenbaserat vaccin skyddar krabbätande makaker, men misslyckas med att skydda afrikanska gröna apor . En systematisk granskning av Cochrane Collaboration fann inga studier av tillräcklig kvalitet för att göra något uttalande om vaccinets effektivitet.
Isolering och identifiering

År 1894 isolerade två bakteriologer, Alexandre Yersin från Schweiz och Kitasato Shibasaburō från Japan, oberoende i Hong Kong bakterien som var ansvarig för 1894 års Hong Kong-pest . Även om båda utredarna rapporterade sina fynd, ledde en rad förvirrande och motsägelsefulla uttalanden från Kitasato till slut till att Yersin accepterades som den primära upptäckaren av organismen. Yersin döpte den till Pasteurella pestis för att hedra Pasteur Institute , där han arbetade. 1967 flyttades den till ett nytt släkte och döptes om till Yersinia pestis till hans ära. Yersin noterade också att råttor drabbades av pest inte bara under pestepidemier, utan också ofta före sådana epidemier hos människor och att pesten av många lokalbefolkningen betraktades som en råttsjukdom; bybor i Kina och Indien hävdade att när ett stort antal råttor hittades döda följde pestutbrott snart. [ citat behövs ]
År 1898 upptäckte den franske vetenskapsmannen Paul-Louis Simond (som också hade kommit till Kina för att bekämpa den tredje pandemin) rått-loppvektorn som driver sjukdomen. Han hade noterat att personer som blev sjuka inte behövde vara i nära kontakt med varandra för att få sjukdomen. I Yunnan , Kina, skulle invånarna fly från sina hem så snart de såg döda råttor, och på ön Formosa ( Taiwan ) ansåg invånarna att hanteringen av döda råttor ökade riskerna för att utveckla pest. Dessa observationer fick honom att misstänka att loppan kan vara en mellanliggande faktor i överföringen av pest, eftersom människor fick pest endast om de var i kontakt med råttor som hade dött mindre än 24 timmar tidigare. I ett nu klassiskt experiment visade Simond hur en frisk råtta dog av pesten efter att infekterade loppor hade hoppat till den från en råtta som nyligen dött av pesten. Utbrottet spred sig till Chinatown, San Francisco, från 1900 till 1904 och sedan till Oakland och East Bay från 1907 till 1909. Det har funnits i gnagarna i västra Nordamerika sedan dess, som rädsla för konsekvenserna av utbrottet på handeln fick myndigheterna att gömma de döda från Chinatown-invånarna tillräckligt länge för att sjukdomen skulle kunna överföras till utbredda arter av inhemska gnagare i ytterområden.
Tre huvudstammar känns igen: Y. p. antiqua , som orsakade en pestpandemi på 500-talet; Y P. medievalis , som orsakade digerdöden och efterföljande epidemier under den andra pandemivågen; och Y.p. orientalis , som är ansvarig för aktuella pestutbrott.
2000-talet
Den 15 januari 2018 föreslog forskare vid universitetet i Oslo och universitetet i Ferrara att människor och deras parasiter (mest troligt loppor och löss på den tiden) var de största bärarna av pesten.
Forntida DNA-bevis
År 2010 fastställde forskare i Tyskland definitivt, med hjälp av PCR-bevis från prover som erhållits från offer för digerdöden, att Y. pestis var orsaken till den medeltida digerdöden .
publicerades det första genomet av Y. pestis som isolerats från svarta dödens offer, och drog slutsatsen att denna medeltida stam var ursprunglig till de flesta moderna former av Y. pestis .
2015 publicerade Cell resultat från en studie av forntida gravar. Plasmider av Y. pestis upptäcktes i arkeologiska prover av tänder från sju bronsåldersindivider, i Afanasievo -kulturen i Sibirien, Corded Ware-kulturen i Estland, Sintashta-kulturen i Ryssland, Unetice-kulturen i Polen och Andronovo-kulturen i Sibirien. Under 2018 publicerades patogenens uppkomst och spridning under den neolitiska nedgången (så långt tillbaka som för 6 000 år sedan). En plats i Sverige var källan till DNA-bevisen och handelsnätverk föreslogs som den troliga vägen för spridning snarare än migration av populationer. Det finns bevis som tyder på att Y. pestis kan ha sitt ursprung i Europa i Cucuteni-Trypillia-kulturen , inte i Asien som man ofta tror.
DNA-bevis som publicerades 2015 tyder på att Y. pestis infekterade människor för 5 000 år sedan i bronsålderns Eurasien, men genetiska förändringar som gjorde det mycket virulent inträffade inte förrän för cirka 4 000 år sedan. Den mycket virulenta versionen som kan överföras av loppor genom gnagare, människor och andra däggdjur hittades i två individer associerade med Srubnaya- kulturen från Samara-regionen i Ryssland för omkring 3 800 år sedan och en järnåldersindivid från Kapan , Armenien, från ca. 2 900 år sedan. Detta tyder på att minst två linjer av Y. pestis cirkulerade under bronsåldern i Eurasien. Y. pestis -bakterien har ett relativt stort antal icke-fungerande gener och tre "ojämna" plasmider, vilket tyder på ett ursprung för mindre än 20 000 år sedan.
Den 8 september 2016 identifierades Y. pestis -bakterien från DNA i tänder som hittats på en Crossrail- byggplats i London . De mänskliga kvarlevorna visade sig vara offer för den stora pesten i London, som varade från 1665 till 1666.
År 2021 hittade forskare ett 5 000 år gammalt offer för Y. pestis , världens äldsta kända, i jägare- och samlarlämningar i det moderna lettiska och estniska gränsområdet.
evenemang
496 rapporterades i USA mellan 1970 och 2020. Fall har hittats främst i New Mexico, Arizona, Colorado, Kalifornien, Oregon och Nevada.
År 2008 var pest vanligt förekommande i Afrika söder om Sahara och Madagaskar, områden som stod för över 95 % av de rapporterade fallen.
kopplades döden av Malcolm Casadaban , professor i molekylär genetik vid University of Chicago , till hans arbete med en försvagad laboratoriestam av Y. pestis . Hemokromatos antogs vara en predisponerande faktor för Casadabans död från denna försvagade stam som används för forskning.
Den 3 november 2019 diagnostiserades två fall av lungpest på ett sjukhus i Pekings Chaoyang -distrikt, vilket ledde till rädsla för ett utbrott. Patienten var en medelålders man med feber, som hade klagat över andningssvårigheter i ett tiotal dagar, åtföljd av sin fru med liknande symtom. Polisen satte akutmottagningen i karantän på sjukhuset och kontroller placerades på kinesiska nyhetsinsamlare. Den 18 november rapporterades ett tredje fall, i en 55-årig man från Xilingol League , en av de tolv mongoliska autonoma regionerna i norra Kina. Patienten fick behandling och 28 symtomfria kontakter sattes i karantän.
I juli 2020 ökade tjänstemännen försiktighetsåtgärderna efter att ett fall av böldpest bekräftats i Bayannur , en stad i Kinas autonoma region Inre Mongoliet . Patienten sattes i karantän och behandlades. Enligt Kinas Global Times utreddes också ett andra misstänkt fall, och en nivå 3-varning utfärdades, i kraft fram till slutet av året. Den förbjöd jakt och ätning av djur som kunde bära pest, och uppmanade allmänheten att rapportera misstänkta fall.
externa länkar
- En lista över variantstammar och information om synonymer (och mycket mer) är tillgänglig via NCBI taxonomy browser .
- CDC:s hemsida för Plague
- IDSA:s resurssida om Plague : Aktuell, omfattande information om patogenes, mikrobiologi, epidemiologi, diagnos och behandling
- Pest (Yersinia Pestis)
- Wyndham Lathem talar om "From Mild to Murderous: How Yersinia pestis Evolved to Cause Pneumonic Pest."