Aluminiumhydrid

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
Aluminiumhydrid |
|
|
Systematiskt IUPAC-namn
Alumane |
|
| Andra namn Alane
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.139 |
| 245 | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| AlH 3 | |
| Molar massa | 29,99 g/mol |
| Utseende | vita kristallina fasta, icke-flyktiga, högpolymeriserade, nålliknande kristaller |
| Densitet | 1,477 g/cm3 , fast |
| Smältpunkt | 150 °C (302 °F; 423 K) börjar sönderdelas vid 105 °C (221 °F) |
| reagerar | |
| Löslighet | löslig i eter reagerar i etanol |
| Termokemi | |
|
Värmekapacitet ( C )
|
40,2 J/mol K |
|
Std molär entropi ( S ⦵ 298 ) |
30 J/mol K |
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
-11,4 kJ/mol |
|
Gibbs fri energi (Δ f G ⦵ )
|
46,4 kJ/mol |
| Besläktade föreningar | |
|
Besläktade föreningar
|
Litiumaluminiumhydrid , diboran |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Aluminiumhydrid (även känd som alan och aluman) är en oorganisk förening med formeln Al H 3 . Alan och dess derivat är vanliga reducerande ( hydridtillsats ) reagens i organisk syntes som används i lösning i både laboratorie- och industriell skala. I lösning - typiskt i eteriska lösningsmedel såsom tetrahydrofuran eller dietyleter - bildar aluminiumhydrid komplex med Lewis-baser och reagerar selektivt med särskilda organiska funktionella grupper (t.ex. med karboxylsyror och estrar över organiska halogenider och nitrogrupper ), och även om det inte är det ett valfritt reagens kan det reagera med kol-kol multipelbindningar (dvs genom hydroaluminering ). Med tanke på dess densitet, och med en vätehalt i storleksordningen 10 viktprocent, är vissa former av alan, från och med 2016, aktiva kandidater för att lagra väte och så för kraftgenerering i bränslecellstillämpningar, inklusive elfordon. [ inte verifierad i kroppen ] Från och med 2006 noterades det att ytterligare forskning krävdes för att identifiera ett effektivt och ekonomiskt sätt att vända processen, genom att regenerera alan från förbrukad aluminiumprodukt.
Fast aluminiumhydrid, eller alan, är färglös och icke-flyktig, och i sin vanligaste reagensform är den en högpolymeriserad art (dvs. har flera AlH3- enheter som är självassocierade); det smälter vid sönderdelning vid 110 °C. Även om de inte är spontant brandfarliga, kräver fasta ämnen och lösningar av alan försiktighetsåtgärder vid användning som liknar andra lättantändliga metallhydrider , och måste hanteras och förvaras med aktiv uteslutning av fukt. Alan sönderdelas vid exponering för luft (främst på grund av fördelaktig fukt), även om passivering - här, vilket möjliggör utveckling av en inert ytbeläggning - kraftigt minskar nedbrytningshastigheten för alanpreparat. [ inte verifierad i kroppen ]
Form och struktur
Aluminiumhydrid, eller alan, är ett färglöst och icke-flyktigt fast ämne. Det smälter vid sönderdelning vid 110 °C. Den fasta formen uppträder emellertid ofta som en vit fast substans som kan vara gråtonad (med minskande reagenspartikelstorlek eller ökande föroreningsnivåer). [ Citat behövs ] Specifikt, beroende på syntesförhållanden, kan alanens yta passiveras (görs något mindre reaktiv) av ett tunt lager av aluminiumoxid eller -hydroxid. [ citat behövs ]
Eftersom det används under vanliga laboratorieförhållanden är alan "mycket polymeriskt", strukturellt, och dess formel presenteras ibland som (AlH3)n, där värdet eller intervallet för "n" inte är definierat. [ Citat behövs ] Sådana beredningar av alan löser sig i tetrahydrofuran (THF) eller dietyleter (eter). Fast alan kan fällas ut från eter, och hastigheten för att göra så varierar med metoden för framställning av alanlösningen.
Strukturellt kan alan anta många polymorfa former - från och med 2006 fanns det "minst 7 icke-solvatiserade AlH 3- faser" kända: α-, α'-, β-, γ-, ε- och ζ-alaner.; från och med detta datum, [ när? ] ytterligare två, δ- och θ-alaner, har lagts till. [ citat behövs ] Var och en har en annan struktur, med α-alane som den mest termiskt stabila polymorfen. Till exempel, kristallografiskt , . antar α-alane en kubisk eller rhombohedral morfologi, medan α'-alane bildar nålliknande kristaller och γ-alan bildar buntar av smälta nålar Kristallstrukturen för α-alan har bestämts . och har aluminiumatomer omgivna av sex oktaedriskt orienterade väteatomer som överbryggar till sex andra aluminiumatomer (se tabell), där Al-H-avstånden alla är ekvivalenta (172 pm) ) och Al-H-Al-vinkeln är 141°. [ icke-primär källa behövs ]
| Kristallografisk struktur av α-AlH 3 [ icke-primär källa behövs ] | |||||
|---|---|---|---|---|---|
| a-AlH3 - enhetscellen | Aluminiumkoordination | Vätgaskoordination | |||

|

|

|
|||
När β- och γ-alaner produceras tillsammans omvandlas de till α-alan vid upphettning, medan δ-, ε- och θ-alaner produceras under ytterligare andra kristallisationsförhållanden; även om de är mindre termiskt stabila, omvandlas inte 5-, e- och 6-alanpolymorferna till a-alan vid upphettning. [ bättre källa behövs ]
Under speciella förhållanden kan icke-polymera alaner (dvs. molekylära former av det) framställas och studeras. Monomer AlH3 har isolerats vid låg temperatur i en fast ädelgasmatris där den visade sig vara plan. [ icke-primär källa behövs Den ] dimera formen, Al2H6 , har isolerats i fast väte, och den är isostrukturell med diboran ( B2H6 ) och digallan ( Ga2H6 ) . [ icke-primär källa behövs ]
Hantering
Alane är inte spontant brandfarligt. Trots det rekommenderas "liknande hantering och försiktighetsåtgärder som... vidtagits för LiAlH 4 " (det kemiska reagenset, litiumaluminiumhydrid ), eftersom dess "reaktivitet [är] jämförbar" med detta relaterade reducerande reagens. För dessa reagens är både beredningar i lösningar och isolerade fasta ämnen "mycket brandfarliga och måste förvaras i frånvaro av fukt". När det används i standardlaboratoriemängder och preparat används alan i ett dragskåp . [ varför? ] Fasta ämnen av denna reagenstyp har rekommendationer om hantering "i en handskpåse eller torrlåda ". Efter användning försluts lösningsbehållare vanligtvis tätt med åtföljande spolning med vattenfri ("torr") inert gas, t.ex. kväve eller argon, för att utesluta luft (och syre och fukt som den innehåller). [ citat behövs ]
Passivering [ förtydligande behövs ] minskar avsevärt nedbrytningshastigheten förknippad med alanpreparat. [ citat behövs ] Passiverad alan behåller ändå en faroklassificering på 4.3 (kemikalier som i kontakt med vatten avger brandfarliga gaser).
Förberedelse
Aluminiumhydrider och olika komplex därav har länge varit kända. Dess första syntes publicerades 1947, och ett patent för syntesen tilldelades 1999. Aluminiumhydrid framställs genom att behandla litiumaluminiumhydrid med aluminiumtriklorid . Proceduren är komplicerad: uppmärksamhet måste ägnas åt att avlägsna litiumklorid .
- 3 LiAlH4 + AlCl3 → 4 AlH3 + 3 LiCl
Eterlösningen av alan kräver omedelbar användning, eftersom polymert material snabbt fälls ut som ett fast ämne. Aluminiumhydridlösningar är kända för att brytas ned efter 3 dagar. Aluminiumhydrid är mer reaktiv än LiAlH 4 .
Det finns flera andra metoder för framställning av aluminiumhydrid:
- 2 LiAlH 4 + BeCl 2 2 AlH 3 Li 2 BeH 2 Cl 2 2
- + → + LiAlH 4 + H 2 SO 4 → 2 AlH 3 + Li 2 SO 4 + 2 H 2
- 2 LiAlH 4 ZnCl 2 → 2 AlH 3 + 2 LiCl + ZnH 2
- 2 LiAlH 4 + I 2 → 2 AlH 3 + 2 LiI + H 2
Elektrokemisk syntes
Flera grupper har visat att alan kan framställas elektrokemiskt . Olika elektrokemiska alanproduktionsmetoder har patenterats. Elektrokemiskt genererande alan undviker kloridföroreningar. Två möjliga mekanismer diskuteras för bildning av alan i Clasens elektrokemiska cell innehållande THF som lösningsmedel, natriumaluminiumhydrid som elektrolyt, en aluminiumanod och en järntråd (Fe) nedsänkt i kvicksilver (Hg) som katod. Natriumet bildar ett amalgam med Hg-katoden som förhindrar sidoreaktioner och vätet som produceras i den första reaktionen kunde fångas upp och reageras tillbaka med natriumkvicksilveramalgamet för att producera natriumhydrid. Clasens system ger ingen förlust av utgångsmaterial. För olösliga anoder inträffar reaktion 1, medan för lösliga anoder förväntas anodupplösning enligt reaktion 2:
- AlH 4 − - e − → AlH 3 · nTHF + 1 ⁄ 2 H 2
- 3AlH 4 − + Al - 3e − → 4AlH 3 · nTHF
I reaktion 2 förbrukas aluminiumanoden, vilket begränsar produktionen av aluminiumhydrid för en given elektrokemisk cell.
Kristallisationen och utvinningen av aluminiumhydrid från elektrokemiskt genererad alan har visats.
Högtryckshydrering av aluminiummetall
α-AlH 3 kan framställas genom hydrering av aluminiummetall vid 10GPa och 600 °C (1 112 °F). Reaktionen mellan det flytande vätet producerar a-AlH3 som skulle kunna utvinnas under omgivande betingelser.
Reaktioner
Bildning av addukter med Lewis-baser
AlH3 bildar lätt addukter med starka Lewis - baser . Till exempel bildas både 1:1 och 1:2 komplex med trimetylamin . 1:1-komplexet är tetraedriskt i gasfasen, men i fast fas är det dimert med överbryggande vätecentra, (NMe 3 Al(μ-H)) 2 . 1:2-komplexet antar en trigonal bipyramidal struktur . Vissa addukter (t.ex. dimetyletylamin alan, NMe 2 Et · AlH 3 ) sönderdelas termiskt för att ge aluminiummetall och kan ha användning i MOCVD- tillämpningar.
Dess komplex med dietyleter bildas enligt följande stökiometri:
- AlH3 + ( C2H5 ) 2O → H3Al · O ( C2H5 ) 2 _ _
Reaktionen med litiumhydrid i eter ger litiumaluminiumhydrid :
- AlH3 + LiH → LiAlH 4
Minskning av funktionella grupper
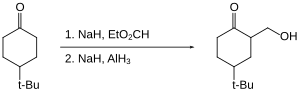
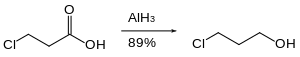
Inom organisk kemi används aluminiumhydrid främst för reduktion av funktionella grupper. På många sätt liknar reaktiviteten för aluminiumhydrid den för litiumaluminiumhydrid . Aluminiumhydrid reducerar aldehyder , ketoner , karboxylsyror , anhydrider , syraklorider , estrar och laktoner till deras motsvarande alkoholer . Amider , nitriler och oximer reduceras till sina motsvarande aminer .
När det gäller funktionell gruppselektivitet skiljer sig alan från andra hydridereagens. Till exempel, i följande cyklohexanonreduktion ger litiumaluminiumhydrid ett trans:cis-förhållande på 1,9 : 1, medan aluminiumhydrid ger ett trans:cis-förhållande på 7,3 : 1.
Alan möjliggör hydroximetylering av vissa ketoner (det vill säga ersättning av CH med C-CH2OH i alfapositionen ) . Ketonen i sig är inte reducerad eftersom den är "skyddad" som sitt enolat.
Organohalider reduceras långsamt eller inte alls av aluminiumhydrid. Därför kan reaktiva funktionella grupper såsom karboxylsyror reduceras i närvaro av halogenider.
Nitrogrupper reduceras inte av aluminiumhydrid. På samma sätt kan aluminiumhydrid åstadkomma reduktionen av en ester i närvaro av nitrogrupper.
Aluminiumhydrid kan användas vid reduktion av acetaler till halvt skyddade dioler.
Aluminiumhydrid kan också användas i epoxidringöppningsreaktion som visas nedan.
SN2 . av aluminiumhydrid är en -reaktion och den är inte steriskt krävande
Aluminiumhydrid kommer att reducera koldioxid till metan med uppvärmning: [ citat behövs ]
- 4 AlH 3 + 3 CO 2 → 3 CH 4 + 2 Al 2 O 3
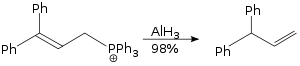
Hydroaluminering
Aluminiumhydrid har visat sig lägga till propargylalkoholer . I likhet med hydroborering kan aluminiumhydrid, i närvaro av titantetraklorid , addera över dubbelbindningar .
Bränsle
I sin passiverade form är alan en aktiv kandidat för lagring av väte och kan användas för effektiv kraftgenerering via bränslecellstillämpningar, inklusive bränslecells- och elfordon och andra lättviktskrafttillämpningar. [ Citat behövs ] AlH 3 innehåller upp till 10,1 viktprocent väte (vid en densitet av 1,48 gram per milliliter), eller två gånger vätedensiteten hos flytande H 2 . [ citat behövs ] Från och med 2006 beskrevs AlH 3 som en kandidat för vilken "ytterligare forskning skulle krävas för att utveckla en effektiv och ekonomisk process för att regenerera [det] från det förbrukade Al-pulvret". [ behöver uppdateras ]
Allane är också en potentiell tillsats till raketbränsle och i explosiva och pyrotekniska sammansättningar. [ citat behövs ] I sin opassiverade form är alan också en lovande raketbränsletillsats , som kan ge impulseffektivitetsvinster på upp till 10 %.
Rapporterade olyckor
En reduktion av trifluorometylförening med alan rapporterades ha orsakat en "[s]erious [e]explosion".
Vidare läsning
- Science Direct Staff (2022). "Alane" . ScienceDirect.com . Amsterdam, Nederländerna: Elsevier BV
- Science Direct Staff (2022). "Aluminiumhydrid" . ScienceDirect.com . Amsterdam, Nederländerna: Elsevier BV
externa länkar
- Aluminiumhydrid på EnvironmentalChemistry.com Chemical Database
- Hydrogen Storage från Brookhaven National Laboratory
- Aluminiumtrihydrid på WebElements