Metanium
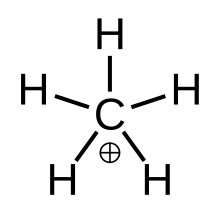 "True" metan, det metastabila övergångstillståndet CH
+ 5 |
|
 Fluxional metanium, CH
3 (H 2 ) + |
|
| Namn | |
|---|---|
| Andra namn karbonium (avskräckt på grund av flera definitioner)
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
|
PubChem CID
|
|
|
|
|
|
| Egenskaper | |
| CH5 + _ | |
| Molar massa | 17.050 g·mol -1 |
| Konjugerad bas | Metan |
| Strukturera | |
| trigonal bipyramidal | |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Inom kemi är metan en komplex positiv jon med formeln [ CH
3 (H
2 ) ] + , nämligen en molekyl med en kolatom bunden till tre väteatomer och en vätemolekyl, som bär en elektrisk laddning av +1 . Det är en supersyra och en av lökjonerna , faktiskt den enklaste karboniumjonen .
Det är mycket instabilt och mycket reaktivt även när det har en hel oktett, vilket ger sina supersura egenskaper.
Metan kan produceras i laboratoriet som en förtärnad gas eller som en utspädd art i supersyror. Den förbereddes för första gången 1950 och publicerades 1952 av Victor Talrose och hans assistent Anna Konstantinovna Lyubimova. Det förekommer som en mellanart i kemiska reaktioner.
Metanjonen är uppkallad efter metan ( CH
4 ), i analogi med härledningen av ammoniumjon ( NH
+ 4 ) från ammoniak ( NH
3 ).
Strukturera
Fluxional metanium kan visualiseras som en CH
+ 3 karbeniumjon med en vätemolekyl som interagerar med den tomma orbitalen i en 3-center-2-elektronbindning . Det bindande elektronparet i H 2 -molekylen delas mellan de två väte- och en kolatom som utgör 3-center-2-elektronbindningen.
De två väteatomerna i H 2 -molekylen kan kontinuerligt byta positioner med de tre väteatomerna i CH
+ 3 -jonen (en konformationsförändring som kallas pseudorotation , närmare bestämt Berry-mekanismen ). Metanjonen anses därför vara en fluxmolekyl . Energibarriären för utbytet är ganska låg och förekommer även vid mycket låga temperaturer .
Infraröd spektroskopi har använts för att få information om metanjonens olika konformationer. IR-spektrumet för vanlig metan har två CH-band från symmetriska och asymmetriska sträckningar vid cirka 3000 cm −1 och två band runt 1400 cm −1 från symmetriska och asymmetriska böjningsvibrationer. I spektrumet av CH
+ 5 förekommer tre asymmetriska sträckningsvibrationer runt 2800–3000 cm −1 , en gungande vibration vid 1300 cm −1 och en böjningsvibration vid 1100 1300 cm −1 .
Förberedelse
Metan kan framställas från metan genom inverkan av mycket starka syror, såsom fluorantimonsyra ( antimonpentafluorid SbF
5 i vätefluorid HF).
Vid cirka 270 Pa tryck och omgivningstemperatur kommer metanjonen CH
+ 4 att reagera med neutral metan för att ge metan och en metylradikal :
-
CH
+ 4 + CH
4 → CH
+ 5 + CH
• 3
Metanjonen kan även framställas i gasfas via reaktionen av metan och en H+-jon (dvs en proton). [ citat behövs ]
CH4 + H + (g ) → CH5 +
Stabilitet och reaktioner
Katjonerna som erhålls genom reaktion av metan med
SbF5 + HF, inklusive metan, stabiliseras genom interaktioner med HF-molekylerna.
Vid låga tryck (cirka 1 mmHg) och omgivningstemperaturer är metan inte reaktivt mot neutral metan.
Se även
- ^ Kemi, internationell union av rent och tillämpat (2009). "karboniumjon" . IUPAC-kompendium för kemisk terminologi . IUPAC-kompendium för kemisk terminologi . IUPAC. doi : 10.1351/goldbook.C00839 . ISBN 978-0-9678550-9-7 . Hämtad 27 november 2018 .
- ^ VL Talrose och AK Lyubimova, Dokl. Akad. Nauk SSSR 86, 909-912 (1952) (På ryska: Тальрозе, В. Л., och А. К. Любимова. "Вторичные процессы в ионном ионном истоспчн." СССР 86 (1952): 909-912)
- ^ Nikolaev, Eugene (1998). "Victor Talrose: en uppskattning". Journal of Mass Spectrometry . 33 (6): 499–501. Bibcode : 1998JMSp...33..499N . doi : 10.1002/(SICI)1096-9888(199806)33:6<499::AID-JMS684>3.0.CO;2-C . ISSN 1076-5174 .
- ^ Rasul, Golam; Prakash, GK Surya; Olah, George A. (2011). "Jämförande studie av de hyperkoordinerade karboniumjonerna och deras boranaloger: En utmaning för spektroskopister". Bokstäver i kemisk fysik . 517 (1–3): 1–8. Bibcode : 2011CPL...517....1R . doi : 10.1016/j.cplett.2011.10.020 .
-
^
Schreiner, Peter R.; Kim, Seung-Joon; Schaefer, Henry F.; von Ragué Schleyer, Paul (1993). " CH
+ 5 : Den oändliga historien eller det sista ordet?". Journal of Chemical Physics . 99 (5): 3716–3720. doi : 10.1063/1.466147 . - ^ Müller, Hendrik; Kutzelnigg, Werner; Noga, Jozef; Klopper, Wim (1997). "CH5+: Historien fortsätter. En explicit korrelerad kopplad klusterstudie". Journal of Chemical Physics . 106 (5): 1863. Bibcode : 1997JChPh.106.1863M . doi : 10.1063/1.473340 .
-
^
Vit Edmund T.; Tang, Jian; Okej, Takeshi (1999). " CH
+ 5 : Det observerade infraröda spektrumet". Vetenskap . 284 (5411): 135–7. Bibcode : 1999Sci...284..135W . doi : 10.1126/science.284.5411.135 . PMID 10102811 . -
^
Oskar Asvany, Padma Kumar P; Redlich, Britta; Hegemann, Ilka; Schlemmer, Stephan; Marx, Dominik (2005). "Förstå det infraröda spektrumet av bar CH
+ 5 ". Vetenskap . 309 (5738): 1219–1222. Bibcode : 2005Sci...309.1219A . doi : 10.1126/science.1113729 . PMID 15994376 . S2CID 28745636 . -
^
Huang, Xinchuan; McCoy, Anne B.; Bowman, Joel M. ; Johnson, Lindsay M.; Savage, Chandra; Dong, Feng; Nesbitt, David J. (2006). "Kvantumdekonstruktion av det infraröda spektrumet av CH
+ 5 " . Vetenskap . 311 (5757): 60–63. Bibcode : 2006Sci...311...60H . doi : 10.1126/science.1121166 . PMID 16400143 . S2CID 26158108 . - ^ Sommer, J.; Jost, R. (2000). "Karbenium- och karboniumjoner i vätske- och fast-supersyrakatalyserad aktivering av små alkaner" ( PDF) . Ren och tillämpad kemi . 72 (12): 2309–2318. doi : 10.1351/pac200072122309 . S2CID 46627813 .
- ^ a b Fält, FH; Munson, MSB (1965). "Reaktioner av gasformiga joner. XIV. Massspektrometriska studier av metan vid tryck till 2 Torr". Journal of the American Chemical Society . 87 (15): 3289–3294. doi : 10.1021/ja01093a001 .