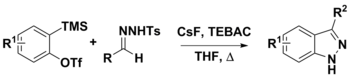Bamford–Stevens reaktion
Bamford –Stevens-reaktionen är en kemisk reaktion där behandling av tosylhydrazoner med stark bas ger alkener . Den är uppkallad efter den brittiske kemisten William Randall Bamford och den skotske kemisten Thomas Stevens Stevens (1900–2000). Användningen av aprotiska lösningsmedel ger övervägande Z- alkener , medan protiska lösningsmedel ger en blandning av E- och Z-alkener. Som en alkengenererande transformation har Bamford-Stevens-reaktionen bred användbarhet i syntetisk metodik och komplex molekylsyntes.
Behandlingen av tosylhydrazoner med alkyllitiumreagens kallas Shapiro-reaktionen .
Reaktionsmekanism
Det första steget i Bamford-Stevens-reaktionen är bildandet av diazoföreningen 3 .
sönderdelas diazoföreningen 3 till karbeniumjonen 5 .
I aprotiska lösningsmedel sönderdelas diazoföreningen 3 till karbenen 7 .
Regisserad Bamford-Stevens reaktion
Bamford-Stevens-reaktionen har inte visat sig användbar för stereoselektiv generering av alkener via termisk sönderdelning av metallerade tosylhydrazoner på grund av den urskillningslösa 1,2-omläggningen av karbencentret, vilket ger en blandning av produkter. Genom att ersätta en alkylgrupp med en trimetylsilyl (TMS) grupp på N-aziridinyliminer kan migration av en specifik väteatom förstärkas. Med kiselatomen beta till H försvagar en σ C-Si → σ * CH stereoelektronisk effekt CH-bindningen, vilket resulterar i dess exklusiva migrering och leder till nästan exklusiv bildning av allylsilaner istället för lika mängder allylsilaner och isomera homoallylsilaner , analogt med blandningen av produkter som ses i dialkylfallet, eller andra insättningsprodukter (dvs cyklopropaner). Se beta-kiseleffekt .
Syntes av 3-substituerade indazoler från aryner och N-tosylhydrazoner
N -tosylhydrazoner kan användas i en mängd olika syntetiska förfaranden. Deras användning med aryner har använts för att framställa 3-substituerade indazoler via två föreslagna vägar. Det första steget är deprotoneringen av hydrazonen av diazoföreningar med användning av CsF. Vid denna tidpunkt kan konjugatbasen antingen sönderdelas för att ge diazoföreningen och genomgå en [3+2] dipolär cykloaddition med arynen för att ge produkten, eller en [3+2] annullering med aryne som också skulle ge slutprodukten . Medan starka baser, såsom LiOtBu och Cs2CO3 ofta används i denna kemi, användes CsF för att underlätta in situ-genereringen av aryner från o-(trimetylsilyl) aryltriflater . CsF ansågs också vara tillräckligt basisk för att deprotonera N-tosylhydrazon.
N -tosylhydrazoner som reagens för korskopplingsreaktioner
Barluenga och medarbetare utvecklade det första exemplet på att använda N-tosylhydrazoner som nukleofila partner i korskopplingsreaktioner. Vanligtvis tenderar nukleofila reagenser i kopplingsreaktioner att vara av den organometalliska sorten, nämligen organomagnesium, -zink, -tenn, -kisel och -bor. I kombination med elektrofila arylhalider kan N-tosylhydrazoner användas för att framställa polysubstituerade olefiner under Pd-katalyserade betingelser utan användning av ofta dyra och syntetiskt krävande organometalliska reagens.
Omfattningen av reaktionen är bred; N-tosylhydrazoner härledda från aldehyder och ketoner tolereras väl, vilket leder till både di- och trisubstituerade olefiner. Dessutom tolereras en mängd olika arylhalider väl som kopplingspartner inklusive de som bär både elektronbortdragande och elektrondonerande grupper, såväl som π-rika och π-bristiga aromatiska heterocykliska föreningar . Stereokemi är ett viktigt element att beakta vid framställning av polysubstituerade olefiner. Användning av hydrazoner härledda från linjära aldehyder resulterade uteslutande i transolefiner, medan de stereokemiska resultaten av trisubstituerade olefiner var beroende av storleken på substituenterna.
00 Mekanismen för denna omvandling tros fortsätta på ett sätt som liknar syntesen av alkener genom Bamford-Stevens-reaktionen; sönderdelningen av N-tosylhydrazoner i närvaro av bas för att generera diazoföreningar som sedan frigör kvävgas, vilket ger en karben, som sedan kan släckas med en elektrofil. I detta fall startar kopplingsreaktionen med den oxidativa tillsatsen av arylhalogeniden till Pd- katalysatorn för att ge aryl-Pd II -komplexet. Reaktionen av diazoföreningen, genererad från hydrazonen, med Pd II -komplexet ger ett Pd-karbenkomplex. En migrerande insättning av arylgruppen ger ett alkyl-Pd-komplex, som genomgår syn- beta-hydrideliminering för att generera transarylolefinen och regenerera Pd- katalysatorn. Denna reaktion har också sett användbarhet vid framställning av konjugerade enyner från N-tosylhydrazoner och terminala alkyner under liknande Pd-katalyserade reaktionsbetingelser och enligt samma mekanism.
Dessutom visade Barluenga och medarbetare en trekomponentskopplingsreaktion i en pott av aldehyder eller ketoner, tosylhydrazider och arylhalider där N - tosylhydrazon bildas in situ. Denna process producerar stereoselektiva olefiner i liknande utbyten jämfört med processen i vilken förformade N -tosylhydrazoner används.
Barluenga och medarbetare utvecklade också metallfri reduktiv kopplingsmetodik för N-tosylhydrazoner med borsyror. Reaktionen tolererar en mängd olika funktionella grupper på båda substraten, inklusive aromatiska, heteroaromatiska, alifatiska, elektrondonerande och elektronbortdragande substituenter, och fortsätter med höga utbyten i närvaro av kaliumkarbonat. Reaktionen tros fortgå genom bildandet av en diazoförening som genereras från ett hydrazonsalt. Diazoföreningen kunde sedan reagera med boronsyran för att producera bensylboronsyran genom en boronatmellanprodukt. En alternativ väg består av bildningen av bensylboronsyran via en zwitterjonisk mellanprodukt, följt av protodeborering av bensylboronsyran under basiska betingelser, vilket resulterar i den slutliga reduktiva produkten.
Denna metodik har också utvidgats till heteroatomnukleofiler för att producera etrar och tioetrar.
En tandem rhodium-katalyserad Bamford-Stevens/termisk alifatisk Claisen-omläggning
En ny process utvecklades av Stoltz där Bamford-Stevens-reaktionen kombinerades med Claisen- omläggningen för att producera en mängd olika olefinprodukter. Denna omvandling fortskrider först genom termisk sönderdelning av N-aziridinylhydrazoner för att bilda diazoföreningen ( 1 ), följt av en rodiummedierad avdiazotisering ( 2 ) och syn 1,2- hydridskiftet ( 3 ). Detta substrat genomgår en termisk alifatisk Claisen-omlagring ( 4 ) för att ge produkten.
Tillämpning på total syntes
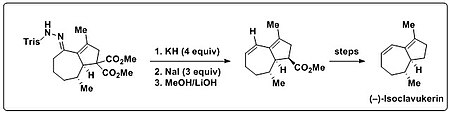
Trost et al. använde Bamford-Stevens-reaktionen i sin totala syntes av (–)-isoclavukerin för att introducera en diendel som finns i naturprodukten. En bicyklisk trisylhydrazon utsattes initialt för Shapiro-reaktionsbetingelser (alkyllitium eller LDA), vilket endast ledde till okarakteriserbara nedbrytningsprodukter. När denna bicykliska trisylhydrazon utsattes för stark bas (KH) och värme, genererades emellertid den önskade dienprodukten. Dessutom visades det att olefingenerering och följande dekarboxylering kunde utföras i en burk. För detta ändamål tillsattes överskott av NaI, tillsammans med en höjning av temperaturen för att underlätta Krapcho-dekarboxyleringen .
- ^ Bamford, WR; Stevens, TS (1952). "924. Nedbrytning av toluen-p-sulfonylhydrazoner med alkali". Journal of the Chemical Society : 4735. doi : 10.1039/JR9520004735 .
- ^ Shapiro, RH (mars 1976). "Alkener från tosylhydrazoner". Organiska reaktioner . Vol. 23. New York: Wiley. s. 405–507. ISBN 0-471-19624-X .
- ^ Adlington, RM; Barrett, AGM (1983). "Senaste tillämpningar av Shapiro-reaktionen". Redovisningar för kemisk forskning . 16 (2): 55. doi : 10.1021/ar00086a004 .
- ^ Creary, X. (1986). "Tosylhydrazonsalt pyroliserar: fenyldiazometaner" . Organiska synteser . 64 : 207. doi : 10.15227/orgsyn.064.0207 . ( även i The Collective Volume (1990) 7 :438 (PDF) )
- ^ Sarkar, T. (1992). "Kiselriktad Bamford-Stevens reaktion av β-Trimethylsilyl N-aziridinylimines". J. Chem. Soc. Chem. Commun. (17): 1184–1185. doi : 10.1039/C39920001184 .
- ^ Lambert, J. (1990). "Interaktionen med kisel med positivt laddat kol". Tetraeder . 46 (8): 2677–2689. doi : 10.1016/s0040-4020(01)88362-9 .
- ^ Jorgensen, W. (1985). "Omfattning och ursprung för beta-kiseleffekten på karbeniumjoner". J. Am. Chem. Soc . 107 (6): 1496–1500. doi : 10.1021/ja00292a008 .
- ^ Feng, S. (2011). "Syntes av 3-substituerade indazoler från Arynes och N-tosylhydrazoner". Org. Lett . 13 (13): 3340–3343. doi : 10.1021/ol201086g . PMID 21630698 .
- ^ Pellissier, H. (2002). "Användningen av arynes i organisk syntes". Tetraeder . 59 (6): 701–730. doi : 10.1016/s0040-4020(02)01563-6 .
- ^ Baruenga, J. (2007). "N-tosylhydrazoner som reagens för korskopplingsreaktioner: en väg till polysubstituerade olefiner". Angew. Chem. Int. Ed . 46 (29): 5587–5590. doi : 10.1002/anie.200701815 . PMID 17577897 .
- ^ Zhihui, S. (2012). "N-Tosylhydrazoner: mångsidiga reagenser för metallkatalyserade och metallfria korskopplingsreaktioner". Chem. Soc. Rev. _ 41 (2): 560–572. doi : 10.1039/c1cs15127d . PMID 21785803 .
- ^ Barluenga, J. (2009). "Metallfri kol-kolbindningsbildande reduktiv koppling mellan borninsyror och tosylhydrazoner". Nat. Chem . 1 (6): 494–499. Bibcode : 2009NatCh...1..494B . doi : 10.1038/nchem.328 . PMID 21378917 . S2CID 35892518 .
- ^ Stoltz, B. (2002). "Non-Carbonyl-Stabilized Metallocarbenoids in Synthesis: The Development of a Tandem Rhodium-Catalyzed Bamford-Stevens/Thermal Aliphatic Claisen Rearrangement Sequence" (PDF ) . J. Am. Chem. Soc . 124 (42): 12426–12427. doi : 10.1021/ja028020j . PMID 12381180 .
- ^ Wood, J. (1999). "Utveckling av en Rhodium Carbenoid-initierad Claisen-omläggning för den enantioselektiva syntesen av a-hydroxikarbonylföreningar". J. Am. Chem. Soc . 121 (8): 1748–1749. doi : 10.1021/ja983294l .
- ^ Trost, BM (1996). "Om diastereoselektiviteten hos intramolekylära Pd-katalyserade TMM-cykloadditioner. En asymmetrisk syntes av Perhydroazulene (–)-isoclavukerin A". J. Am. Chem. Soc . 118 (42): 10094–10105. doi : 10.1021/ja961561m .
- ^ Kurti, L.; Czako, B. (2005). Strategiska tillämpningar av namngivna reaktioner i organisk syntes . El Sevier. ISBN 978-0124297852 .