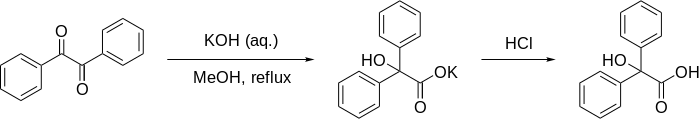
Bensilsyra omarrangemang
Bensilsyraomlagringen är formellt 1,2-omlagringen av 1,2 - diketoner för att bilda α- hydroxi - karboxylsyror med hjälp av en bas . Denna reaktion har fått sitt namn från reaktionen mellan bensil och kaliumhydroxid för att bilda bensilsyra . Först utförd av Justus von Liebig 1838, är det det första rapporterade exemplet på en omarrangeringsreaktion . Det har blivit en klassisk reaktion i organisk syntes och har recenserats många gånger tidigare. Det kan ses som en intramolekylär redoxreaktion , eftersom ett kolcentrum oxideras medan det andra reduceras.
Reaktionen har visat sig fungera i aromatiska , semi-aromatiska, alifatiska och heterocykliska substrat. Reaktionen fungerar bäst när de funktionella ketongrupperna inte har några intilliggande enoliserbara protoner, eftersom detta tillåter aldolkondensation att konkurrera. Reaktionen är formellt en ringkontraktion när den används på cykliska diketoner. Det har visat sig att arylgrupper lättare migrerar än alkylgrupper, och att arylgrupper med elektronbortdragande grupper migrerar snabbast.
Reaktionsmekanism
Reaktionen är en representant för 1,2-omarrangemang. Den sedan länge etablerade reaktionsmekanismen föreslogs först i sin helhet av Christopher Kelk Ingold och har uppdaterats med in silico- data enligt nedan. Reaktionen är av andra ordningen totalt sett vad gäller hastighet, är första ordningen i diketon och första ordningen i bas.
En hydroxidanjon angriper en av ketongrupperna i 1 i en nukleofil addition för att bilda alkoxiden 2 . Nästa steg kräver en bindningsrotation till konformer 3 som placerar den migrerande gruppen R i position för attack på den andra karbonylgruppen. I ett samordnat steg angriper den migrerande R-gruppen a-karbonylgruppen och bildar en annan alkoxid med åtföljande bildning av en ketogrupp vid det andra kolet. Det här migreringssteget är hastighetsbestämmande . Denna sekvens liknar en nukleofil acylsubstitution . Beräkningar visar att när R är metyl kan laddningsuppbyggnaden på denna grupp i övergångstillståndet vara så hög som 0,22 och att metylgruppen är placerad mellan den centrala kolbindningen!
Karboxylsyran i intermediär 4 är mindre basisk än alkoxiden och därför sker reversibel protonöverföring till förmån för intermediär 5 som protoneras vid sur upparbetning till den slutliga α- hydroxi - karboxylsyran 6 . Beräkningar visar att en korrekt beskrivning av reaktionssekvensen är möjlig med deltagande av 4 vattenmolekyler som tar ansvar för stabiliseringen av laddningsuppbyggnaden. De tillhandahåller också en skyttel för effektiv överföring av en proton i bildandet av mellanliggande 5 .
Ovanstående mekanism överensstämmer med alla tillgängliga experimentella bevis. Jämvikten mellan arterna 1 och 2 stöds av 18 O isotopiska märkningsexperiment . I deutererat vatten sker utbyte av karbonylsyre mycket snabbare än omlagringen, vilket indikerar att den första jämvikten inte är det hastighetsbestämmande steget. Ytterligare experiment visade en högre relativ hastighet i ett deutererat lösningsmedelssystem jämfört med ett icke-deutererat lösningsmedelssystem med i övrigt identisk sammansättning. Detta förklarades bero på den större relativa basiciteten hos den deutererade hydroxidanjonen jämfört med den normala hydroxidanjonen, och användes för att indikera att vätemigrering inte inträffade i reaktionssteget för hastighetsbestämning. Detta uteslöt en samordnad mekanism för reaktionen, eftersom väteöverföring skulle ske i det hastighetsbestämmande steget.
Variationer
Benzilic ester omarrangemang
Denna reaktion är identisk med den normala bensilsyraomlagringen, förutom att en alkoxid eller en amidanjon används i stället för en hydroxidjon. Den använda alkoxiden bör inte vara lätt oxiderbar (som kaliumetoxid ) eftersom detta gynnar reduktionsvägen Meerwein–Ponndorf–Verley som en bireaktion. Reaktionen är av andra ordningen totalt sett vad gäller hastighet, är första ordningen vad gäller alkoxid och första ordningen vad gäller diketon. Produkten av reaktionen är en α- hydroxi - ester eller en α-hydroxi- amid .
Alfa-ketol omarrangemang
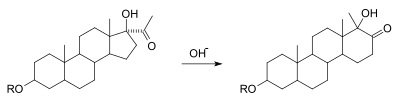
Alfa -ketol-omlagringen är en omvandling av en hydroxyl -alfa till en karbonyl till de komplementära karbonyl- och hydroxylgrupperna, med migrering av en substituent. Det är mekaniskt ekvivalent med bensylsyraomlagringen vid punkten efter att nukleofilen angriper 1,2-dikarbonyl. Denna variation av reaktionen har varit känd för att förekomma i många substrat som bär den funktionella acyloingruppen . Bilden nedan visar ringexpansionen av en cyklopentan till en cyklohexanring som exempel på reaktion.