Paal–Knorr syntes
| Paal-Knorr syntes | |
|---|---|
| Döpt efter |
Carl Paal Ludwig Knorr |
| Reaktionstyp | Ringbildande reaktion |
| Identifierare | |
| RSC ontologi-ID | |
Paal -Knorr-syntesen i organisk kemi är en reaktion som genererar antingen furaner , pyrroler eller tiofener från 1,4-diketoner . Det är en syntetiskt värdefull metod för att erhålla substituerade furaner och pyrroler, vanliga strukturella komponenter i många naturliga produkter. Det rapporterades ursprungligen oberoende av de tyska kemisterna Carl Paal och Ludwig Knorr 1884 som en metod för framställning av furaner, och har anpassats för pyrroler och tiofener. Även om Paal–Knorr-syntesen har sett en utbredd användning, förstods mekanismen inte helt förrän den klargjordes av V. Amarnath et al. på 1990-talet.
Furansyntesen kräver en syrakatalysator:
I pyrrolsyntesen deltar en primär amin :
och i tiofen till exempel föreningen fosforpentasulfid :
Mekanismer
Furan syntes
| Paal-Knorr furan syntes | |
|---|---|
| Identifiers | |
| Organic Chemistry Portal | |
| RSC ontologi ID | |
Den syrakatalyserade furansyntesen fortskrider genom protonering av en karbonyl som angrips av den bildande enolen av den andra karbonylen. Uttorkning av hemiacetalen ger den resulterande furanen.
Mekanismen för Paal-Knorr-furansyntesen klargjordes 1995 av V. Amarnath et al . Amarnaths arbete visade att diastereomererna av 3,4-disubstituerade-2,5-hexandioner reagerar i olika hastigheter. I den allmänt accepterade mekanismen skulle dessa dioner gå igenom en gemensam enolintermediär, vilket innebär att meso- och d,l -racemiska isomerer skulle cyklisera i samma takt som de bildas från en gemensam mellanprodukt. Innebörden av olika reaktioner är att cyklisering måste ske i ett samordnat steg med enolbildning. Sålunda föreslogs att mekanismen skulle ske genom attack av den protonerade karbonylen med den bildande enolen. Amarnath fann också att den oreagerade dionen inte hade genomgått konformationell isomerisering, vilket också indikerade att en enol inte var en mellanprodukt.
Pyrrolsyntes
| Paal-Knorr pyrrolsyntes | |
|---|---|
| Identifierare | |
| Organisk kemi Portal | |
| RSC ontologi ID | |
Mekanismen för syntesen av pyrrolen undersöktes av V. Amarnath et al. 1991. Hans arbete tyder på att den protonerade karbonylen angrips av aminen för att bilda hemiaminal. Aminen angriper den andra karbonylen för att bilda ett 2,5-dihydroxitetrahydropyrrolderivat som genomgår dehydratisering för att ge motsvarande substituerad pyrrol.
Reaktionen körs typiskt under protiska eller Lewis-syrabetingelser, med en primär amin. Användning av ammoniumhydroxid eller ammoniumacetat (som rapporterats av Paal) ger den N-osubstituerade pyrrolen.
Tiofensyntes
| Paal-Knorr tiofensyntes | |
|---|---|
| Identifierare | |
| Organisk kemi Portal | |
| RSC ontologi ID | |
Tiofensyntes uppnås via en mekanism som mycket liknar furansyntesen. Den initiala diketonen omvandlas till en tioketon med ett sulfuriseringsmedel, som sedan genomgår samma mekanism som furansyntesen.
De flesta sulfuriseringsmedel är starka dehydratiseringsmedel och driver fullbordandet av reaktionen. Tidiga postulat mot mekanismen för Paal-Knorr-furansyntesen antydde att tiofenet uppnåddes genom sulfurisering av furanprodukten. Campaigne och Foye visade att behandling av isolerade furaner från Paal-Knorr-furansyntesen med fosforpentasulfid gav inkonsekventa resultat med behandlingen av 1,4-dikarbonyler med fosforpentasulfid, vilket uteslöt sulfurisering av en furanmekanism och antyder att reaktionen fortsätter. via sulfurisering av en dikarbonyl, vilket producerar en tioketon .
Omfattning
Paal–Knorr-reaktionen är ganska mångsidig. I alla synteser kan nästan alla dikarbonyler omvandlas till sin motsvarande heterocykel. R2 och R5 kan vara H, aryl eller alkyl. R3 och R4 kan vara H, aryl, alkyl eller en ester. I pyrrolsyntesen (X = N) kan R1 vara H, aryl, alkyl, amino eller hydroxyl.
En mängd olika tillstånd kan användas för att utföra dessa reaktioner, varav de flesta är milda. Paal-Knorr Furan-syntesen utförs normalt under sura vattenförhållanden med protiska syror såsom vattenhaltig svavelsyra eller saltsyra, eller vattenfria betingelser med en Lewis-syra eller dehydratiseringsmedel. Vanliga dehydratiseringsmedel inkluderar fosforpentoxid , anhydrider eller zinkklorid. Pyrrolsyntesen kräver en primär amin under liknande betingelser, eller så kan ammoniak (eller ammoniakprekursorer) användas. Syntes av en tiofen kräver ett sulfuriseringsmedel som vanligtvis är en tillräcklig dehydratator, såsom fosforpentasulfid , Lawessons reagens eller vätesulfid .
Traditionellt har Paal-Knorr-reaktionen begränsats i omfattning av tillgången på 1,4-diketoner som syntetiska prekursorer. Nuvarande kemiska metoder har avsevärt utökat tillgängligheten för dessa reagens, och variationer av Paal-Knorr tillåter nu att olika prekursorer kan användas. Paal-Knorr ansågs också vara begränsad av hårda reaktionsförhållanden, såsom långvarig uppvärmning i syra, vilket kan försämra känsliga funktioner i många potentiella furanprekursorer. Nuvarande metoder tillåter mildare förhållanden som kan undvika värme helt, inklusive mikrovågskatalyserade cykliseringar.
Variationer
Flera 1,4-dikarbonylsurrogat kan användas i stället för en 1,4-dikarbonyl. Även om dessa substitut har olika strukturer än en 1,4-dikarbonyl, fortskrider deras reaktioner via mekanismer som är mycket lika de hos Paal-Knorr.
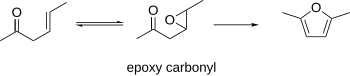
β-epoxikarbonyler
β-epoxikarbonyler har varit kända för att cyklisera till furaner. Denna procedur kan använda β-y-omättade karbonyler som utgångsmaterial, som kan epoxideras. Den resulterande epoxikarbonylen kan cykliseras till en furan under sura eller basiska betingelser.
1,4-diol-2-yn
1,4-diol-2-yn-system har också använts för att göra Paal-Knorr-kemi. Med användning av palladium kan en 1,4-diol-2-yn isomeriseras till motsvarande 1,4-diketon in situ och sedan dehydratiseras till motsvarande furan med användning av ett dehydratiseringsmedel.
Betydelsen av denna variation ligger i det faktum att den ökar omfattningen av Paal-Knorr genom att dra nytta av den rikedom av acetylenkemi som finns, särskilt den för generering av propargylalkoholer.
Acetaler
Acetaler har också visat sig vara användbara utgångsmaterial för Paal-Knorr. En keton med en acetal 3-bindning bort från den kan omvandlas under exakt samma förhållanden som en 1,4-diketon till motsvarande heterocykel.
Mikrovågsstödd Paal–Knorr
En annan variant har varit införandet av mikrovågsstrålning för att förbättra Paal-Knorr. Traditionella Paal-Knorr-förhållanden involverade långvarig uppvärmning av starka syror för att driva uttorkning som inträffade under en period av flera timmar. Mikrovågsstödda Paal-Knorr-reaktioner har visats inträffa på tidsskalor mätt i minuter och i öppna kolvar vid rumstemperatur.
Relaterade reaktioner
Knorr -pyrrolsyntesen , rapporterad av Knorr 1884, är syntesen av en substituerad pyrrol från en aminoketon och en keton.
| Knorr pyrazolsyntes | |
|---|---|
| Döpt efter | Ludwig Knorr |
| Reaktionstyp | Ringbildande reaktion |
| Identifierare | |
| RSC ontologi-ID | |
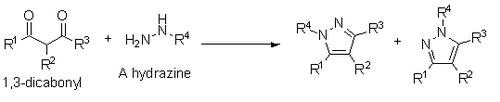
Även rapporterad av Knorr är en syntes av pyrazoler från 1,3-dikarbonyler och hydraziner , hydrazider eller semibikarbazider. Denna syntes sker via en kondensationsmekanism som liknar Paal-Knorr, men om en substituerad hydrazin används resulterar den i en blandning av regioisomerer där den substituerade heteroatomen är antingen bredvid R1-substituenten eller R3-substituenten.
Syntetiska applikationer
År 2000, BM Trost et al. rapporterade en formell syntes av antibiotikumet roseofilin. Trosts väg till den makrocykliska kärnan av roseophilin, liksom andra, förlitade sig på en Paal-Knorr Pyrrole-syntes för att erhålla den sammansmälta pyrrolen. Upphettning av 1,4-diketonen med ammoniumacetat i metanol med kamfersulfonsyra och 4 Ångström molekylsiktar gav pyrrolen utan N-substitution. Denna pyrrol visade sig vara instabil och behandlades som sådan med trimetylsilyletoximetoxiklorid (SEM-Cl) för att skydda pyrrolen före isolering.
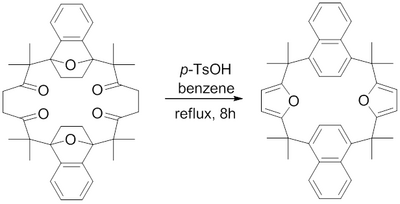
År 1982, H. Hart et al. rapporterade en syntes av en makrocykel innehållande fuserade furanringar med användning av en Paal-Knorr furansyntes. Återloppskokande para -toluensulfonsyra i bensen visade sig dehydratisera 1,4-diketonerna till deras respektive furaner för att uppnå de utmanande makrocykliska fuserade furanerna.