Staudinger syntes
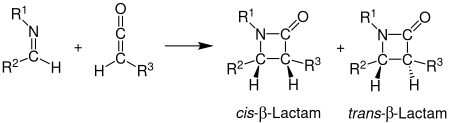
Staudinger- syntesen , även kallad Staudinger-keten-imin-cykloaddition, är en kemisk syntes där en imin 1 reagerar med en keten 2 genom en icke- fotokemisk 2+2 - cykloaddition för att producera en β -laktam 3 . Reaktionen har särskild betydelse vid syntesen av β-laktamantibiotika . Staudinger-syntesen ska inte förväxlas med Staudinger-reaktionen , en fosfin- eller fosfitreaktion som används för att reducera azider till aminer.
Recensioner om mekanismen, stereokemi och tillämpningar av reaktionen har publicerats.
Historia
Reaktionen upptäcktes 1907 av den tyske kemisten Hermann Staudinger . Reaktionen väckte inte intresse förrän på 1940-talet, då penicillinets struktur klargjordes. P -laktamdelen av det första syntetiska penicillinet konstruerades med användning av denna cykloaddition, och den förblir ett värdefullt verktyg i syntetisk organisk kemi .
Mekanism
är en nukleofil attack av iminkvävet på karbonylkolet för att generera en zwitterjonisk mellanprodukt . Elektrondonerande grupper på iminen underlättar detta steg, medan elektronbortdragande grupper hindrar attacken. Det andra steget är antingen en intramolekylär nukleofil ringslutning eller en konrotatorisk elektrocyklisk ringslutning . Det andra steget skiljer sig från typiska elektrocykliska ringslutningar som förutspåtts av Woodward-Hoffmann-reglerna . Under fotokemiska och mikrovågsförhållanden kan intermediärens 4π-elektronsystem inte genomgå en disroterande ringslutning för att bilda β-laktamen, möjligen på grund av att de två dubbelbindningarna inte är i samma plan. Vissa produkter av Staudinger-syntesen skiljer sig från de som förutspås av den torquo-elektroniska modellen. Dessutom skiljer sig den elektroniska strukturen för övergångstillståndet från den för andra konroterande ringförslutningar. Det finns bevis från beräkningsstudier på modellsystem att mekanismen är samordnad i gasfasen.
Stereokemi
Stereokemin för Staudinger-syntesen kan vara svår att förutsäga eftersom båda stegen kan vara hastighetsbestämmande . Om ringslutningssteget är hastighetsbestämmande, är stereokemiska förutsägelser baserade på torkosselektivitet tillförlitliga. Andra faktorer som påverkar stereokemin inkluderar iminens initiala regiokemi. Generellt bildar (E)-iminer cis-β-laktamer medan (Z)-iminer bildar trans-β-laktamer. Andra substituenter påverkar också stereokemin. Ketener med starka elektrondonerande substituenter producerar huvudsakligen cis-β-laktamer, medan ketener med starka elektronbortdragande substituenter i allmänhet producerar trans-β-laktamer. Ketensubstituenten påverkar övergångstillståndet genom att antingen påskynda eller sakta ner utvecklingen mot β-laktamen. En långsammare reaktion möjliggör isomerisering av iminen, vilket i allmänhet resulterar i en transprodukt.
Variationer
Recensioner om asymmetrisk induktion av Staudinger-syntesen, inklusive användningen av organiska och organometalliska katalysatorer, har publicerats.
Iminen kan ersättas genom att tillsätta olefin för att producera en cyklobutanon , karbonyl för att producera en β -lakton , eller karbodiimider för att producera 4-imino β -laktamer . Staudingersyntesen och variationerna är alla ketencykloadditioner .
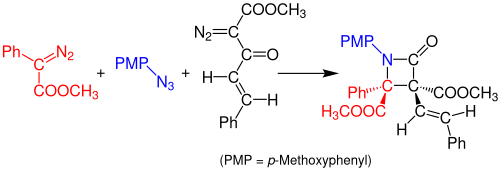
2014 rapporterade Doyle och medarbetare om en Staudinger-syntes med flera komponenter i en pott av β-laktamer från azider och två diazoföreningar. Reaktionen sker genom en rodiumacetat-katalyserad reaktion mellan aryldiazoacetatet (röd) och den organiska aziden (blå) för att bilda en imin. En Wolff-omlagring av diazoacetoacetatenonen (svart) bildar en stabil keten, som reagerar med iminen och bildar en stabil β-laktamförening. Lösningsmedlet som används för denna reaktion är diklormetan (DCM) och lösningen måste vila i 3 timmar vid rumstemperatur. Utbytet av reaktionen är ca 99%.
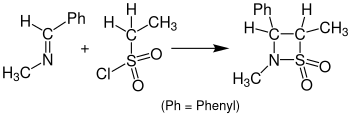
Reaktionen med sulfener istället för ketener som leder till β - sultamer kallas Sulfa-Staudinger cycloaddition . Följande illustration visar ett exempel på Sulfa-Staudinger cykloaddition. Bensylidenmetylamin reagerar med etansulfonylklorid till en β-sultam. För denna reaktion tetrahydrofuran (THF) som lösningsmedel och lösningen behövde vila i 24 timmar.
-
^ a b c
Wright, Stephen i Corey, redigerad av Jie Jack Li; förord av EJ (2010). Namnreaktioner för karbocykliska ringformationer . Hoboken, NJ: Wiley. sid. 45. ISBN 9780470872208 .
{{ citera bok }}:|first=har ett generiskt namn ( hjälp ) - ^ Tidwell, TT (2008). "Hugo (Ugo) Schiff, Schiff-baser och ett århundrade av β-laktamsyntes". Angew. Chem. Int. Ed. 47 (6): 1016–1020. doi : 10.1002/anie.200702965 . PMID 18022986 .
- ^ Fu, N.; Tidwell, TT "Framställning av β-laktamer genom [2+2] cykloaddition av ketener och iminer" Tetrahedron 2008 , 64 , 10465-10496. ( [1] )
- ^ Georg, Gunda I. (1992). Organisk kemi för β-laktamer . New York: Verlag Chemie. ISBN 978-0471187998 .
- ^ a b c d Cossio, FP; Arrieta, A.; Sierra, MG (2008). "Mekanismen för Ketene-Imine (Staudinger) reaktionen i dess hundraårsjubileum: fortfarande ett olöst problem?". Redovisningar för kemisk forskning . 41 (8): 925–936. doi : 10.1021/ar800033j . PMID 18662024 .
- ^ H. Staudinger (1907). "Zur Kenntniss der Ketene. Diphenylketen" . Justus Liebigs Ann. Chem. 356 (1–2): 51–123. doi : 10.1002/jlac.19073560106 .
-
^
JC Sheehan, EL Buhle, EJ Corey , GD Laubach, JJ Ryan (1950). "Den totala syntesen av ett 5-fenylpenicillin: metyl-5-fenyl-(2-karbometoxietyl)-penicillinat". J. Am. Chem. Soc. 72 (8): 3828–9. doi : 10.1021/ja01164a534 .
{{ citera tidskrift }}: CS1 underhåll: flera namn: lista över författare ( länk ) -
^
Wright, Stephen i Corey, redigerad av Jie Jack Li; förord av EJ (2010). Namnreaktioner för karbocykliska ringformationer . Hoboken, NJ: Wiley. sid. 47. ISBN 9780470872208 .
{{ citera bok }}:|first=har ett generiskt namn ( hjälp ) - ^ Qi, Hengzhen; Li, Xinyao; Xu, Jiaxi (december 2010). "Stereoselektiv kontroll i Staudinger-reaktionerna som involverar monosubstituerade ketener med elektronacceptorsubstituenter: experimentell undersökning och teoretisk rationalisering" . Organisk och biomolekylär kemi . 9 (8): 2702–2714. doi : 10.1039/C0OB00783H . PMID 21359284 . S2CID 37085450 .
- ^ Liang, Yong; Jiao, Lei; Zhang, Shiwei; Xu, Jiaxi (2005). "Mikrovågs- och fotobestrålningsinducerade Staudinger-reaktioner av cykliska iminer och ketener genererade från α-Diazoketoner. En ytterligare undersökning av den stereokemiska processen". Journal of Organic Chemistry . 70 (1): 334–337. doi : 10.1021/jo048328o . PMID 15624943 .
- ^ a b c Jiao, Lei; Liang, Yong; Xu, Jiaxi (2006). "Ursprunget till den relativa stereoselektiviteten hos β-laktambildningen i Staudinger-reaktionen". Journal of the American Chemical Society . 128 (18): 6060–6069. doi : 10.1021/ja056711k . PMID 16669675 .
- ^ a b Liang, Yong; Jiao, Lei; Zhang, Shiwei; Yu, Zhi-Xiang; Xu, Jiaxi (2009). "Nya insikter i Staudinger-reaktionens Torquoselectivity". Journal of the American Chemical Society . 131 (4): 1542–1549. doi : 10.1021/ja808046e . PMID 19132931 .
- ^ Palomo, Claudio; Aizpurua, Jesus M.; Ganboa, Iñaki; Oiarbide, Mikel (1999). "Asymmetrisk syntes av β-laktamer av Staudinger Ketene-Imine Cycladdition Reaction". European Journal of Organic Chemistry . 1999 (12): 3223–3235. doi : 10.1002/(SICI)1099-0690(199912)1999:12<3223::AID-EJOC3223>3.0.CO;2-1 .
- ^ Mandler, Michael D.; Truong, Phong M.; Zavalij, Peter Y.; Doyle, Michael P. (2014). "Katalytisk omvandling av diazokarbonylföreningar till iminer". Organiska bokstäver . 16 (3): 740–743. doi : 10.1021/ol403427s . PMID 24423056 .
- ^ Yang, Zhanhui; Chen, Ning; Xu, Jiaxi (2015). "Substituentkontrollerad annuloselektivitet och stereoselektivitet i Sulfa-Staudinger Cycladditions". The Journal of Organic Chemistry . 80 (7): 3611–3620. doi : 10.1021/acs.joc.5b00312 . ISSN 0022-3263 . PMID 25756543 .