Baeyer–Villiger-oxidation
| Baeyer-Villiger oxidation | |
|---|---|
| Döpt efter |
Adolf von Baeyer Victor Villiger |
| Reaktionstyp | Organisk redoxreaktion |
| Identifierare | |
| Organic Chemistry Portal | |
| RSC ontologi-ID | |
Baeyer -Villiger-oxidationen är en organisk reaktion som bildar en ester från en keton eller en lakton från en cyklisk keton, med peroxisyror eller peroxider som oxidant . Reaktionen är uppkallad efter Adolf von Baeyer och Victor Villiger som först rapporterade reaktionen 1899.
Reaktionsmekanism
I det första steget av reaktionsmekanismen protonerar peroxisyran syret i karbonylgruppen . Detta gör karbonylgruppen mer mottaglig för att attackeras av peroxisyran. Därefter angriper peroxisyran kolet i karbonylgruppen och bildar det som kallas Criegee-mellanprodukten . Genom en samordnad mekanism migrerar en av substituenterna på ketongruppen till syret i peroxidgruppen medan en karboxylsyra lämnar. Detta migreringssteg anses vara hastighetsbestämmande steg . Slutligen producerar deprotonering av oxokarbeniumjonen estern .
Produkterna från Baeyer-Villiger-oxidationen tros kontrolleras genom både primära och sekundära stereoelektroniska effekter . Den primära stereoelektroniska effekten i Baeyer-Villiger-oxidationen hänvisar till nödvändigheten av att syre-syrebindningen i peroxidgruppen är antiperiplanär mot gruppen som migrerar. Denna orientering underlättar optimal överlappning av den migrerande gruppens 𝛔-omloppsbana till peroxidgruppens 𝛔*-omloppsbana . Den sekundära stereoelektroniska effekten hänvisar till behovet av det ensamma paret på syret i hydroxylgruppen ska vara antiperiplanär mot den migrerande gruppen. Detta möjliggör optimal överlappning av den syrefria orbitalen med den migrerande gruppens 𝛔* orbital. Detta migreringssteg är också (åtminstone i silico ) assisterat av två eller tre peroxisyraenheter som gör det möjligt för hydroxylprotonen att skjuta till sin nya position.
Migrationsförmågan rankas tertiär > sekundär > aryl > primär. Allylgrupper är mer benägna att migrera än primära alkylgrupper men mindre än sekundära alkylgrupper. Elektronbortdragande grupper på substituenten minskar migrationshastigheten. Det finns två förklaringar till denna trend i migrationsförmåga. En förklaring bygger på uppbyggnaden av positiv laddning i övergångstillståndet för nedbrytning av Criegee-mellanprodukten (illustrerad av karbokatationsresonansstrukturen av Criegee-mellanprodukten). Med denna struktur i åtanke är det vettigt att den substituent som bäst kan bibehålla positiv laddning är mest sannolikt att migrera. Ju högre substitutionsgrad, desto stabilare är en karbokatation i allmänhet. Därför observeras den tertiära > sekundära > primära trenden.
En annan förklaring använder stereoelektroniska effekter och steriska argument. Som nämnts kommer substituenten som är antiperiplanär mot peroxidgruppen i övergångstillståndet att migrera. Detta övergångstillstånd har en gauche-interaktion mellan peroxisyran och den icke-migrerande substituenten. Om den skrymmande gruppen placeras antiperiplanärt mot peroxidgruppen, kommer gauche-interaktionen mellan substituenten på den bildade estern och karbonylgruppen i peroxisyran att reduceras. Således är det den mer skrymmande gruppen som föredrar att vara antiperiplanär mot peroxidgruppen, vilket ökar dess förmåga att migration.
Den migrerande gruppen i acykliska ketoner är vanligtvis inte 1° alkylgrupp. De kan dock övertalas att migrera i stället för 2°- eller 3°-grupperna genom att använda CF 3 CO 3 H eller BF 3 + H 2 O 2 som reagens.
Historisk bakgrund
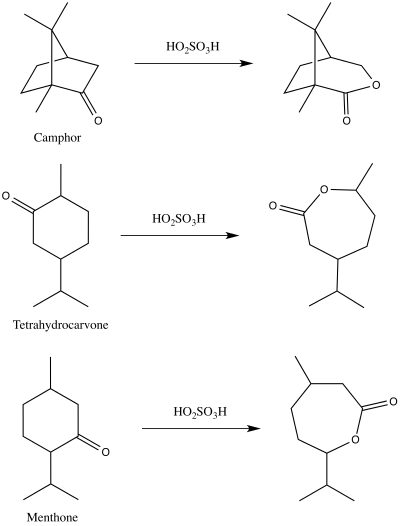
År 1899 publicerade Adolf Baeyer och Victor Villiger först en demonstration av reaktionen som vi nu känner som Baeyer–Villiger-oxidationen. De använde peroximonosvavelsyra för att göra motsvarande laktoner från kamfer , menton och tetrahydrokarvon.
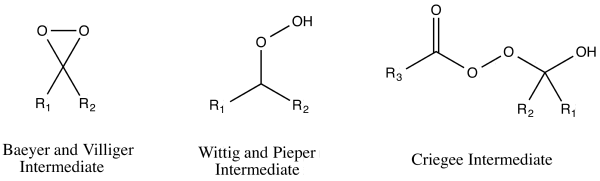
Det fanns tre föreslagna reaktionsmekanismer för Baeyer-Villiger-oxidationen som tycktes passa med observerade reaktionsresultat. Dessa tre reaktionsmekanismer kan verkligen delas upp i två vägar för peroxisyraangrepp - på antingen syret eller kolet i karbonylgruppen . Angrepp på syre kan leda till två möjliga mellanprodukter : Baeyer och Villiger föreslog en dioxiranmellanprodukt , medan Georg Wittig och Gustav Pieper föreslog en peroxid utan dioxiranbildning. Kolangrepp föreslogs av Rudolf Criegee . På denna väg attackerar persyran karbonylkolet och producerar det som nu är känt som Criegee-mellanprodukten .
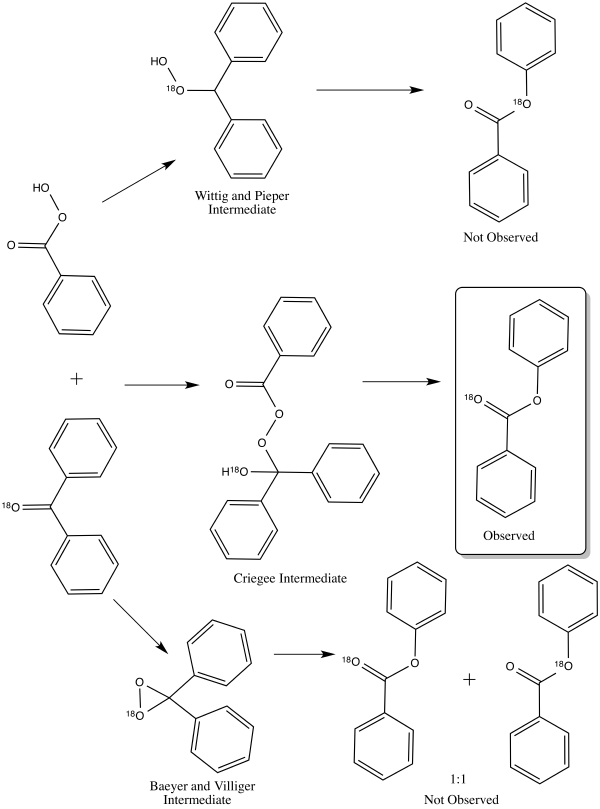
År 1953 klargjorde William von Eggers Doering och Edwin Dorfman den korrekta vägen för reaktionsmekanismen för Baeyer-Villiger-oxidationen genom att använda syre-18 -märkning av bensofenon . De tre olika mekanismerna skulle var och en leda till olika distribution av märkta produkter. Criegee-mellanprodukten skulle leda till en produkt endast märkt på karbonylsyren. Produkten av Wittig och Pieper-mellanprodukten är endast märkt på alkoxigruppen av estern. Baeyer- och Villiger-mellanprodukten leder till en 1:1-fördelning av båda ovanstående produkter. Resultatet av märkningsexperimentet stödde Criegee-mellanprodukten, som nu är den allmänt accepterade vägen.
Stereokemi
Migrationen förändrar inte stereokemin hos gruppen som överförs, dvs: den är stereoretentiv .
Reagens
inkluderar några av de vanligare oxidanterna meta -klorperbensoesyra (mCPBA) och trifluorperättiksyra (TFPAA). Den allmänna trenden är att högre reaktivitet är korrelerad med lägre pKa ( dvs : starkare surhet) av motsvarande karboxylsyra (eller alkohol i fallet med peroxiderna). Därför visar reaktivitetstrenden TFPAA > 4-nitroperbensoesyra > mCPBA och permyrsyra > perättiksyra > väteperoxid > tert-butylhydroperoxid . Peroxiderna är mycket mindre reaktiva än peroxisyrorna. Användningen av väteperoxid kräver till och med en katalysator . Dessutom tenderar användning av organiska peroxider och väteperoxid att generera mer sidreaktivitet på grund av deras promiskuitet.
Begränsningar
Användningen av peroxisyror och peroxider när du utför Baeyer–Villiger-oxidationen kan orsaka oönskad oxidation av andra funktionella grupper . Alkener och aminer är några av de grupper som kan oxideras . Till exempel kan alkener i substratet, särskilt när de är elektronrika, oxideras till epoxider . Metoder har dock utvecklats som möjliggör tolerans för dessa funktionella grupper. 1962 rapporterade GB Payne att användningen av väteperoxid i närvaro av en selenkatalysator kommer att producera epoxiden från alkenylketoner, medan användning av peroxiättiksyra kommer att bilda estern.
Ändringar
Katalytisk Baeyer-Villiger-oxidation
Användningen av väteperoxid som oxidationsmedel skulle vara fördelaktigt, vilket gör reaktionen mer miljövänlig eftersom den enda biprodukten är vatten. Bensenseleninsyraderivat som katalysatorer har rapporterats ge hög selektivitet med väteperoxid som oxidant. En annan klass av katalysatorer som uppvisar hög selektivitet med väteperoxid som oxidant är fasta Lewis-syrakatalysatorer såsom stannosilikater. Bland stannosilikater visar särskilt zeotypen Sn-beta och den amorfa Sn-MCM-41 lovande aktivitet och nära till full selektivitet mot den önskade produkten.
Asymmetrisk Baeyer-Villiger oxidation
Det har gjorts försök att använda organometalliska katalysatorer för att utföra enantioselektiva Baeyer-Villiger-oxidationer. Det första rapporterade fallet av en sådan oxidation av en prokiral keton använde dioxygen som oxidant med en kopparkatalysator. Andra katalysatorer, inklusive platina- och aluminiumföreningar, följde.
Baeyer-Villiger monooxygenaser
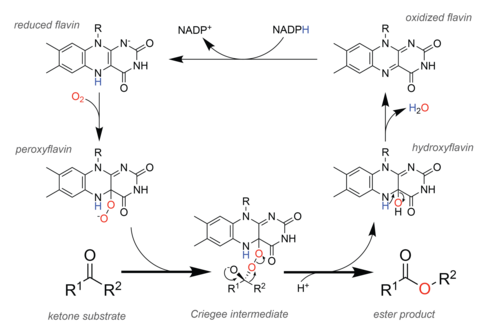
I naturen utför enzymer som kallas Baeyer-Villiger monooxygenaser (BVMOs) oxidationen analogt med den kemiska reaktionen. För att underlätta denna kemi innehåller BVMOs en flavinadenindinukleotid (FAD) kofaktor . I den katalytiska cykeln (se figuren till höger) reducerar den cellulära redoxekvivalenten NADPH först kofaktorn, vilket gör att den därefter kan reagera med molekylärt syre . Det resulterande peroxiflavinet är den katalytiska enheten som syresätter substratet , och teoretiska studier tyder på att reaktionen fortskrider genom samma Criegee-mellanprodukt som observerades i den kemiska reaktionen. Efter omlagringssteget som bildar esterprodukten finns en hydroxiflavin kvar, som spontant eliminerar vatten för att bilda oxiderad flavin, och därigenom stänger den katalytiska cykeln.
BVMOs är nära besläktade med de flavininnehållande monooxygenaserna (FMOs) , enzymer som också förekommer i människokroppen och fungerar i leverns metaboliska avgiftningssystem i frontlinjen längs cytokrom P450 monooxygenaserna . Human FMO5 visade sig faktiskt kunna katalysera Baeyer-Villiger-reaktioner, vilket indikerar att reaktionen kan inträffa även i människokroppen.
BVMO har studerats brett på grund av deras potential som biokatalysatorer , det vill säga för en tillämpning i organisk syntes. Med tanke på miljöhänsynen för de flesta av de kemiska katalysatorerna anses användningen av enzymer vara ett grönare alternativ. Speciellt BVMO är intressanta för tillämpning eftersom de uppfyller en rad kriterier som vanligtvis eftersträvas inom biokatalys: förutom deras förmåga att katalysera en syntetiskt användbar reaktion, finns vissa naturliga homologer . visade sig ha en mycket stor substratomfattning (dvs. deras reaktivitet var inte begränsad till en enskild förening, vilket ofta antas vid enzymkatalys), kan de lätt produceras i stor skala, och eftersom den tredimensionella strukturen hos många BVMO har bestämts, kunde enzymteknik tillämpas för att producera varianter med förbättrad termostabilitet och/eller reaktivitet. En annan fördel med att använda enzymer för reaktionen är deras ofta observerade regio- och enantioselektivitet, tack vare den steriska kontrollen av substratorientering under katalys inom enzymets aktiva plats .
Ansökningar
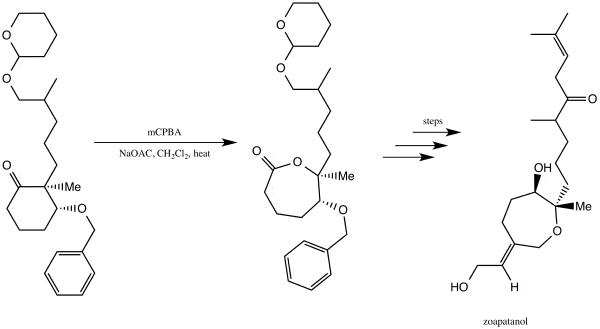
Zoapatanol
Zoapatanol är en biologiskt aktiv molekyl som förekommer naturligt i zeopatleväxten, som har använts i Mexiko för att göra ett te som kan framkalla menstruation och förlossning. 1981 rapporterade Vinayak Kane och Donald Doyle en syntes av zoapatanol. De använde Baeyer-Villiger-oxidationen för att göra en lakton som fungerade som en avgörande byggsten som i slutändan ledde till syntesen av zoapatanol.
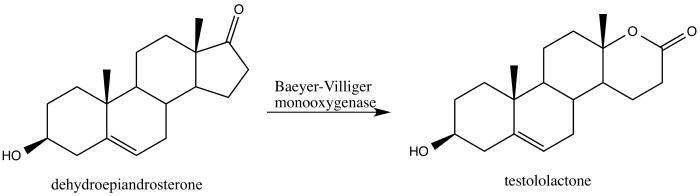
Steroider
2013 rapporterade Alina Świzdor omvandlingen av steroiden dehydroepiandrosteron till anticancermedlet testololakton genom användning av en Baeyer-Villiger-oxidation inducerad av svamp som producerar Baeyer-Villiger-monooxygenaser.