Hyperkonjugering
Inom organisk kemi hänvisar hyperkonjugering ( σ-konjugation eller no-bond- ) resonans till delokalisering av elektroner med deltagande av bindningar av i första hand σ-karaktär . Vanligtvis involverar hyperkonjugering interaktionen av elektronerna i en sigma (σ) orbital (t.ex. C–H eller C–C) med en intilliggande obefolkad icke-bindande p eller antibindande σ* eller π* orbitaler för att ge ett par förlängda molekylära orbitaler . Men ibland kan lågt liggande antibindande σ*-orbitaler också interagera med fyllda orbitaler av ensamparkaraktär (n) i vad som kallas negativ hyperkonjugation . Ökad elektrondelokalisering associerad med hyperkonjugering ökar stabiliteten i systemet. I synnerhet stabiliseras den nya orbitalen med bindningskaraktär, vilket resulterar i en total stabilisering av molekylen. Endast elektroner i bindningar som är i β-position kan ha den här typen av direkt stabiliserande effekt - donerar från en sigmabindning på en atom till en orbital i en annan atom direkt kopplad till den. Men utökade versioner av hyperkonjugering (som dubbel hyperkonjugering) kan också vara viktiga. Baker -Nathan-effekten , som ibland används synonymt för hyperkonjugering, är en specifik tillämpning av den på vissa kemiska reaktioner eller typer av strukturer.
Ansökningar
Hyperkonjugering kan användas för att rationalisera en mängd olika kemiska fenomen, inklusive den anomeriska effekten , gaucheeffekten , rotationsbarriären av etan , beta-kiseleffekten , vibrationsfrekvensen för exocykliska karbonylgrupper och den relativa stabiliteten hos substituerade karbokater och substituerade kolcentrerade radikaler och den termodynamiska Zaitsevs regel för alkenstabilitet. Mer kontroversiellt föreslås hyperkonjugering av kvantmekanisk modellering för att vara en bättre förklaring för preferensen för den förskjutna konformationen snarare än den gamla läroboksuppfattningen om steriskt hinder .
Effekt på kemiska egenskaper
Hyperkonjugering påverkar flera egenskaper.
- Bindningslängd : Hyperkonjugering föreslås som en nyckelfaktor för att förkorta sigma-bindningar (σ-bindningar). Till exempel är de enkla C–C-bindningarna i 1,3-butadien och propyn cirka 1,46 Å långa, mycket mindre än värdet på cirka 1,54 Å som finns i mättade kolväten . För butadien kan detta förklaras som normal konjugering av de två alkenyldelarna. Men för propyn är det allmänt accepterat att detta beror på hyperkonjugering mellan alkyl- och alkynyldelarna.
- Dipolmoment : Den stora ökningen av dipolmoment för 1,1,1-trikloretan jämfört med kloroform kan tillskrivas hyperkonjugerade strukturer.
- Värmen för bildning av molekyler med hyperkonjugation är större än summan av deras bindningsenergier och hydreringsvärmen per dubbelbindning är mindre än hydreringsvärmen för eten .
- Stabilitet av karbokatjoner :
- (CH 3 ) 3 C + > (CH 3 ) 2 CH + > (CH 3 )CH 2 + > CH 3 +
- De tre C–H σ-bindningarna av metylgruppen(erna) fästa till karbokatjonen kan genomgår stabiliseringsinteraktionen men endast en av dem kan anpassas perfekt med den tomma p-orbitalen, beroende på konformationen av kol-kolbindningen. Donation från de två feljusterade C–H-bindningarna är svagare. Ju fler intilliggande metylgrupper det finns, desto större hyperkonjugationsstabilisering beror på det ökade antalet intilliggande CH-bindningar.
Hyperkonjugering i omättade föreningar
Hyperkonjugering föreslogs som orsaken till den ökade stabiliteten av kol-kol dubbelbindningar när graden av substitution ökar. Tidiga studier i hyperkonjugation utfördes av i forskargruppen George Kistiakowsky . Deras arbete, som först publicerades 1937, var tänkt som en preliminär lägesrapport för termokemiska studier av energiförändringar under additionsreaktioner av olika omättade och cykliska föreningar. Vikten av hyperkonjugering för att förklara denna effekt har fått stöd från kvantkemiska beräkningar. Nyckelinteraktionen tros vara donationen av elektrondensitet från den angränsande C–H σ-bindningen till alkenens π* antibindande orbital (σ C–H →π*). Effekten är nästan en storleksordning svagare än fallet med alkylsubstitution på karbokatjoner (σ C–H →p C ), eftersom en ofylld p-orbital har lägre energi och därför bättre energimässigt anpassad till en σ-bindning. När denna effekt manifesterar sig i bildandet av den mer substituerade produkten i termodynamiskt kontrollerade El-reaktioner, är det känt som Zaitsevs regel , även om den kinetiska produkten i många fall också följer denna regel. ( Se Hofmanns regel för fall där den kinetiska produkten är den mindre substituerade. )
En uppsättning experiment av Kistiakowsky involverade insamlade värme av hydrogeneringsdata under gasfasreaktioner av en rad föreningar som innehöll en alkenenhet . När man jämförde en rad monoalkyl - substituerade alkener fann de att alla alkylgrupper märkbart ökade stabiliteten, men att valet av olika specifika alkylgrupper hade liten eller ingen effekt.
En del av Kistiakowskys arbete involverade en jämförelse av andra omättade föreningar i form av CH2 = CH(CH2 ) n-CH=CH2 ( n=0,1,2). Dessa experiment avslöjade ett viktigt resultat; när n=0 finns det en effekt av konjugering till molekylen där AH-värdet sänks med 3,5 kcal . Detta liknas vid tillägg av två alkylgrupper till eten. Kistiakowsky undersökte också öppna kedjesystem, där det största värdet av frigjord värme visade sig vara under tillsatsen till en molekyl i 1,4-position. Cykliska molekyler visade sig vara de mest problematiska, eftersom det visade sig att stammen av molekylen skulle behöva beaktas. Stammen av femledade ringar ökade med en minskad grad av omättnad. Detta var ett överraskande resultat som undersöktes ytterligare i senare arbete med cykliska syraanhydrider och laktoner . Cykliska molekyler som bensen och dess derivat studerades också, eftersom deras beteende skilde sig från andra omättade föreningar.
Trots grundligheten i Kistiakowskys arbete var det inte komplett och behövde ytterligare bevis för att backa upp hans fynd. Hans arbete var ett avgörande första steg till början av idéerna om hyperkonjugation och konjugationseffekter.
Stabilisering av 1,3-butadiyn och 1,3-butadien
Konjugationen av 1,3- butadien utvärderades först av Kistiakowsky, ett konjugativt bidrag på 3,5 kcal/mol hittades baserat på den energiska jämförelsen av hydrering mellan konjugerade arter och okonjugerade analoger. Rogers som använde metoden som först tillämpades av Kistiakowsky, rapporterade att konjugationsstabiliseringen av 1,3-butadiyn var noll, eftersom skillnaden mellan Δ hyd H mellan första och andra hydrogenering var noll. Hydrogeneringsvärmen (Δ hyd H) erhölls genom beräkningsmetod G3(MP2) kvantkemi.
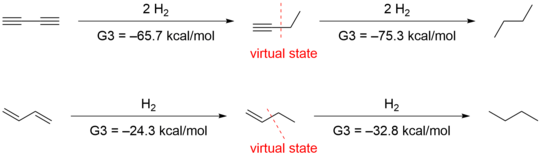
En annan grupp ledd av Houk föreslog att de metoder som Rogers och Kistiakowsky använde var olämpliga, eftersom jämförelser av hydreringsvärme utvärderar inte bara konjugationseffekter utan även andra strukturella och elektroniska skillnader. De erhöll -70,6 kcal/mol och -70,4 kcal/mol för den första respektive andra hydreringen genom ab initio- beräkning, vilket bekräftade Rogers data. Men de tolkade data olika genom att ta hänsyn till hyperkonjugationsstabiliseringen. För att kvantifiera hyperkonjugationseffekten designade de följande isodesmiska reaktioner i 1-butyn och 1-buten .
Att ta bort de hyperkonjugativa interaktionerna ger virtuella tillstånd som har energier som är 4,9 och 2,4 kcal/mol högre än för 1-butyn respektive 1-buten . Användning av dessa virtuella tillstånd resulterar i en 9,6 kcal/mol konjugativ stabilisering för 1,3-butadiyn och 8,5 kcal/mol för 1,3-butadien.
Trender inom hyperkonjugering
Ett relativt färskt arbete (2006) av Fernández och Frenking (2006) sammanfattade trenderna i hyperkonjugering mellan olika grupper av acykliska molekyler, med hjälp av energinedbrytningsanalys eller EDA. Fernández och Frenking definierar denna typ av analys som "...en metod som endast använder pi-orbitaler för de interagerande fragmenten i molekylens geometri för att uppskatta pi-interaktioner." För denna typ av analys är bildningen av bindningar mellan olika molekyldelar en kombination av tre komponenttermer. ΔE elstat representerar vad Fernández och Frenking kallar en molekyls "kvasiklassiska elektrostatiska attraktioner." Den andra termen, ΔE Pauli , representerar molekylens Pauli-repulsion. ΔE orb , den tredje termen, representerar stabiliserande interaktioner mellan orbitaler, och definieras som summan av ΔE pi och ΔE sigma . Den totala interaktionsenergin, ΔE int , är resultatet av summan av de 3 termerna.
En grupp vars ΔE pi -värden analyserades mycket noggrant var en grupp av enoner som varierade i substituent.
Fernández och Frenking rapporterade att metyl- , hydroxyl- och aminosubstituenterna resulterade i en minskning av ΔE pi från moder- 2-propenalen . Omvänt halidsubstituenter med ökande atommassa i ökande AEpi . Eftersom både enone-studien och Hammett -analysen studerar substituenteffekter (även om det är i olika arter), ansåg Fernández och Frenking att en jämförelse mellan de två för att undersöka möjliga trender kan ge betydande insikt i deras egna resultat. De observerade ett linjärt samband mellan ΔE pi -värdena för de substituerade enonerna och motsvarande Hammett-konstanter. Lutningen på grafen visade sig vara -51,67, med en korrelationskoefficient på -0,97 och en standardavvikelse på 0,54. Fernández och Frenking drar slutsatsen från dessa data att ... "de elektroniska effekterna av substituenterna R på pi-konjugering i homo- och heterokonjugerade system är likartade och verkar därför vara ganska oberoende av det konjugerande systemets natur."
Rotationsbarriär av etan
där hyperkonjugering kan förbises som en möjlig kemisk förklaring är att rationalisera rotationsbarriären för etan ( C2H6 ) . Det hade accepterats så tidigt som på 1930-talet att de förskjutna konformationerna av etan var mer stabila än den förmörkade konformationen . Wilson hade bevisat att energibarriären mellan ett par av förmörkade och förskjutna konformationer är ungefär 3 kcal/mol, och det allmänt accepterade skälet till detta var de ogynnsamma steriska interaktionerna mellan väteatomer.
I deras papper från 2001 avslöjade Pophristic och Goodman dock att denna förklaring kan vara för enkel. Goodman fokuserade på tre huvudsakliga fysikaliska faktorer: hyperkonjugativa interaktioner, utbytesrepulsion definierad av Pauli-uteslutningsprincipen och elektrostatiska interaktioner ( Coulomb-interaktioner ). Genom att jämföra en traditionell etanmolekyl och en hypotetisk etanmolekyl med alla utbytesrepulsioner borttagna, framställdes potentiella kurvor genom att plotta vridningsvinkel mot energi för varje molekyl. Analysen av kurvorna fastställde att den förskjutna konformationen inte hade någon koppling till mängden elektrostatiska repulsioner inom molekylen. Dessa resultat visar att coulombiska krafter inte förklarar de gynnade förskjutna konformationerna, trots det faktum att central bindningssträckning minskar elektrostatiska interaktioner.
Goodman genomförde också studier för att fastställa bidraget av vicinala (mellan två metylgrupper) kontra geminala (mellan atomerna i en enda metylgrupp) interaktioner till hyperkonjugering. I separata experiment togs de geminala och vicinala interaktionerna bort, och den mest stabila konformern för varje interaktion härleddes.
| Raderad interaktion | Torsionsvinkel | Motsvarande konformer |
|---|---|---|
| Ingen | 60° | Förskjuten |
| All hyperkonjugering | 0° | Förmörkad |
| Vicinal hyperkonjugering | 0° | Förmörkad |
| Geminal hyperkonjugering | 60° | Förskjuten |
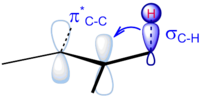
Från dessa experiment kan man dra slutsatsen att hyperkonjugativa effekter delokaliserar laddning och stabiliserar molekylen. Vidare är det de vicinala hyperkonjugativa effekterna som håller molekylen i den förskjutna konformationen. Tack vare detta arbete är följande modell för stabilisering av den förskjutna konformationen av etan nu mer accepterad:
Hyperkonjugering kan också förklara flera andra fenomen vars förklaringar kanske inte heller är lika intuitiva som den för rotationsbarriären av etan.
Frågan om rotationsbarriären av etan är inte avgjord inom det vetenskapliga samfundet. En analys inom kvantitativ molekylär orbitalteori visar att 2-orbital-4-elektron (steriska) repulsioner är dominerande över hyperkonjugering. En av valensbindningsteori betonar också vikten av steriska effekter.